茯苓多酚氧化酶酶学特性及褐变抑制*
2014-12-16陈红梅谢翎
陈红梅,谢翎
(安庆师范学院生命科学学院,安徽安庆,246011)
茯苓,俗称松苓、云苓,为担子菌纲多孔菌科茯苓属(Poria cocos(Schw.)Wolf),大多寄生于松科植物马尾松或赤松根部,为传统中药,具有利水渗湿、益脾健胃、宁心安神,增强机体免疫等功能[1]。茯苓富含茯苓多糖、茯苓酸、三萜羧酸、月桂酸等成分[2-3],具有很高的药用和营养价值。安徽省安庆市岳西县隶属于大别山区,是茯苓主要栽培基地[4],年产茯苓达100多万kg。茯苓深加工产业带动了地方经济的发展,但是,茯苓在加工过程中,较易发生褐变,从而影响了茯苓的外观品质。
多酚氧化酶(polyphenol oxidase,PPO,E.C.1.10.3.1)是一种含铜的末端氧化还原酶,广泛存在于植物、动物和微生物体内[5]。多酚氧化酶因能作用于酚,使之转化为醌类物质,醌类物质之间相互聚合生成褐色素,而使植物组织呈现褐色[6-7],这样,PPO成为植物体内引起酶促褐变的重要因素之一。酶促褐变往往因会影响蔬果的感官品质,而使蔬果的经济价值降低,从而引起了人们对PPO的关注。不同植物,可能因为其品种或生长环境的差异,PPO对酶促褐变的影响也不同。目前,对于马铃薯、莲藕、苹果、香蕉等蔬果中PPO的酶学特性研究较多[8-11],而关于茯苓PPO的研究却未见详细报道。本研究以茯苓为原料,对茯苓PPO的部分酶学性质包括最适pH值,最适反应温度和底物浓度等进行研究,并探讨抑制剂对PPO活性的影响。通过对茯苓PPO动力学特性的研究,采取有针对性的措施以减少茯苓加工过程中酶促褐变的发生,为优良品质茯苓的深加工提供依据和技术支持。
1 材料与方法
1.1 材料与仪器
茯苓,取自安徽省安庆市岳西县茯苓种植基地。
丙酮、NaH2PO4、Na2HPO4、邻苯二酚、NaCl、抗坏血酸、L-半胱氨酸、柠檬酸等均为分析纯。
UV-2000紫外可见分光光度计,上海尤尼柯公司;TGL-16G高速冷冻离心机,上海精密仪器有限公司;FA2004A电子天平,上海精天有限公司,数显恒温水浴锅,常州国华电器有限公司。
1.2 实验方法
1.2.1 粗酶液的制备
将茯苓用清水洗净,风干,切成小块,准确称取5 g置于组织捣碎机中,加入预冷的丙酮,打成匀浆,抽滤,滤渣经丙酮反复抽滤,得丙酮粉。丙酮粉经风干后,加入pH 7.0的经预冷的磷酸盐缓冲液,在冰浴条件下研成匀浆。匀浆液转入离心管中,于4℃,12 000 r/min离心20 min,上清液即为茯苓PPO粗酶液,备用。
1.2.2 PPO酶活性测定
分别取0.1 mol/L邻苯二酚溶液0.5 mL、pH 5.5的磷酸盐缓冲液3mL置于小试管中,充分混匀后再加入0.5 mL茯苓PPO粗酶液,用分光光度计测定其在420 nm下的吸光度值A。以蒸馏水为对照,每隔5 s读取1次,连续记录2 min。每克样品单位时间内吸光度值增加0.001为1个酶活力单位U。最大酶活力为100%。
1.2.3 PPO最适反应pH值
取0.1 mol/L邻苯二酚溶液0.5 mL于小试管中,再分别加入 pH 分别为 3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9 的磷酸盐缓冲液 3 mL,充分混匀后,加入0.5 mL茯苓PPO粗酶液,用分光光度计测定其在420 nm下的吸光度变化值。
1.2.4 PPO最适反应温度
取0.1 mol/L邻苯二酚溶液0.5mL于小试管中,再加入最适pH的磷酸盐缓冲液3 mL,充分混匀后,加入0.5 mL茯苓PPO粗酶液,分别置于20、25、30、35、40、45、50、55、60、65、70、75 ℃ 水浴锅中保温 5 min,冷却,用分光光度计测定其在420 nm下的吸光度变化值。
1.2.5 底物浓度对PPO酶活性的影响
分别取浓度为 0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09 mol/L 的邻苯二酚溶液 0.5 mL于小试管中,再加入最适pH的磷酸盐缓冲液3 mL,充分混匀后,加入0.5 mL茯苓PPO粗酶液,在最适温度下保温5 min,冷却,用分光光度计测定其在420 nm下的吸光度变化值。
1.2.6 PPO热稳定性分析
取最适pH的磷酸盐缓冲液3 mL,加入0.5 mL茯苓 PPO 粗酶液,分别在35、45、55、65、75 ℃保温 0、4、8、12、16、20、24 min,置于冰浴中迅速冷却,用分光光度计测定其在420 nm下的吸光度变化值。
1.2.7 抑制剂对PPO酶活性的影响
取邻苯二酚溶液0.5 mL于小试管中,再加入最适pH的磷酸盐缓冲液3 mL,充分混匀后,加入0.5 mL茯苓PPO粗酶液,分别加入不同质量浓度的NaCl、抗坏血酸、L-半胱氨酸和柠檬酸溶液1 mL,依次用分光光度计测定在420 nm下的吸光度变化值。
2 结果与分析
2.1 pH值对茯苓PPO酶活性的影响
pH值对茯苓PPO酶活性的影响如图1所示。茯苓PPO酶活性的最适pH值为6.5,高于或低于此值,酶活力均下降。当pH值小于6.5时,随着pH值的增加,酶活性也随之增强;而当pH值大于6.5时,酶活性又随着pH值的升高而下降。PPO酶活性在强酸性和强碱性环境中,酶活性均较低,这主要是因为PPO是一种含铜蛋白,位于PPO酶活性中心部位的辅基Cu2+,在极端酸碱性环境中容易发生解离。当在强酸性环境中,Cu2+发生解离,使酶活性大大下降或失活;当处于强碱性环境中时,解离下的Cu2+容易形成Cu(OH)2沉淀,从而使得酶活性显著降低甚至失活[12]。因此,PPO在酸性或碱性环境中,酶活性受到很大抑制,在一定程度上也能减少酶促褐变的发生。
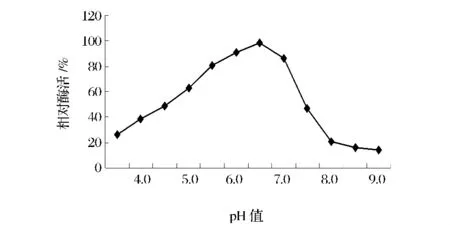
图1 pH值对茯苓PPO酶活性的影响Fig.1 Effect of pH on PPO activity of Poria cocos
2.2 温度对茯苓PPO酶活性的影响
温度对茯苓PPO酶活性的影响如图2所示。在20~35℃,随着温度的升高,酶活性呈增长趋势,当温度达到35℃时,茯苓PPO酶活性达到最高,茯苓PPO的最适反应温度为35℃。此后继续升高温度,酶活性呈下降趋势。当温度达到75℃时,酶相对活性仅有19.4%。这是因为温度升高,分子碰撞加剧,酶促反应速率也随之加快,但酶的本质是蛋白质,蛋白质的结构与功能是密切相关的。温度稍高会引起蛋白质空间构象发生一定程度的改变,酶活性中心破坏,酶蛋白变性,致使其活性下降甚至引起失活。
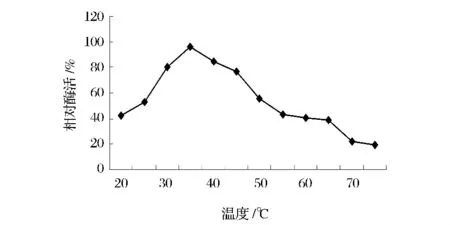
图2 温度对茯苓PPO酶活性的影响Fig.2 Effect of temperature on PPO activity of Poria cocos
2.3 底物浓度对茯苓PPO酶活性的影响
底物浓度对茯苓PPO酶活性的影响如图3所示,符合典型的米氏方程曲线。由图3可知,当底物浓度较低时,随着底物浓度的增高,酶活性也随之增高,二者呈一级反应。这是因为底物浓度较低时,只有一部分酶与底物结合,底物浓度决定了反应速率;当底物浓度达到0.06 mol/L时,酶活力几乎保持不变,继续增加底物浓度,反应也趋于稳定状态,二者呈零级反应。这是因为当底物达到一定浓度时,全部跟酶的活性部位结合,酶已经达到饱和,即使再增加底物浓度,也不会使反应速率增加。
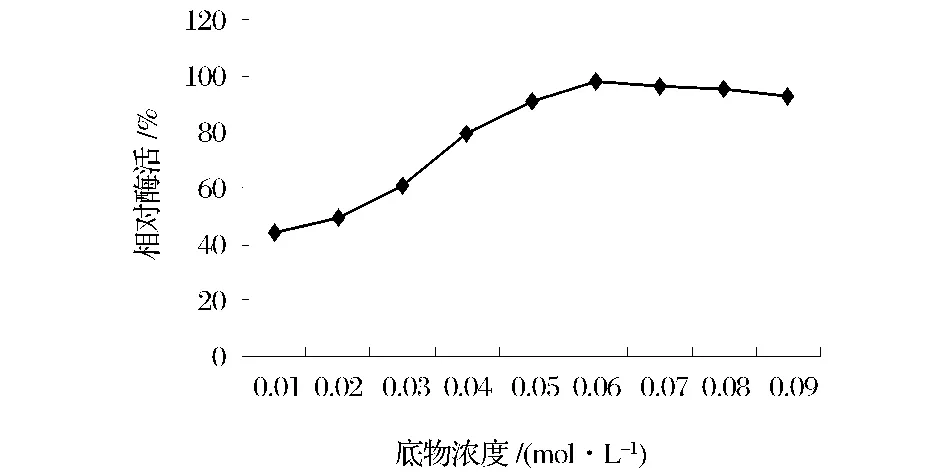
图3 底物浓度对茯苓PPO酶活性的影响Fig.3 Effect of substrate concentration on PPO activity of Poria cocos
根据Line weaver-Burk方程,利用双倒数作图法,以1/[S]为横坐标,1/V为纵坐标作图,如图4所示,拟合得到动力学方程。根据方程,求得茯苓PPO动力学参数,其中米氏常数Km=0.024 4 mol/L,最大反应速率Vmax=121.95 U/min。

图4 茯苓PPO酶促反应双倒数曲线Fig.4 Double reciprocal plot of enzyme-catalyzed reaction of PPO from Poria cocos
2.4 茯苓PPO热稳定性
将茯苓PPO酶置于不同温度下分别处理一段时间,测定其酶活,对其热稳定性分析,结果如图5所示。茯苓PPO酶在35℃时,酶活性较为稳定,随着作用时间的延长,酶活性呈缓慢下降趋势;其次为45℃。而当继续增高至55、65、75℃时,酶活性呈急剧下降趋势。在75℃下作用8 min,PPO已经大部分失活。
2.5 抑制剂对茯苓PPO酶活性的影响

图5 茯苓PPO酶热稳定性Fig.5 Thermal stability of PPO from Poria cocos
在酶的反应体系中,分别加入不同质量浓度的NaCl、抗坏血酸、L-半胱氨酸和柠檬酸溶液,这4种抑制剂对茯苓PPO酶活性的影响如图6所示。NaCl、抗坏血酸、L-半胱氨酸和柠檬酸溶液均对茯苓PPO酶活性具有一定的抑制作用,且抑制效果与抑制剂的质量浓度呈正比关系。在同等质量浓度下,L-半胱氨酸对茯苓PPO酶的活性抑制程度最大,其次是抗坏血酸、柠檬酸,最后是NaCl。L-半胱氨酸质量浓度为0.6 mmol/L时,此时茯苓PPO酶相对酶活只有7%。L-半胱氨酸抑制茯苓PPO酶的活性,可能是因为它可以与醌类物质结合生成硫氢化合物,从而抑制酶促褐变[13]。抗坏血酸对茯苓PPO酶活性也具有较强的抑制作用,可能是因为它具有还原性,可以将PPO酶的辅基Cu2+还原,将醌类还原成酚醛结构,抑制醌类物质相互聚合[14-15]。柠檬酸和NaCl对PPO活性也有一定的抑制作用,但较L-半胱氨酸和抗坏血酸来说,抑制效果相对较差。
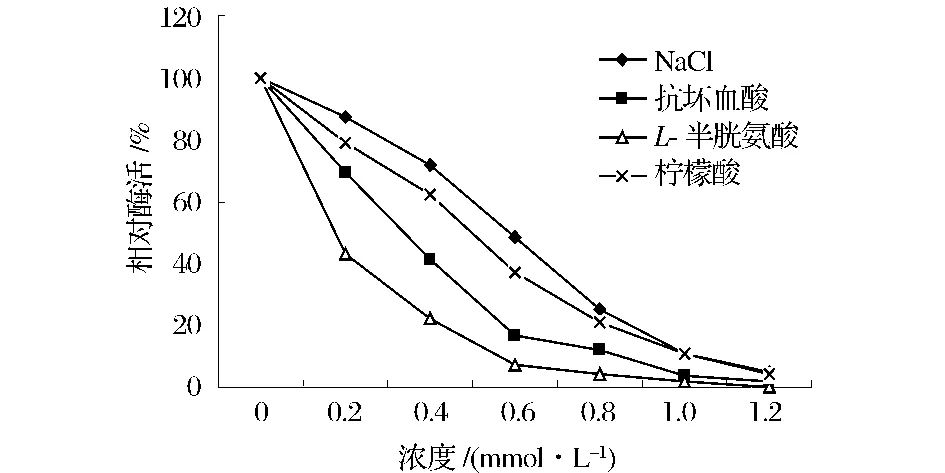
图6 不同抑制剂对茯苓PPO酶活性的影响Fig.6 Effect of different inhibitors on PPO activity of Poria cocos
3 结论与讨论
通过对茯苓PPO酶学特性的研究,茯苓PPO酶的最适pH为6.5,最适温度为35℃,最适底物浓度为0.06 mol/L。PPO酶促反应动力学符合米氏方程,米氏常数Km=0.024 4 mol/L,最大反应速率Vmax=121.95 U/min。PPO的耐热性较差,75℃下热处理8 min,可以使酶活性基本失活。NaCl、抗坏血酸、L-半胱氨酸和柠檬酸溶液对茯苓PPO酶活性有一定的抑制作用,在一定质量浓度范围内,抑制效果与质量浓度呈线性关系。其中以L-半胱氨酸抑制效果最好,其次是抗坏血酸,再次是柠檬酸,最后是NaCl。
今后,在茯苓深加工过程中,可以采取一些措施避开PPO酶的最佳反应条件。诸如可以在偏酸性或是偏碱性的环境中,低温下进行操作,抑制PPO活性,延缓褐变;PPO热稳定性较差,热处理一定时间可以使酶活性部分或完全失活,但热处理过程中也容易使茯苓其他的有效成分分解,影响品质,因此不建议使用。另外,在加工过程中可以加入L-半胱氨酸、抗坏血酸等,这些物质都可以抑制PPO的活性,从而减少酶促褐变的发生。在植物加工过程中,这些物质常作为护色剂加入防止褐变的发生[16-17],均取得了一定的效果。对于抑制剂,有研究表明具有协同作用,同时将几种抑制剂结合使用与只加入其中一种相比较,可能对酶促褐变起到更好的抑制作用,但是,对于茯苓是否不能同样如此,本文并没有作进一步研究。
[1] 中国药典.一部[S].2010:224.
[2] 张扬,胡高升,韩志福,等.茯苓发酵菌丝体中3种主要三萜酸类成分积累动态研究[J].中国中药杂志,2013,9(38):1 355-1 359.
[3] 胡斌,杨益平,叶阳.茯苓化学成分研究[J].中草药,2006,5(37):655-658.
[4] SONG X W,WANG D Q.大别山茯苓产地的形成与发展[J].安徽中医学院学报,2011,30(5):65-67.
[5] 李忠光,龚明.植物多酚氧化酶活性测定方法的改进[J].云南师范大学学报,2005,25(1):44-45.
[6] 李超,郑义,王乃馨,等.牛蒡多酚氧化酶的特性及酶促褐变的抑制[J].食品工业科技,2011,32(6):121-124.
[7] 何国庆,丁立孝.食品酶学[M].北京:化学工业出版社,2006:130-134.
[8] 王磊,阮征,骆成尧,等.马铃薯多酚氧化酶酶学特性及热稳定性模型的研究[J].食品工业科技,2012,33(19):92-96.
[9] 高梦祥,胡翠翠,严奉伟,等.磁场和抑制剂对莲藕多酚氧化酶反应动力学的影响[J].农业机械学报,2008,39(1):78-81.
[10] 乜兰春,孙建设,辛蓓,等.苹果果实酶促褐变底物及多酚氧化酶活性的研究[J].园艺学报,2004,31(4):502-504.
[11] 柳素洁,杜金华,单玲克,等.香蕉中多酚氧化酶性质及褐变控制[J].食品与发酵工业,2012,38(2):126-130.
[12] 王向阳,姜丽佳,王忠英.莲藕的酶促褐变及其贮藏中褐变的控制[J].农业工程学报,2009,25(4):276-280.
[13] 孔维宝,陆健,赵海锋,等.L-半胱氨酸抑制多酚氧化酶的机制研究[J].食品科学,2007,28(11):66-70.
[14] 刘静,钱建亚,李成良,等.芡实多酚氧化酶的酶学性质[J].食品科学,2012,33(7):176-181.
[15] Yoruk R,Marshall M R.Physicochemical properties and function of plant polyphenol oxidase:A review[J].J Food Bio chem,2003,27(5):361-422.
[16] 黄绍华,胡晓波,王震宙.山药中多酚氧化酶的活性测定及其护色研究[J].食品与发酵工业,2005,31(6):27-29.
[17] 罗志刚,杨连生,姜绍通,等.抗坏血酸和亚硫酸钠在甘薯破碎中抗褐变的研究[J].食品工业科技,2002,23(5):52-53.
