黑曲霉WB-1固态发酵产单宁酶的研究
2015-12-28郑重谊张冬雪王娇娇
郑重谊,资 云,张冬雪,王娇娇,周 辉
(1.湖南农业大学研究生院,湖南长沙410128;2.湖南农业大学食品科技学院,湖南长沙410128)
单宁酶(tannase,EC 3.1.1.20)是一种水解酶,主要由微生物产生,可使单宁分子中的酯键、糖苷键和缩酚键裂解,水解后生成没食子酸,其水解速度与酶浓度成正比[1]。单宁酶在精细化工、皮革、饲料、化妆品等行业具有广泛的应用[2]。
单宁酶除存在于富含单宁的植物中外,还广泛存在于微生物中,能由某些真菌在没食子酸等诱导物存在时合成,这些菌种主要分布于曲霉属(Aspergillus)[3-4]、拟青霉属(Paecilomyces)[5-6]、青霉属(Penicillium)[7-8],其中曲霉属的黑曲霉(Aspergillusniger)是典型代表[9-10]。
五倍子是我国的一种重要的林化产品,含有丰富的可降解型单宁,主要用于提取单宁酸。作者课题组在前期实验中从五倍子加工企业的污水排放口土壤中分离得到一株产单宁酶的黑曲霉WB-1,作者对该黑曲霉WB-1产单宁酶的发酵条件以及酶学性质进行研究,为深入了解产单宁酶的黑曲霉提供参考。
1 实验
1.1 菌种及培养基
黑曲霉WB-1,本实验室筛选保存。
马铃薯葡萄糖琼脂培养基(PDA 培养基):马铃薯200g,切成小块,加1 000mL 水煮沸30min,用4层纱布滤成清液。加水补充减少的水分,加入葡萄糖20g,琼脂20g,充分混匀后于121 ℃灭菌30min。
固体发酵培养基:取5g五倍子粉和麸皮的混合物(其中五倍子粉0.5g,麸皮4.5g)、盐溶液(组成:NH4NO35g·L-1,MgSO4·7H2O 1g·L-1,NaCl 1g·L-1)5mL充分混合均匀,自然pH 值,装入250 mL 的三角瓶中,121 ℃灭菌20min。
1.2 单宁酶的提取及黑曲霉WB-1产酶条件研究
1.2.1 孢子悬浮液的制备
将黑曲霉WB-1 在PDA 斜面上活化培养。取28 ℃培养5d的新鲜斜面若干支,每支加入5mL 无菌生理盐水,用无菌接种环将斜面上的孢子刮下来,将孢子悬浮液移入灭菌的三角瓶中,振荡摇匀,以上操作均在无菌台中进行,用PDA 平板计数孢子悬浮液中的孢子数量。
1.2.2 粗酶液的提取
向固体发酵培养基中加入1mL 黑曲霉WB-1孢子悬浮液(1×1010个·mL-1),混合均匀,在28 ℃的培养箱中进行固态发酵。发酵结束后,取出装有固态基质的三角瓶,加入50mL pH 值5.0的柠檬酸缓冲液,置于摇床上,160r·min-1振荡提取30min,用滤纸过滤,所得滤液即为粗酶液。
1.2.3 单宁酶酶活力的测定
根据单宁酶水解没食子酸丙酯产生没食子酸,没食子酸可与绕单宁在碱性条件下生成色团物质,该物质在520nm 处有最大光吸收的原理进行测定[11]。
酶活力单位定义为:在30 ℃下,每分钟分解产生1μmol没食子酸所需要的酶量定义为一个酶活力单位(U)。
1.2.4 发酵温度对产单宁酶的影响
在发酵培养基中接入WB-1 孢子悬浮液分别于24 ℃、28℃、32℃、37℃、42℃的培养箱中培养96h,提取单宁酶并测定酶活力,比较不同发酵温度下的酶活力大小。
1.2.5 发酵时间对产单宁酶的影响
在发酵培养基中接种WB-1孢子悬浮液,在28 ℃培养箱中进行固态发酵,分别培养24h、48h、72h、96h、120h、144h,提取单宁酶,测定单宁酶的酶活力。
1.2.6 外加碳源对产单宁酶的影响
固定发酵培养基中其它成分不变,盐溶液中分别添加终浓度为1%的葡萄糖、蔗糖、α-乳糖、甘油、D-果糖、甘露醇作为外加碳源,接种WB-1孢子悬浮液,在28 ℃培养箱中进行固态发酵,培养96h,提取单宁酶,测定单宁酶的酶活力。
1.3 单宁酶的酶学性质研究
1.3.1 单宁酶的储存稳定性
将提取的单宁酶粗酶液分为若干份,置于4 ℃冰箱中储存1周、2周、3周、4周、5周后,吸取少量单宁酶粗酶液测定并计算相对酶活力,观察单宁酶的酶活力变化。
1.3.2 反应温度对单宁酶酶活力的影响
将单宁酶酶解反应温度设定为20~70℃之间,比较不同反应温度下的酶活力大小。
1.3.3 pH 值对单宁酶酶活力的影响
配制pH 值分别为3、4、5、6、7的柠檬酸缓冲液,以不同pH 值的缓冲液来配制没食子酸丙酯溶液,进行单宁酶酶解反应,测定单宁酶活力,比较不同pH 值下的酶活力大小。
2 结果与讨论
2.1 黑曲霉WB-1产酶条件研究
2.1.1 发酵温度对产单宁酶的影响
考察不同发酵温度下黑曲霉WB-1产单宁酶酶活力的大小,结果见图1。
由图1可知,在发酵温度为28 ℃时黑曲霉WB-1产单宁酶酶活力最高,这与多数文献中报道的黑曲霉产单宁酶发酵温度基本一致。发酵温度过低或过高均不利于产酶或维持酶的功能稳定性。因此,确定黑曲霉WB-1产单宁酶的最佳发酵温度为28 ℃。
2.1.2 发酵时间对产单宁酶的影响
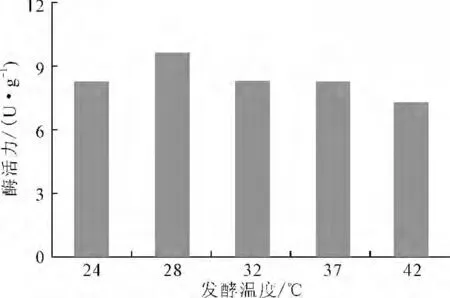
图1 发酵温度对产单宁酶的影响Fig.1 Effect of fermentation temperature on tannase production
考察不同发酵时间下黑曲霉WB-1产单宁酶酶活力的大小,结果见图2。
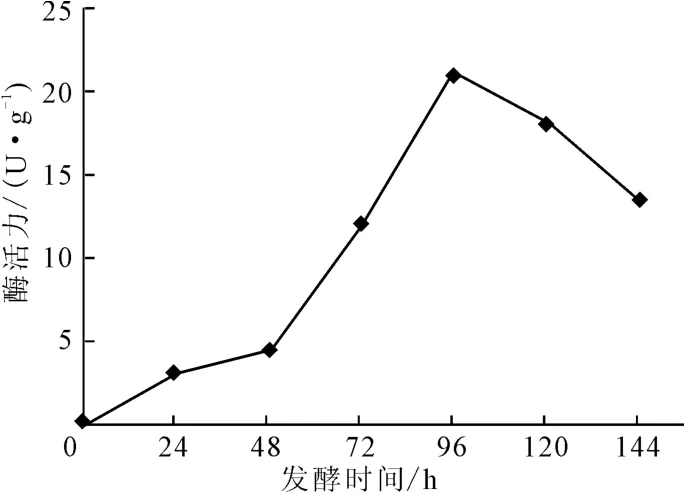
图2 发酵时间对产单宁酶的影响Fig.2 Effect of fermentation time on tannase production
由图2可知,单宁酶的酶活力随着发酵时间的延长先升高后降低,在发酵时间为96h时达到最高,为21U·g-1;超过96h后,单宁酶的酶活力下降。这是因为,随着发酵时间的延长,单宁酶可能被菌体降解。因此,确定黑曲霉WB-1产单宁酶的最佳发酵时间为96h。
2.1.3 外加碳源对产单宁酶的影响
考察不同外加碳源下黑曲霉WB-1产单宁酶酶活力的大小,结果见图3。
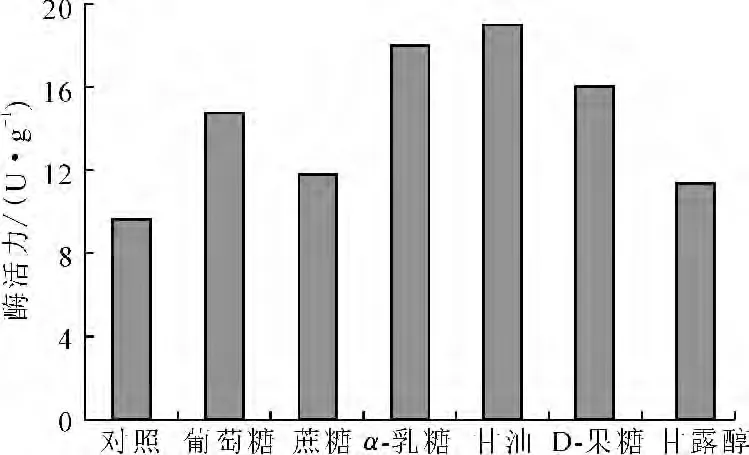
图3 外加碳源对产单宁酶的影响Fig.3 Effect of additional carbon source on tannase production
由图3可知,外加碳源都能提高单宁酶的酶活力,其对产酶的影响顺序为:甘油>α-乳糖>D-果糖>葡萄糖>蔗糖>甘露醇。其中添加甘油的效果最好,所得单宁酶的酶活力可达19.27U·g-1。
2.2 单宁酶的酶学性质研究
2.2.1 低温储存稳定性(图4)

图4 单宁酶的储存稳定性Fig.4 Storage stability of tannase
由图4可知,随着储存时间的延长,单宁酶酶活力逐渐降低,储存3周后酶活力保持在80%以上,储存5周后仍有67%的酶活力。而储存3个月后,单宁酶酶活力仍有52%,说明该单宁酶的低温(4 ℃)储存稳定性较好。
2.2.2 最适反应温度(图5)
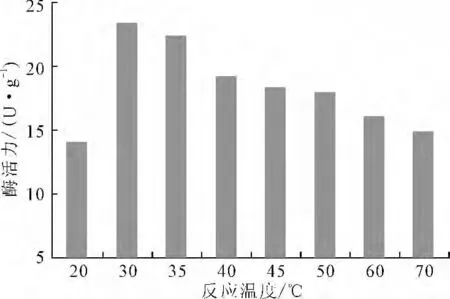
图5 反应温度对单宁酶酶活力的影响Fig.5 Effect of reaction temperature on the activity of tannase
由图5可知,20 ℃时单宁酶的酶活力较低,不利于单宁酶发挥催化功能,30 ℃时单宁酶的酶活力最高,可达到23U·g-1,此后随着反应温度的升高,单宁酶酶活力逐渐降低。说明温度高于30℃以后,单宁酶催化反应生成没食子酸的量减少。因此,单宁酶的最适反应温度为30 ℃。
2.2.3 最适pH 值(图6)
由图6可知,单宁酶酶活力随着pH 值的升高而升高,在pH 值为6时,酶活力达到最高,之后随着pH值的继续升高,单宁酶酶活力开始下降。因此,单宁酶的最适pH 值为6。
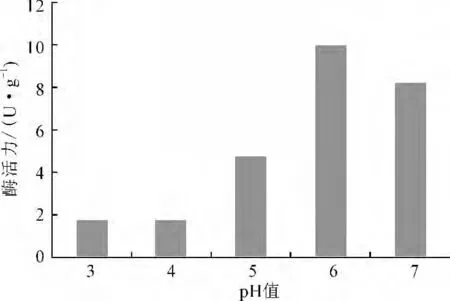
图6 pH 值对单宁酶酶活力的影响Fig.6 Effect of pH value on the activity of tannase
3 结论
对黑曲霉WB-1固态发酵产单宁酶进行了研究。考察了发酵温度、发酵时间、外加碳源对黑曲霉WB-1产单宁酶的影响,同时考察了单宁酶的储存稳定性以及最适反应温度、pH 值。结果表明,黑曲霉WB-1产单宁酶的最佳发酵温度和发酵时间分别为28 ℃和96 h,外加碳源有利于单宁酶的产生,且以甘油为外加碳源时效果最好。所产单宁酶的最适反应温度和pH 值分别为30 ℃和6,而且具有一定的低温(4 ℃)储存稳定性。
[1]石瑞丽,邱树毅,李秧针,等.黑曲霉利用五倍子生料固体发酵产单宁酶优化发酵条件研究[J].中国食品添加剂,2009,(3):107-111.
[2]余钧池.米曲霉单宁酶产酶条件及其应用的研究[J].广西轻工业,2007,23(7):12-13.
[3]马如意.单宁酶产生菌的筛选及其发酵条件研究[D].济南:山东农业大学,2011.
[4]李红歌,付桂明,游向荣,等.高产单宁酶泡盛曲霉Aspergillus awamoriFUYN206的筛选及所产胞外单宁酶的稳定性研究[J].食品工业科技,2012,33(18):190-194.
[5]BATTESTIN V,MACEDO G A.Tannase production byPaecilomycesvariotii[J].Bioresource Technology,2007,98(9):1832-1837.
[6]RAAMAN N,MAHENDRAN B,JAGANATHAN C,et al.Optimisation of extracellular tannase production fromPaecilomyces variotii[J].World Journal of Microbiology and Biotechnology,2010,26(6):1033-1039.
[7]BATRA A,SAXENA R K.Potential tannase producers from generaAspergillusandPenicillium[J].Process Biochemistry,2005,40(5):1553-1557.
[8]SELWAL M K,YADAV A,SELWAL K K,et al.Tannase production byPenicilliumatramentosumKM under SSF and its applications in wine clarification and tea cream solubilization[J].Brazilian Journal of Micrbiology,2011,42(1):374-387.
[9]金伟,聂光军,王丽,等.黑曲霉固态发酵生产单宁酶的条件优化[J].生物加工过程,2013,11(3):7-12.
[10]王挥,张蕾,黎继烈,等.响应面法优化黑曲霉发酵产单宁酶条件[J].中南林业科技大学学报,2011,31(10):122-126.
[11]SHARMA S,BHAT T K,DAWRA R K.A spectrophotometric method for assay of tannase using rhodanine[J].Analytical Biochemistry,2000,279(1):85-89.
