BRAF V600E突变蛋白在皮肤黑素瘤中的表达
2014-12-09任丹阳康晓静于世荣时晓辉吴秀娟靳颖普雄明
任丹阳 康晓静 于世荣 时晓辉 吴秀娟 靳颖 普雄明
·研究报道·
BRAF V600E突变蛋白在皮肤黑素瘤中的表达
任丹阳 康晓静 于世荣 时晓辉 吴秀娟 靳颖 普雄明
目的探讨皮肤黑素瘤BRAF V600E突变蛋白表达情况,分析免疫组化法检测V600E突变的灵敏度和特异度。方法应用抗BRAF V600E单克隆抗体的免疫组化法检测103例皮肤黑素瘤、40例色素痣石蜡包埋组织切片中BRAF V600E突变蛋白表达水平。采用SPSS 17.0统计软件进行统计分析,率的比较采用χ2检验。结果BRAF V600E突变蛋白阳性表达率在皮肤黑素瘤中为20.4%(21/103),色素痣中为5.0%(2/40),两组差异有统计学意义(χ2=5.06,P<0.05)。黑素瘤BRAF V600E突变蛋白的表达率在不同年龄组[<60岁组表达率为29.8%(14/47),≥60岁组为12.5%(7/56)]、不同民族[维吾尔族组为30.2%(13/43),汉族组为13.3%(8/60)]、不同发病部位[肢端为13.6%(6/42)、黏膜为11.8%(4/29)、非肢端为45.8%(11/32)]、不同Clark分级[Ⅰ~Ⅲ级组为8.6%(4/42),Ⅳ~V级组为12.4%(17/61)]组间表达差异均有统计学意义(P<0.05),而在不同性别、有无淋巴结转移组间表达差异均无统计学意义(P>0.05)。免疫组化检测恶性黑素瘤中BRAF V600E突变灵敏度为100%(15/15),特异度为98.5%(65/66)。结论BRAF V600E突变蛋白在皮肤黑素瘤中高表达,在维吾尔族人群表达率高于汉族人群;免疫组化法检测BRAF V600E突变具有准确、快速等特点。
黑色素瘤;突变;原癌基因蛋白质B-raf
近年来我国黑素瘤发病呈递增趋势[1]。BRAF突变是黑素瘤最常见的遗传学事件,90%以上是BRAF V600E突变,平均突变率为60%~80%[2],与黑素瘤发生、发展、靶向治疗和不良预后密切相关[3]。针对BRAF V600E突变抑制剂威罗菲尼能提高黑素瘤的无进展生存期和总生存期[4]。临床上快速检测黑素瘤中BRAF V600E突变是黑素瘤患者个体化靶向治疗的依据。本研究应用免疫组化法检测103例皮肤黑素瘤中BRAF V600E突变蛋白表达情况,与PCR方法检测V600E突变比较,分析BRAF V600E突变蛋白表达与皮肤黑素瘤不同临床病理参数的关系和免疫组化检测BRAF V600E突变的临床应用价值。
一、资料
1.标本来源:103份皮肤黑素瘤标本,包括80份本实验组前期经PCR检测BRAF突变标本[5]和23份新增标本,均来自新疆维吾尔自治区人民医院皮肤科及病理科2004—2013年6月存档石蜡组织标本,病史完整(表1)。全部病例均未做化疗、放疗及抗免疫治疗,经手术切除后病理学检查确诊。另选择40份色素痣石蜡组织作为对照组。
2.主要试剂:一抗是小鼠抗人BRAF V600E单克隆抗体(IgG,美国NewEast公司,产品编号:26039);鼠兔通用型二抗、二氨基联苯胺(DAB)显色剂均系北京中杉金桥生物技术有限公司生产。
二、方法
1.免疫组化法:将4%甲醇固定、石蜡包埋的黑素瘤组织制成4~5 μm切片,常规烤片、脱蜡、水化;浸入0.01 mol/L pH6.0的枸橼酸盐缓冲液内,热抗原修复3 min;3%H2O2室温作用10 min;滴加一抗(稀释度为1∶800)100 μl;4℃过夜后室温复温45 min,滴加通用型二抗100 μl,室温孵育30 min;DAB显色1 min左右;自来水冲洗,苏木精复染,通透、脱水,中性树胶封片,显微镜下观察。PBS代替一抗作为空白对照,已知表达突变型V600E黑素瘤切片作为阳性对照。
2.结果判断及标准:所有切片在做免疫组化前均现切,免疫组化结果由2位病理科专家双盲阅片判读结果,阳性染色为大多数肿瘤细胞出现明显的细胞质棕黄色着色,阴性为不着色或单一孤立的胞核着色、零星细胞的单一浅着色、单核巨噬细胞着色。
3.统计学方法:应用SPSS 17.0统计软件,率的比较采用χ2检验。

图1 皮肤黑素瘤BRAF V600E突变蛋白表达阳性 细胞质出现棕黄色颗粒(免疫组化×400)
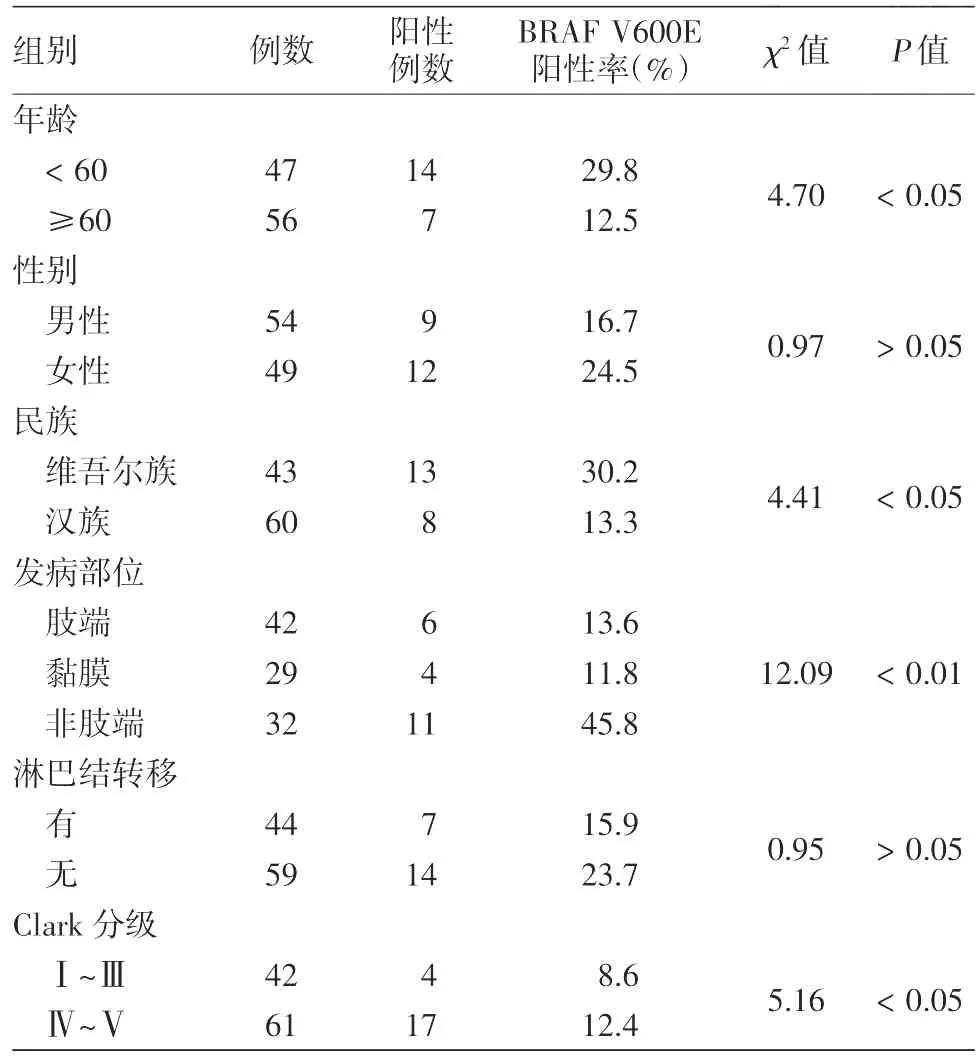
表1 皮肤黑素瘤患者临床病理参数与BRAF V600E突变蛋白表达的关系
三、结果
1.BRAF V600E突变蛋白在皮肤黑素瘤和色素痣中的表达:BRAF V600E突变蛋白阳性表达表现为细胞质棕黄色着色,皮肤黑素瘤103例中阳性21例,阳性率为20.4%;色素痣40例中阳性2例,阳性率为5.0%,两组阳性率差异有统计学意义(χ2=5.06,P<0.05)。见图1。
2.皮肤黑素瘤临床病理参数与BRAF V600E突变蛋白表达的关系:皮肤黑素瘤BRAF V600E突变蛋白表达水平在不同年龄、民族、发病部位、Clark分级组间差异均有统计学意义(P<0.05),而患者不同性别、有无淋巴结转移组间表达差异均无统计学意义(P>0.05)。见表1。
3.免疫组化法检测BRAF V600E突变的灵敏度和特异度:与本实验组前期研究[5]对比,80例黑素瘤患者DNA直接测序BRAF V600E突变15例,这15例免疫组化检测均阳性,另有1例出现假阳性。免疫组化检测BRAF V600E突变的灵敏度和特异度分别为100%(15/15)和98.5%(64/65)。
四、讨论
研究发现,RAS-RAF-MEK-ERK级联信号通路是细胞生长、增殖、分化和凋亡的关键通路,BRAF基因突变是MAPK通路异常活化机制之一,出现在超过60%~80%的黑素瘤中,其中90%以上突变是BRAF蛋白第600位的缬氨酸被谷氨酸取代,即V600E[2],这种突变的发生能显著提高BRAF激酶活性,其激活MAPK信号通路的传导异常,导致黑素细胞转化成黑素瘤细胞[6-7]。
美国FDA于2011年和2013年先后批准针对BRAF V600E突变的小分子靶向药物威罗菲尼、达拉菲尼和曲美替尼上市,其总有效率达60%~80%[8]。因此在进行系统性治疗之前,检测黑素瘤患者BRAF V600E突变,可以为黑素瘤患者个体化治疗提供依据。目前检测BRAF突变的方法包括基因测序、突变特异性PCR等,它们的灵敏度和特异度不同。分子检测技术相对昂贵、费时,对DNA质量要求高,并且4%甲醇固定石蜡包埋组织(FFPE)中的DNA存在不同程度的降解,使其临床应用受到限制[9]。近来一种突变特异性抗体VE1的出现,使拥有高灵敏度和特异度的免疫组化方法能检测FFPE肿瘤组织中BRAF V600E突变蛋白。Feller等[10]提示,免疫组化是检测BRAF V600E突变的一种可靠、高度特异性的方法,能作为临床实践中筛选BRAF V600E突变的工具。同时研究发现,在甲状腺癌、结直肠癌、肺腺癌和星形细胞瘤中免疫组化可以作为临床检测BRAF V600E突变的简化方式[11-14]。本研究用免疫组化检测皮肤黑素瘤中BRAF V600E突变的灵敏度为100%,特异度为98.5%,能准确、快速、低费用检测BRAF V600E突变,与国外报道一致。其中1例假阳性结果为L597Q(T1790A)突变,将这份标本再次进行PCR扩增,DNA测序结果表明仍为L597Q突变。这种假阳性结果可能是VE1抗体对BRAF 600位氨基酸前后T-A的突变比较敏感所致。
朱琰琰等[15]采用PCR扩增、直接测序法在其研究的90例黑素瘤中发现BRAF突变率达27.8%,V600E突变率为22.2%。Si等[16]进一步验证了上述结论,在其检测的432例黑素瘤中,BRAF突变率达25.5%,其中V600E突变占全部突变的89.1%,V600E突变率为22.7%。我国BRAF V600E突变率相对偏低,提示该基因突变可能存在种族差异。新疆是多民族聚居地区,维吾尔族人群具有独特的民族特点和遗传选择性,提示新疆地区黑素瘤可能存在其特有的基因特点。本研究对新疆地区103例皮肤黑素瘤BRAF V600E突变蛋白进行检测,结果显示,21例患者BRAF V600E突变蛋白表达阳性,其中维吾尔族13例,汉族8例,统计学分析显示,维吾尔族BRAF V600E突变蛋白表达高于汉族人群,提示BRAF V600E突变可能存在民族差异,因样本量较小,有待于大样本进一步研究证实。有研究证明,BRAF突变主要发生在间断性日光暴露的黑素瘤患者中,更倾向发生于年轻人群[17],且与不良预后有关。本研究结果显示,BRAF V600E突变蛋白在<60岁组中高表达,黏膜、肢端和非肢端黑素瘤中的表达率分别为11.8%、13.6%、45.8%,ClackⅣ~V级患者BRAF V600E突变蛋白表达率显著高于ClackⅠ~Ⅲ级。这些与国内外研究报道一致,提示BRAF V600E对皮肤黑素瘤的辅助诊断和预后评估具有重要意义。本研究还发现,BRAF V600E突变蛋白在男性与女性的表达差异无统计学意义。有无淋巴结转移被认为是影响恶性黑素瘤预后的一个重要因素,但本研究结果显示,BRAF基因突变在有无淋巴结转移组间表达差异无统计学意义,考虑到样本含量较少及标本选择的差异性,仍需进一步扩大样本量证实。
综上所述,本研究用免疫组化法分析了BRAF V600E突变蛋白在皮肤黑素瘤中的表达情况,结果显示,BRAF V600E突变蛋白在皮肤黑素瘤中高表达,对皮肤黑素瘤辅助诊断、靶向治疗和预后评估具有重要的临床意义。免疫组化法检测皮肤黑素瘤中BRAF V600E突变具有准确、快速、价格相对低廉的优点,可为黑素瘤患者制定个体化治疗方案提供帮助。
[1]练炼,马德亮,陶敏.恶性黑色素瘤的分子靶向治疗进展[J].实用肿瘤杂志,2010,25(2):109-112.
[2]Flaherty KT,Puzanov I,Kim KB,et al.Inhibition of mutated,activated BRAF in metastatic melanoma[J].N Engl J Med,2010,363(9):809-819.
[3]Long GV,Menzies AM,Nagrial AM,et al.Prognostic and clinicopathologic associations ofoncogenic BRAF in metastatic melanoma[J].J Clin Oncol,2011,29(10):1239-1246.
[4]Hauschild A,Grob JJ,Demidov LV,et al.Dabrafenib in BRAF-mutated metastatic melanoma:a multicentre,open-label,phase 3 randomised controlled trial[J].Lancet,2012,380(9839):358-365.
[5]郭芳,康晓静,唐小辉,等.新疆80例恶性黑素瘤BRAF基因突变分析[J].中华皮肤科杂志,2013,46(1):33-36.
[6]Wellbrock C1,Ogilvie L,Hedley D,et al.V599EB-RAF is an oncogene in melanocytes[J].Cancer Res,2004,64(7):2338-2342.
[7]Hingorani SR,Jacobetz MA,Robertson GP,et al.Suppression of BRAF(V599E)in human melanoma abrogates transformation[J].Cancer Res,2003,63(17):5198-5202.
[8]CSCO黑色素瘤专家委员会.中国黑色素瘤诊治指南(2011版)[J].临床肿瘤学进展,2012,17(2):159-171.
[9]Long GV,Wilmott JS,Capper D,et al.Immunohistochemistry is highly sensitive and specific for the detection of V600E BRAF mutation in melanoma[J].Am J Surg Pathol,2013,37(1):61-65.
[10]Feller JK1,Yang S,Mahalingam M.Immunohistochemistry with a mutation-specific monoclonal antibody as a screening tool for the BRAFV600E mutational status in primary cutaneous malignant melanoma[J].Mod Pathol,2013,26(3):414-420.
[11]Zagzag J,Pollack A,Dultz L,et al.Clinical utility of immunohistochemistry for the detection of the BRAF v600e mutation in papillary thyroid carcinoma[J].Surgery,2013,154(6):1199-1204.
[12]Rössle M,Sigg M,Rüschoff JH,et al.Ultra-deep sequencing confirms immunohistochemistry as a highly sensitive and specific method for detecting BRAF V600E mutations in colorectal carcinoma[J].Virchows Arch,2013,463(5):623-631.
[13]Sasaki H,Shimizu S,Tani Y,et al.Usefulness of immunohistochemistry for the detection of the BRAF V600E mutation in Japanese lung adenocarcinoma[J].Lung Cancer,2013,82(1):51-54.
[14]Ida CM,Vrana JA,Rodriguez FJ,et al.Immunohistochemistry is highly sensitive and specific for detection of BRAF V600E mutation in pleomorphic xanthoastrocytoma[J].Acta Neuropathol Commun,2013,1(1):20.
[15]朱琰琰,斯璐,迟志宏,等.中国黑色素瘤患者BRAF基因突变分析[J].临床肿瘤学杂志,2009,14(7):585-588.
[16]Si L,Kong Y,Xu X,et al.Prevalence of BRAF V600E mutation in Chinese melanoma patients:large scale analysis of BRAF and NRAS mutations in a 432-case cohort[J].Eur J Cancer,2012,48(1):94-100.
[17]Sclafani F,Gullo G,Sheahan K,et al.BRAF mutations in melanoma and colorectal cancer:a single oncogenic mutation with different tumour phenotypes and clinical implications[J].Crit Rev Oncol Hematol,2013,87(1):55-68.
2014-03-20)
(本文编辑:颜艳)
Expression of BRAF V600E mutant protein in cutaneous malignant melanoma
Ren Danyang,Kang Xiaojing*,Yu Shirong,Shi Xiaohui,Wu Xiujuan,Jin Ying,Pu Xiongming.*Department of Dermatology and Venereology,People′s Hospital of Xinjiang Uygur Autonomous Region,Urumqi 830001,China
Kang Xiaojing,Email:drkangxj666@163.com
ObjectiveTo detect the expression of BRAF V600E mutant protein in cutaneous malignant melanoma(CMM),and to evaluate the sensitivity and specificity of immunohistochemistry(IHC)in detecting BRAF V600E mutation.MethodsIHC with an anti-BRAF V600E monoclonal antibody was performed to detect the expression of BRAF V600E mutant protein in paraffin-embedded tissue sections from 103 patients with CMM and 40 patients with nevus.Statistical analysis was carried out with SPSS software version 17.0,and the expression rate of BRAF V600E mutant protein was compared by chi-square test.ResultsThe expression rate of BRAF V600E mutant protein in the CMM patients was 20.4%(21/103),significantly higher than that in the nevus patients(5.0%(2/40),χ2=5.06,P< 0.05).Significant differences were observed in the expression rate of BRAF V600E mutant protein between CMM patients of different age groups(29.8%(14/47)in patients aged<60 years vs.12.5%(7/56)in those aged ≥ 60 years,P< 0.05)and nationality(30.2%(13/43)for Uygur nationality vs.13.3%(8/60)for Han nationality,P < 0.05),as well as among CMM lesions from different anatomical sites(13.6%(6/42)in acral sites vs.11.8%(4/29)in mucous membrane vs.45.8%(11/32)in non-acral sites,P< 0.05)and of different Clark levels(8.6%(4/42)for gradeⅠ-Ⅲ vs.12.4%(17/61)for gradeⅣ-V,P<0.05),but not between male and female CMM patients or between CMM patients with lymph node metastasis and those without(bothP>0.05).IHC with the anti-BRAF V600E antibody showed a sensitivity of 100%(15/15)and a specificity of 98.5%(65/66)in detecting BRAF V600E mutation.Conclusions The expression of BRAF V600E mutant protein is up-regulated in CMM lesions,and CMM patients of Uygur nationality seems to have a higher expression rate than those of Han nationality.IHC appears to be an accurate and rapid method to detect V600E BRAF mutation.
Melanoma;Mutation;Proto-oncogene proteins B-raf
10.3760/cma.j.issn.0412-4030.2014.12.014
国家自然科学基金(81250023);新疆维吾尔自治区国际科技合作计划项目(20146022);2012年度国家临床重点专科项目
830001乌鲁木齐,新疆维吾尔自治区人民医院皮肤性病科[任丹阳(现在新疆石河子大学医学院病理学系,832000)、康晓静、于世荣、时晓辉、吴秀娟、靳颖、普雄明]
康晓静,Email:drkangxj666@163.com
