过表达表皮生长因子受体对人类黑素瘤脑转移瘤细胞系H1生长和转移的影响
2014-12-09康晶HrvojeMiletic郭淑兰
康晶 Hrvoje Miletic 郭淑兰
过表达表皮生长因子受体对人类黑素瘤脑转移瘤细胞系H1生长和转移的影响
康晶 Hrvoje Miletic 郭淑兰
目的探索表皮生长因子受体(EGFR)在黑素瘤生长和转移过程中的作用。方法选用本实验室已建立的人黑素瘤脑转移瘤细胞系(H1),通过慢病毒载体稳定转染野生型EGFR(H1EGFRwt),使其呈EGFR过表达状态,对照组转染绿色荧光蛋白(H1GFP)后分选纯化。采用细胞划痕实验对实验组H1EGFRwt细胞和对照组H1GFP细胞的迁移能力进行分析,结果以划痕面积愈合率表示。采用集落形成实验观察EGFR对两组细胞独立生存能力和集落形成能力的影响,通过刃天青还原试验评估集落形成结果,结果以两组细胞活细胞数及其代谢活性评分表示。Western印迹分析EGFR激活的信号通路。采用SPSS 20.0软件进行重复测量的方差分析比较两组细胞划痕面积愈合率的差异,采用配对样本t检验比较两组细胞不同预处理的代谢评分差异。结果流式细胞仪检测显示,H1细胞EGFR和GFP转染成功,分选后得到了纯化H1EGFRwt和H1GFP细胞。细胞划痕实验显示,实验组H1EGFRwt在给予表皮生长因子(EGF)刺激的不同时间点(6、18、24、48 h),划痕面积愈合率分别为0.145±0.066、0.479±0.096、0.571±0.198、0.672±0.199,对照组H1GFP在相同条件下分别为0.051±0.036、0.254±0.038、0.303±0.077和0.498±0.111,H1EGFRwt细胞的愈合程度均高于H1GFP细胞,两组比较,F=68.49,df=5,P<0.05。集落形成实验证实,H1EGFRwt细胞的代谢评分(92 225.2±6 632.1)高于H1GFP细胞(62 935.7±8 159.2),两组比较,t=2.26,df=9,P<0.01。Western印迹结果显示,H1EGFRwt细胞可在EGF的刺激下激活下游信号磷酸化磷脂酰肌醇特异性磷脂酶C-γ(pPLCγ)、磷酸化信号转导和转录活化因子5(pSTAT 5)、磷酸化信号转导和转录活化因子3(pSTAT3),而对照组未能激活。此外,H1EGFRwt细胞可在EGF刺激下使磷酸化丝/苏氨酸蛋白激酶(pAKT)和磷酸化有丝裂原活化蛋白激酶(pMAPK)表达明显高于对照组。结论EGFR在黑素瘤H1细胞的转移机制中发挥重要作用,并有可能成为黑素瘤转移治疗中的靶向目标。
黑色素瘤;受体,表皮生长因子;表皮生长因子
黑素瘤是一种具有高度侵袭及转移性的恶性肿瘤,目前,首选治疗方案仍然是手术切除,但是治愈率很大程度上要取决于是否能早期诊断[1]。表皮生长因子受体(epidermal growth factor receptor,EGFR)是一种具有酪氨酸激酶活性的膜受体,可被表皮样生长因子如表皮生长因子(epidermal growth factor,EGF)和转化生长因子α(transforming growth factor-α,TGF-α)等激活,隶属于 ErbB 受体家族,这个家族还包括ErbB2(HER2 or Neu)、ErbB3(HER3)和ErbB4(HER4)三个成员[2]。EGFR被证实与很多人类肿瘤的发生发展及不良预后有关[3],也参与了黑素瘤的发展与转移。我们通过创伤愈合实验和集落形成实验探索EGFR对黑素瘤细胞转移及独立存活能力的影响,采用Western印迹研究EGFR激活的信号通路,寻找有可能成为黑素瘤转移治疗中的理想靶点。
材料和方法
一、细胞培养和试剂
人黑素瘤脑转移瘤细胞系H1的描述见文献[4],培养基为DMEM(美国Sigma公司)并添加8%~10%胎牛血清,320 μg/L L谷氨酰胺,100 U/ml青霉素和100 mg/L链霉素。磷酸化丝/苏氨酸蛋白激酶(pAkt)、磷酸化磷脂酰肌醇特异性磷脂酶C-γ(pPLCγ)、磷酸化信号转导和转录活化因子 5(pSTAT 5)、磷酸化信号转导和转录活化因子3(pSTAT 3)、磷酸化有丝裂原活化蛋白激酶(pMAPK)和甘油醛-3-磷酸脱氢酶(GAPDH)一抗(美国Cell Signaling Technology公司),山羊抗兔二抗(美国Vector Laboratories公司),绿色荧光蛋白(GFP,美国Proteintech Group公司),刃天青钠盐、低熔点琼脂糖、十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)(美国Sigma公司),磷酸盐缓冲液(PBS)、EGF(美国Peprotech公司),Difco Noble琼脂(美国BD公司),BCA蛋白测定试剂盒(美国Thermo Fisher Scientific公司)。
二、流式细胞仪检测
流式细胞仪(型号为Acurri C6)分析H1细胞中EGFR的表达。实验组H1细胞采用慢病毒载体转染野生型EGFR,对照组转染GFP。流式细胞仪(型号:FACS Aria)对细胞进行纯化和分选,得到EGFR过表达的H1EGFRwt细胞和对照组的H1GFP细胞。
三、细胞划痕实验
H1EGFRwt和H1GFP细胞接种在24孔板中并于培养箱中培养24 h,直至细胞达100%汇合。然后将细胞进行饥饿处理,无血清培养基中培养24 h。用微量移液器枪头沿单层细胞划过,PBS洗涤2次以除去细胞碎片,加入20 μg/L EGF继续培养。0、6、18、24和48 h时在显微镜下拍照,通过Cell Profiler软件测量划痕面积。结果以划痕面积愈合率表示,划痕面积愈合率=(0 h时划痕面积-各时间点的划痕面积)/0 h时划痕面积。
四、集落形成实验
2.4%Difco Noble琼脂与细胞培养液1∶3混合制备底层琼脂,2.4%低熔点琼脂糖和预热的细胞培养液同样1∶3混合制备上层琼脂。单层细胞悬液调整到8×104个/ml,与制备好的上层琼脂等体积混合,于37~38℃保存。先以每孔50 μl体积的底层琼脂加入到96孔板中,每组10个孔,其上覆盖同体积的琼脂糖/细胞悬液,最后每孔加入100 μl细胞培养液。将96孔板置于培养箱中培养10 d。10 d后上机检测,采用Workout 2.0检测其活细胞数及代谢活性并进行评分。之后采用刃天青还原试验评估集落形成结果,每孔加入0.1 g/L刃天青溶液20 μl,培养箱中4 h孵育后,再次上机检测两组细胞的活细胞数及代谢活性并进行评分,其代谢评分用来反映细胞集落形成实验结果。
五、Western印迹
H1EGFRwt和H1GFP细胞饥饿培养24 h,加入20 μg/L的EGF[5]刺激细胞生长30 min后提取总蛋白,并用BCA蛋白测定试剂盒检测总蛋白浓度。将等量样品通过SDS-PAGE凝胶电泳后转膜。分别加入不同浓度一抗4℃孵育过夜,清洗后二抗室温孵育1.5 h。GAPDH用作内参照。
六、统计学处理
采用SPSS 20.0进行统计分析,重复测量的方差分析比较两组细胞划痕面积愈合率的差异,配对样本t检验比较两组细胞不同预处理的代谢评分差异,P<0.05为差异有统计学意义。
结 果
一、H1细胞系的EGFR表达

图1 H1细胞转染前后表皮生长因子受体(EGFR)表达情况 1a:转染前H1细胞为EGFR阴性细胞;1b:EGFR转染后EGFR的阳性率高达98.0%;1c:H1GFP细胞为EGFR阴性细胞

图2 表皮生长因子(EGF)处理不同时间对H1EGFRwt和H1GFP细胞划痕面积愈合的影响(×100) 给予EGF刺激时,相同时间内H1EGFRwt细胞的愈合程度明显高于H1GFP细胞;不给予任何处理时,H1EGFRwt细胞和H1GFP细胞的愈合程度无显著差异
流式细胞仪检测结果显示,H1细胞系为EGFR阴性细胞系(图1a),转染后H1细胞系的EGFR表达率高达98.0%(图1b)。流式细胞仪分选后可得到纯化的EGFR过表达的细胞系H1EGFRwt细胞。对照组H1GFP细胞根据GFP的绿色荧光,同样用流式细胞仪对其进行分选,从而得到纯化的H1GFP细胞,H1GFP细胞为EGFR阴性细胞系(图1c)。
二、细胞划痕实验结果
结果显示,给予实验组H1EGFRwt细胞以及对照组H1GFP细胞EGF处理时,相同时间内H1EGFRwt细胞的愈合程度明显高于H1GFP细胞;而两组细胞不给予任何处理时,愈合程度无显著差异(图2)。为进一步确定实验结果,分别计算两组细胞不同时间点的划痕面积愈合率,根据不同时间点的划痕面积愈合率以及不同的处理因素绘制柱形图(图3)。结果显示,给予EGF处理时,H1EGFRwt细胞的划痕面积愈合率比对照组H1GFP细胞高,两组划痕愈合率数据满足球形分布假设,差异有统计学意义(F=68.49,df=5,P<0.05);不给予任何处理时,H1EGFRwt细胞与H1GFP细胞的划痕面积愈合率数据不满足球形分布假设,多变量方差分析差异无统计学意义(F=66.64,df=5,P>0.05)。此外,由图3还可发现,EGF刺激下在18 h和24 h时,H1EGFRwt细胞与对照组H1GFP细胞相比划痕面积愈合率差异最显著。
三、集落形成实验结果
结果显示,添加刃天青溶液前H1EGFRwt细胞的活细胞数评分为2018.7±116.2,而H1GFP细胞为2 069.7±95.0,两组比较,t=1.32,df=9,P>0.05。加入刃天青后,实验组H1EGFRwt细胞的代谢评分为92 225.2±6 632.1,对照组H1GFP细胞为62 935.7±8 159.2,实验组代谢评分显著高于对照组(t=7.27,df=9,P<0.01),表明 H1EGFRwt细胞与对照组相比有更高的集落形成能力和独立生存能力。
四、Western印迹结果
H1EGFRwt细 胞 在 EGF刺 激 下 pPLCγ、pSTAT5、pSTAT3均被激活,而对照组H1GFP细胞以及不给予EGF处理时的两组细胞均未被激活;pAkt和pMAPK在有无EGF刺激时各组细胞均可表达,但H1EGFRwt细胞给予EGF刺激时表达明显增高。见图4。
讨 论
EGFR在人类肿瘤中常常呈现过表达状态[3],而EGFR的过表达状态与许多人类肿瘤的进展和治疗效果不佳有关,已成为预后不良的标志物。Normanno等[6]证实,EGFR在鳞状细胞癌中呈过表达状态。Oh等[7]和Adamczyk等[8]分别发现宫颈癌和胰腺癌患者血清中EGFR的表达水平增高。而EGFR在黑素瘤中表达情况尚有争议。一方面有研究证实,EGFR对于人葡萄膜黑素瘤细胞的增殖存活很重要,但与其表达水平关系不大[9];另一方面Hurks等[10]发现,EGFR在人葡萄膜黑素瘤中表达,且其表达与存活率之间呈负相关。此外Udart等[11]在晚期黑素瘤中检测到了过表达的EGFR。我们的集落形成实验显示,EGFR过表达的H1EGFRwt细胞与对照组H1GFP细胞相比,H1EGFRwt细胞的独立存活能力以及集落形成能力高于对照组细胞,说明EGFR过表达的H1EGFRwt细胞更容易存活。
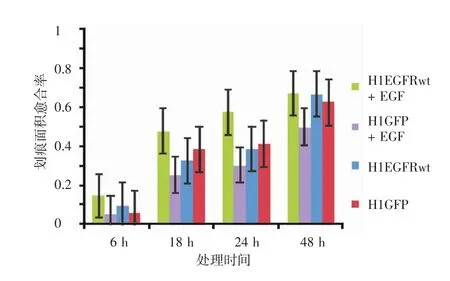
图3 表皮生长因子(EGF)处理不同时间对H1EGFRwt和H1GFP细胞划痕面积愈合程度的影响 EGF处理时H1EGFRwt细胞的划痕面积愈合率比H1GFP细胞高(F=68.49,df=5,P<0.05);不给予任何处理时H1EGFRwt细胞与H1GFP细胞的划痕面积愈合率差异无统计学意义(F =66.64,df=5,P>0.05),而且EGF刺激下在18 h和24 h时H1EGFRwt细胞与对照组H1GFP细胞划痕面积愈合率差异最显著

图4 表皮生长因子(EGF)处理后H1EGFRwt和H1GFP细胞的信号激活情况 1:经EGF处理的H1GFP细胞;2:经EGF处理的H1EGFRwt细胞;3:H1GFP细胞;4:H1EGFRwt细胞
肿瘤转移是一个多因素多步骤的复杂过程,包括黏附、迁移和侵袭等方面的改变[12]。已有研究证实,EGFR过表达与多种肿瘤的生长和转移机制有关[10],但目前对过表达的EGFR参与黑素瘤的发生发展及转移的机制仍不清楚。有研究报道,在黑素瘤转移瘤中可检测到EGFR基因的高频率表达[13]。Slominski等[14]发现,恶性黑素瘤中EGFR的表达增加与肿瘤侵袭和转移的程度之间有相关性。Huang等[15]也发现,EGFR的过表达与人黑素瘤细胞系在裸小鼠实验中的自发转移有相关性。我们的研究发现,过表达的EGFR在EGF的刺激下显著提高了细胞的迁移能力(图2、3),此外,细胞独立存活和集落形成能力的提高也有助于肿瘤细胞的转移以及转移瘤的存活发展。
EGFR所参与的信号转导通路调控着细胞的增殖、分化和凋亡,对肿瘤的发展以及转移有重要作用。Udart等[11]证实,EGFR活性随黑素瘤的发生发展及转移逐渐增强,说明EGFR信号通路与黑素瘤的发生、发展以及转移相关。EGF可结合其受体,促进受体二聚化和自身磷酸化,从而导致各种下游信号分子如MAPK和PI3K/Akt信号激活[16],而MAPK和PI3K/Akt信号通路在肿瘤细胞侵袭和转移的调控中起到关键性的作用[17]。除此之外,STAT3的激活在肿瘤的形成和发展过程中也起到重要作用[18]。研究表明,在黑素瘤肿瘤模型中靶向抑制STAT3可诱导肿瘤消退[19],抑制血管生成[20],预防肿瘤转移[21],促进免疫应答的活化[22-23]。Wellbrock等[24]发现,STAT5过度表达可促进黑素瘤的发生发展,而Wellbrock等[25]在早期还发现,STAT5的激活在黑素细胞向黑素瘤的转化过程中发挥重要作用。Jiang等[26]发现,如果抑制PI3K-Akt和PLCγ-PKC通路可诱导细胞凋亡,说明PI3K-Akt和PLCγ-PKC信号通路在维持细胞存活方面发挥了重要作用。在我们的研究中,H1EGFRwt细胞在EGF刺激下,pPLCγ、pSTAT5、pSTAT3均被激活,pAkt和 pMAPK在H1EGFRwt细胞给予EGF刺激时表达明显高于其他对照组,说明EGFR过表达的情况下,EGF可以刺激EGFR激活或增强磷酸化信号Akt、STAT5、STAT3、PLCγ以及MAPK所参与的各条信号通路,而他们所参与的信号通路对肿瘤细胞侵袭、转移、增殖和存活方面有促进作用,促进了肿瘤的发展和转移。
综上所述,我们的研究证明,EGFR过表达可以提高H1细胞系的独立存活能力,在EGF的刺激下可提高H1细胞系的迁移能力以及激活下游信号pPLCγ、pSTAT5和 pSTAT3, 并且使 pAkt以及pMAPK表达显著增强,从而促进了黑素瘤细胞转移的发生。我们的研究可能为黑素瘤转移的靶向治疗提供了一定的理论依据,从而进一步支持EGFR有可能成为黑素瘤转移治疗的新靶点。
[1]Balch CM,Gershenwald JE,Soong SJ,et al.Update on the melanoma staging system:the importance of sentinel node staging and primary tumor mitotic rate[J].J Surg Oncol,2011,104(4):379-385.
[2]Guida M,Pisconti S,Colucci G.Metastatic melanoma:the new era of targeted therapy[J].Expert Opin Ther Targets,2012,16 Suppl 2:S61-S70.
[3]Boone B,Jacobs K,Ferdinande L,et al.EGFR in melanoma:clinical significance and potential therapeutic target[J].J Cutan Pathol,2011,38(6):492-502.
[4]Wang J,Daphu I,Pedersen PH,et al.A novel brain metastases model developed in immunodeficient rats closely mimics the growth of metastatic brain tumours in patients[J].Neuropathol Appl Neurobiol,2011,37(2):189-205.
[5]SongHW,KumarBK,KimSH,etal.Agmatineenhancesneurogenesis by increasing ERK1/2 expression,and suppresses astrogenesis by decreasing BMP 2,4 and SMAD 1,5,8 expression in subventricular zone neural stem cellsr[J].Life Sci,2011,89(13-14):439-449.
[6]Normanno N,De Luca A,Bianco C,et al.Epidermal growth factor receptor(EGFR)signaling in cancer[J].Gene,2006,366(1):2-16.
[7]Oh MJ,Choi JH,Kim IH,et al.Detection of epidermal growth factor receptor in the serum of patients with cervical carcinoma[J].Clin Cancer Res,2000,6(12):4760-4763.
[8]Adamczyk KA,Klein-Scory S,Tehrani MM,et al.Characterization of soluble and exosomal forms of the EGFR released from pancreatic cancer cells[J].Life Sci,2011,89(9-10):304-312.
[9]Wu X,Zhou J,Rogers AM,et al.c-Met,epidermal growth factor receptor,and insulin-like growth factor-1 receptor are important for growth in uveal melanoma and independently contribute to migration and metastatic potential[J].Melanoma Res,2012,22(2):123-132.
[10]Hurks HM,Metzelaar-Blok JA,Barthen ER,et al.Expression of epidermal growth factor receptor:risk factor in uveal melanoma[J].Invest Ophthalmol Vis Sci,2000,41(8):2023-2027.
[11]Udart M,Utikal J,Krähn GM,et al.Chromosome 7 aneusomy.A marker for metastatic melanoma?Expression of the epidermal growth factor receptor gene and chromosome 7 aneusomy in nevi,primary malignant melanomas and metastases[J].Neoplasia,2001,3(3):245-254.
[12]Friedl P,Locker J,Sahai E,et al.Classifying collective cancer cell invasion[J].Nat Cell Biol,2012,14(8):777-783.
[13]Koprowski H,Herlyn M,Balaban G,et al.Expression of the receptor for epidermal growth factor correlates with increased dosage of chromosome 7 in malignant melanoma[J].Somat Cell Mol Genet,1985,11(3):297-302.
[14]Slominski A,Ross J,Mihm MC.Cutaneous melanoma:pathology,relevant prognostic indicators and progression[J].Br Med Bull,1995,51(3):548-569.
[15]Huang TS,Rauth S,Das Gupta TK.Overexpression of EGF receptor is associated with spontaneous metastases of a human melanoma cell line in nude mice[J].Anticancer Res,1996,16(6B):3557-3563.
[16]Martín-Orozco RM,Almaraz-Pro C,Rodríguez-Ubreva FJ,et al.EGF prevents the neuroendocrine differentiation of LNCaP cells induced by serum deprivation:the modulator role of PI3K/Akt[J].Neoplasia,2007,9(8):614-624.
[17]Kulawiec M,Owens KM,Singh KK.Cancer cell mitochondria confer apoptosis resistance and promote metastasis[J].Cancer Biol Ther,2009,8(14):1378-1385.
[18]Bowman T,Garcia R,Turkson J,et al.STATs in oncogenesis[J].Oncogene,2000,19(21):2474-2488.
[19]Niu G,Heller R,Catlett-Falcone R,et al.Gene therapy with dominant-negative Stat3 suppresses growth ofthe murine melanoma B16 tumorin vivo[J].Cancer Res,1999,59(20):5059-5063.
[20]Niu G,Wright KL,Huang M,et al.Constitutive Stat3 activity upregulates VEGF expression and tumor angiogenesis[J].Oncogene,2002,21(13):2000-2008.
[21]Xie TX,Wei D,Liu M,et al.Stat3 activation regulates the expression of matrix metalloproteinase-2 and tumor invasion and metastasis[J].Oncogene,2004,23(20):3550-3560.
[22]Wang T,Niu G,Kortylewski M,et al.Regulation of the innate and adaptive immune responses by Stat-3 signaling in tumor cells[J].Nat Med,2004,10(1):48-54.
[23]Kortylewski M,Jove R,Yu H.Targeting STAT3 affects melanoma on multiple fronts[J].Cancer Metastasis Rev,2005,24(2):315-327.
[24]Wellbrock C,Weisser C,Hassel JC,et al.STAT5 contributes to interferon resistance of melanoma cells[J].Curr Biol,2005,15(18):1629-1639.
[25]Wellbrock C,Geissinger E,Gómez A,et al.Signalling by the oncogenic receptor tyrosine kinase Xmrk leads to activation of STAT5 in Xiphophorus melanoma[J].Oncogene,1998,16(23):3047-3056.
[26]Jiang YY,Huang H,Wang HJ,et al.Interruption of mitochondrial complex IV activity and cytochrome c expression activated O2·--mediated cell survival in silibinin-treated human melanoma A375-S2 cells via IGF-1R-PI3K-Akt and IGF-1R-PLC γ-PKC pathways[J].Eur J Pharmacol,2011,668(1-2):78-87.
2014-05-02)
(本文编辑:颜艳)
Effect of overexpression of epidermal growth factor receptor on the growth and migration of a brainmetastatic H1 human melanoma cell line
Kang Jing*,Hrvoje Miletic,Guo Shulan.*Shandong University School of Medicine,Jinan 250012,China
Guo Shulan,Email:guoshulan@medmail.com.cn
ObjectiveTo investigate the role of epidermal growth factor receptor(EGFR)in the growth and migration of melanoma.MethodsA brain-metastatic human melanoma cell line H1,which had been developed in our laboratory,was used in this study.Some H1 melanoma cells were stably transfected with wild-type EGFR via lentiviral vectors to overexpress EGFR(H1EGFRwt),and some H1 cells transfected with green fluorescent protein(GFP)served as the control group(H1GFP).After transfection,the cells were sorted and purified.Then,scratch wound healing assay was performed to estimate the migratory activity of H1 cells;colony-forming assay was conducted to investigate the effects of EGFR on the survival ability and colony-forming ability of H1 cells,and resazurin reduction test was used to evaluate colony formation results;Western blot was carried out to measure the expressions of signaling pathways activated by EGFR.Statistical analysis was done by repeated measures analysis of variance(ANOVA)for the comparison of wound-area healing rate,and by pairedttest for the comparison of metabolic activity,between the two groups of H1 cells by using SPSS software version 20.0.ResultsFlow cytometry showed that H1 cells were successfully transfected with EGFR and GFP respectively,and purified H1EGFRwt and H1GFP cells were obtained after cell sorting.The wound-area healing rate at 6,18,24 and 48 hours after epidermal growth factor(EGF)stimulation was 0.145±0.066,0.479±0.096,0.571±0.198 and 0.672±0.199 respectively for H1EGFRwt cells,0.051± 0.036,0.254± 0.038,0.303± 0.077 and 0.498 ± 0.111 respectively for H1GFP cells.The degree of wound healing in H1EGFRwt cells was significantly higher than that in H1GFP cells(F=68.49,df=5,P<0.05).Colony-forming assay revealed that the average metabolic activity score of H1EGFRwt cells was significantly higher than that of H1GFP cells(92 225.2 ± 6 632.1 vs.62 935.7 ± 8 159.2,t=2.26,df=9,P<0.01).Western blot showed that EGF might induce the phosphorylation of downstream signaling proteins such as phosphatidylinositol-specific phospholipase C-γ (PLCγ),signal transducer and activator of transcription 5(STAT5)and 3(STAT3)in H1EGFRwt cells,but not in H1GFP cells.In addition,the expressions of phosphorylated serine/threonine protein kinase(pAKT)and mitogen-activated protein kinase(pMAPK)were significantly higher in H1EGFRwt cells than in H1GFP cells after EGF stimulation.Conclusions EGFR may play an important role in the metastasis of H1 melanoma cells,and might serve as a target in the treatment of metastatic melanoma.
Melanoma;Receptor,epidermal growth factor;Epidermal growth factor
10.3760/cma.j.issn.0412-4030.2014.12.013
250012济南,山东大学医学院(康晶);挪威卑尔根大学生物医学系(Hrvoje Miletic);山东大学齐鲁医院皮肤科(郭淑兰)
郭淑兰,Email:guoshulan@medmail.com.cn
