丝裂霉素膀胱灌注对膀胱癌细胞端粒酶活性的影响
2014-12-06解放军第四六三医院泌尿外科110042刘兴凯姜泰茂石岐兴
解放军第四六三医院泌尿外科(110042)刘兴凯 姜泰茂 石岐兴
刘冬烨 张 勇 张 乐
在我国,男性膀胱癌位居全身肿瘤的第8位,其发病率远较西方国家低[1]。临床上膀胱癌以浅表性肿瘤为多见,约为70%~80%,浅表性膀胱癌患者手术后复发率较高,3年内复发率可达40%~70%[2]。膀胱癌采用化疗药物灌注是目前预防浅表性膀胱癌术后复发的重要措施。由于端粒酶在肿瘤组织中较正常组织明显高表达,因此具有肿瘤标记物的作用,可用于恶性肿瘤的检测[3-4],因此可以选择端粒酶作为评价化疗药物灌注效果的指标。我院于2008年6月~2010年6月,采用丝裂霉素对一组膀胱移行细胞癌患者进行术前膀胱灌注,通过检测膀胱灌注前后肿瘤细胞端粒酶活性变化,从细胞和分子水平探讨丝裂霉素对膀胱肿瘤的作用及机制。现报告如下。
1 资料与方法
1.1 临床资料 膀胱移行上皮细胞癌患者50例,均经病理证实。男29例,女21例。年龄35~86岁,平均70.4岁。临床分期:T1期28例,T2期18例,T3期4例。细胞分级:Ⅰ级26例,Ⅱ级17例,Ⅲ级7例。采用经尿道膀胱肿瘤电切术30例,膀胱部分切除术13例,膀胱全切尿流改道7例。术前膀胱镜检查时留取肿瘤标本。术前1周用丝裂霉素20mg经导尿管缓慢注入膀胱,嘱患者分别仰卧、左右侧卧及俯卧,每15分钟变换一次体位,保留药物2小时。隔天灌注l次,共3次。手术留取肿瘤标本,部分标本离体后l小时内液氮速冻,置-80℃冰箱保存(<3个月),部分标本以10%甲醛固定、石蜡包埋。
1.2 研究方法 端粒酶检测试剂盒购自德国Roche公司;PCR扩增仪为美国PE公司;酶标检测仪为美国Gene公司产品;冷冻高速离心机为日本HITACH公司。采用端粒重复序列扩增法(TRAP-PCRELISA)对速冻膀胱癌组织的端粒酶活性进行相对定量测定,操作方法简述如下:1)端粒酶提取:取膀胱癌组织标本50mg在200μL预冷的裂解液中匀浆化,置碎冰中作用30分钟,在4℃下16000r/min离心20分钟,取上清液保存于-80℃备用。2)TRAPPCR扩增:取待测样品50μg用25μLPCR反应混合液,加入2μL蛋白提取液。再加入无菌双蒸水至50μL,在PCR扩增仪上进行引物延伸与DNA扩增。实验参数如下:引物延伸,25℃20分钟;端粒酶灭活,94℃5分钟;扩增条件为:变性94℃30秒,复性50℃30秒,延伸72℃90秒,共30个循环,再72℃延伸10分钟。3)产物杂交和ELISA检测:取5μL扩增产物,加入20μL变性试剂,在25℃下孵育10分钟,再加入225μL杂交缓冲液混匀。取上述混合液,每孔100μL加入用亲和素预包被的微量反应板的各孔中。300r/min摇床37℃培养2小时。甩净杂交液,250μL洗液每次30秒洗3次,甩干。每孔加入抗DIG-POD工作液100μL,在37℃下300r/min摇床培养30分钟,甩净孔内液体,加入100μL TMB底物溶液,在室温下显色15分钟。每孔加入100μL终止液,用酶标分析仪测定标本450nm波长吸收值(A)。
1.3 判断标准 端粒酶活性测定:使用酶标仪,测定加入终止液后30分钟内其在波长450nm的吸收值,对照试剂盒内标的吸收值和控制模板的吸收值,得到相对定量数值。
1.4 统计学分析 采用SPSS13.0统计软件,计量资料以()表示,组间比较采用t检验和方差分析,P<0.05为差异有显著性。
2 结果
膀胱灌注前后膀胱癌组织的端粒酶活性分别为(12.84±3.53)和(3.88±1.03),灌注后膀胱癌组织的端粒酶活性明显降低,差异有显著性(P<0.05)。
将端粒酶活性降低作为所要分析的变量,将患者年龄、性别、肿瘤大小、肿瘤数量、病理分级、临床分期、发作次数及预后情况分别作为分组变量,进行统计学分析,结果表明,膀胱灌注前后端粒酶活性降低情况与患者年龄、性别、肿瘤数量、病理分级、发作次数无关(P>0.05)。端粒酶活性降低在肿瘤直径>3cm组与≤3cm组之间,临床分期为T2~T3(浸润组)与Tis~T1(非浸润组)之间,复发或转移组与临床痊愈组之间的差异有显著性(P<0.05),见表1。
表1 丝裂霉素膀胱灌注前后肿瘤细胞端粒酶变化情况(,OD值)
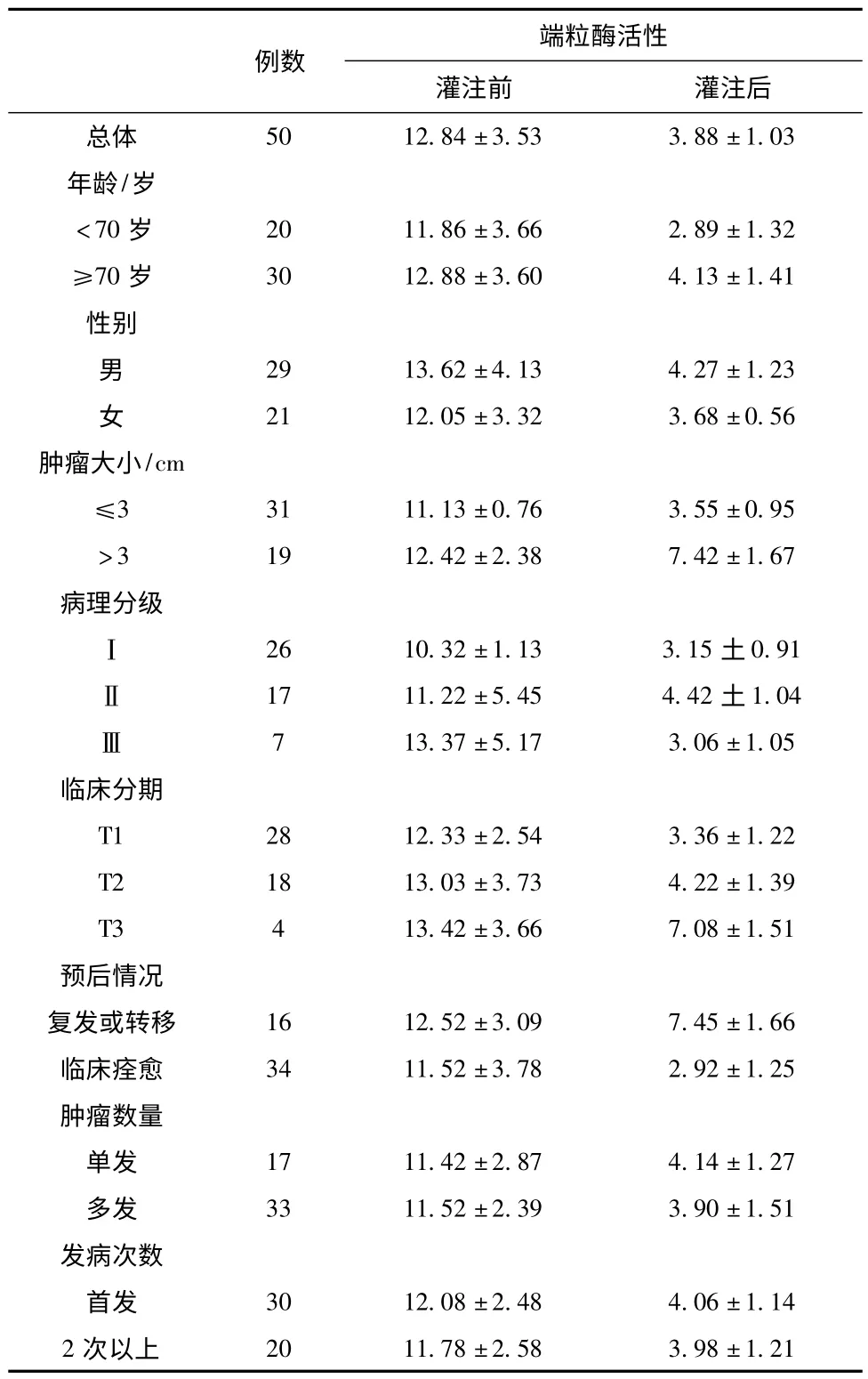
表1 丝裂霉素膀胱灌注前后肿瘤细胞端粒酶变化情况(,OD值)
注:灌注前后端粒酶活性比较,P<0.05;在肿瘤大小、临床分期及预后情况组间比较端粒酶活性变化,P<0.05。
3 讨论
膀胱癌多为浅表性[5],发病率占男性肿瘤的6%,病死率占2.5%,病因不明[6]。吸烟也是膀胱癌重要的致癌因素,其他如膀胱白斑、腺性膀胱炎、尿石等也可能是膀胱癌的诱发因素。膀胱癌临床最常见的首发症状是肉眼血尿,血尿以间断性、无痛性为主。膀胱癌的主要治疗方法为外科手术。但术后易复发,复发位置多不在原手术部位,因此预防术后复发一般都采用膀胱内药物灌注治疗[7]。丝裂霉素是抗生素类抗肿瘤药,为细胞周期非特异性药物,膀胱内极少吸收,药物可直接作用于膀胱肿瘤细胞,与DNA的双螺旋结构形成交联,也能直接作用破坏其DNA链,使之断裂,抑制DNA复制,并有烷化作用。有细胞毒作用,杀死肿瘤细胞,以阻止其复发。
端粒是位于染色体末端的DNA片段,具有稳定染色体结构的功能。端粒酶是重新合成端粒DNA片段的一种核糖核酸蛋白酶,其能维持端粒的长度和功能,使细胞永生化成为癌细胞。端粒酶活性的高低与肿瘤的分化程度有相关性。Hiyama等[8]报道,140例乳腺癌患者中端粒酶阴性者较端粒酶阳性者病程分期早,淋巴结转移率低,肿瘤体积小。Al-banell等[9]对99例原发性肺癌患者的研究也显示,肿瘤组织端粒酶活性与肿瘤的临床生物学行为密切相关。刘兴凯等[10]对肾上腺皮质肿瘤中端粒酶的研究表明,端粒酶活性表达反映了肿瘤细胞的恶性行为,端粒酶活性检测可望成为肾上腺皮质肿瘤良恶性诊断的一种有用方法。Murakami等[11]的研究发现,92%的恶性卵巢肿瘤呈端粒酶阳性,且分化差的恶性肿瘤酶活性明显高于其他肿瘤。研究证实,膀胱癌组织中端粒酶活性阳性率达为86%~100%,而正常膀胱组织中均呈阴性[12-13]。
膀胱癌的复发[14]和转移[15]一直是困扰医学界的难题,而且常常伴随复发的是级别的升高、浸润性的增强和转移的出现。所以如能早期、准确地对有转移可能的患者进行判断和监测,发现肿瘤细胞的存在[16],对治疗方案的确立和对预后的评价都有积极的意义,就有可能帮助我们提高患者的5年生存率,延长生命。由于端粒酶在膀胱肿瘤组织表达的普遍性与特异性,本实验选择其作为监测膀胱肿瘤治疗效果及复发的指标,通过检测丝裂霉素膀胱灌注前后膀胱肿瘤组织的端粒酶活性,来观察丝裂霉素对膀胱癌细胞的杀伤作用,证实了化疗药物可明显抑制端粒酶的表达。因此,本实验认为,监测抗肿瘤前后端粒酶表达水平,可以为临床预测膀胱灌注效果,合理选择抗肿瘤药物,减少不合适患者的药物副作用和不必要的资源浪费,为个体化治疗提供实验依据。
从实验的结果来分析,浸润性膀胱癌患者丝裂霉素膀胱灌注后端粒酶活性下降显著低于非浸润性膀胱癌患者,其差异有显著性,P<0.05;肿瘤直径>3cm膀胱癌患者丝裂霉素膀胱灌注后端粒酶活性下降显著低于肿瘤直径≤3cm膀胱癌患者,差异也有显著性,P<0.05。结果说明丝裂霉素膀胱灌注对膀胱肿瘤的杀伤效果与膀胱肿瘤大小和临床分期有着明确的关系。从以往临床资料和经验,并结合文献报道,肌层浸润性膀胱癌多存在潜在和明确的转移[17],这也是其5年生存率一直很难提高的一个重要原因。根据实验结果我们发现,在浸润性膀胱癌患者中膀胱灌注的疗效明显低于非浸润性膀胱癌患者,该结果与肌层浸润性膀胱癌更易转移的现象有明显相关性。当膀胱肿瘤较大或浸润至肌层,丝裂霉素膀胱灌注时对肿瘤细胞的持续杀伤作用不完全,因此可能影响效果,表现在端粒酶活性下降幅度较低。
所有膀胱癌患者经过3年随访,分为复发或转移组和临床治愈组,经统计分析发现,复发或转移组丝裂霉素膀胱灌注后端粒酶活性下降幅度较小;而临床痊愈组端粒酶活性下降明显,两者差异有显著性(P<0.05)。这表明丝裂霉素敏感者预后佳,证明丝裂霉素对膀胱癌的治疗及预防复发有显著作用,能有效地抑制膀胱癌组织的细胞端粒酶活性,诱导肿瘤细胞凋亡[18]。对于丝裂霉素膀胱灌注后端粒酶活性下降小者,可加强术后检查监测,必要时行膀胱镜检查,若有复发早期发现。同时也可选择其他化疗药物,如羟喜树碱、阿霉素等膀胱灌注,或许会取得一定的疗效。
[1]金美花,德伟林.联合检测尿HAase和NMP-22活性水平在膀胱癌诊断和手术后复发的研究[J].中国实验诊断学,2010,16:947
[2]李振勇,徐求是.羟基喜树碱膀胱灌注预防表浅性膀胱癌术后复发[J].临床肿瘤学杂志,2000,5:54
[3]Safont,MJ,Gil M,Sirera R,et al.The prognostic value of hTERT expression levels in advanced-stage colorectal cancer patients:a comparison between tissue and serum expression[J].Clin Transl Oncol,2011,13(6):396
[4]Rahmati-Yamchi M,Zarghami N,Rahbani M,et al.Plasma leptin,hTERT gene expression,and anthropometric measures in obese and non-obese women with breast Cancer[J].Breast Cancer,2011,5:27
[5]吴阶平.吴阶平泌尿外科学[M].济南:山东科学技术出版社,2004:952
[6]Hashimura T,Shirahase T,Inoue T,et a1.A randomized study ofprophylactic intravesical instillation of pirarubicin(THP)prior to transurethral resection of superficial bladder cancer[J].Hin-yokika Kiyo,2005,51:439
[7]兰卫华,靳风烁,王洛夫,等.卡介苗与丝裂霉素C膀胱灌注预防浅表性膀胱癌复发疗效及毒性比较的Meta分析[J].中华泌尿外科杂志,2006,27:29
[8]Hiyama E,Kageyama Y,Yonese J,et al.Telomerase activity in human breast tumors[J].J Natl Cancer Inst,1996,88:116
[9]Albanell J,Lonardo F,Rusch V,et al.High telomerase activity in primary lung cancers[J].JNatl Cancer Inst,1997,89:1609
[10]刘兴凯,杨敬进,袁勤民,等.端粒酶在肾上腺皮质肿瘤中的表达及其临床意义「J].解放军医学杂志,2003,28(6):558
[11]Murakami J,Nagai N,Ohama K,et al.Telomerase activity in ovarian tumors[J].Cancer,1997,80(6):1085
[12]Rahat MA,Lahat N,Gazawi H,et al.Telomerase activity in patients with transitional cell carcinoma:apreliminary study[J].Cancer,1999,85(4):919
[13]Wu WJ,Liu LT,Huang CH,et al.Telomerase activity in human bladder tumors and bladder washing specirnens[J].Kaohsiung J Med Sci,2001,17(12):602
[14]Brems-Eskildsen AS,Zieger K,Toldbod H,et al.Prediction and di-agnosis of bladder cancer recurrence based on urinary content ofhTERT,SENP1,PPP1CA,and MCM5 transcripts[J].BMC Cancer,2010,10:646
[15]Belair CD,Yeager TR,Lopez PM,et al.Telomerase activity:a biomark-er of cell proliferation,not malignant transformation[J].Proc Natl AcadSci U SA,1997,94(25):13677
[16]汪彬哲,邓晓芳,胡伟民.恶性肿瘤细胞血循环微转移检测进展[J].现代肿瘤医学,2009,17(7):1378
[17]Sexton WJ,Wiegand LR,Correa JJ,et al.Bladder cancer:a review ofnon-muscle invasive disease[J].Cancer Control,2010,17(4):256
[18]宋永胜,杨威,符伟军,等.抑制端粒酶活性诱导膀胱癌细胞凋亡的研究[J〕.中华泌尿外科杂志,2001,22(12):738
