抑郁症大鼠海马体积异常的形态学探讨
2014-11-17徐爱军李世英王凤玲王海涛
徐爱军, 刘 昊, 刘 英, 李世英, 张 蕊, 王凤玲, 王海涛
抑郁症(depression)是一种情感性精神疾病,临床表现以情绪低落为主要特征,严重时甚至伴随幻觉妄想和自杀倾向。抑郁症的严重性和危害性越来越受到重视,但其发病机制迄今尚未完全阐明。目前已经证实,抑郁症患者海马容积存在明显萎缩现象[1~4]。探讨抑郁症患者海马萎缩的原因对于揭示抑郁症发病机制有重要意义。我们推测在抑郁症发病过程中,海马部位神经元异常死亡,造成神经元减少或丢失。为验证这一假设,本实验建立抑郁症大鼠模型,观察海马神经元形态改变,检测神经元凋亡和自噬的发生,为揭示抑郁症海马体积异常原因提供实验依据。
1 材料和方法
1.1 实验动物 健康成年雄性SD大鼠40只,体重220~260 g(河北联合大学实验动物中心提供,动物合格证编号:SCXK京2009-0004),适应性饲养7 d后用于实验。
1.2 试剂药品与仪器 LC-3兔多克隆抗体、Beclin 1羊多克隆抗体和β-actin鼠单克隆抗体(Santz Cruz,美国);免疫印迹相关试剂(武汉博士德生物工程有限公司);蛋白电泳系统(北京六一);高灵敏度化学发光系统(Bio-RAD,美国)。
1.3 动物分组和模型建立 将大鼠随机分为对照组(20只)和模型组(20只)。对照组大鼠除每天抓取一次外不做特殊处理。模型组大鼠给予慢性不可预见性温和应激(CUMS),建立抑郁模型。应激包括11种:鼠笼45℃倾斜24 h,潮湿垫料24 h,行为限制3 h,4℃冰水游泳5 min,42℃热水游泳5 min,禁食24 h,禁水 24 h,夹尾 1 min,鼠笼摇动 15 min,持续光照36 h,双耳电击5 s(0.8 mA)。将上述11种应激随即分配到21 d内,每日给予大鼠一种应激,每种应激平均出现2次,同种应激不连续出现。
1.4 大鼠海马尼氏染色 将两组大鼠用10%水合氯醛腹腔注射麻醉,4%多聚甲醛PBS缓冲液经心脏灌流固定,分离脑组织,常规石蜡包埋,冠状切片,片厚5μm。将石蜡切片常规脱蜡至水,尼氏染液室温染色30 min。用蒸馏水冲洗3次,梯度酒精脱水,二甲苯透明,树脂封片。光学显微镜下观察。
1.5 流式细胞术检测海马神经元凋亡 将两组大鼠各麻醉后断头取脑。根据图谱,在立体显微镜下取右侧海马,制成细胞悬液,细胞浓度为5×105/ml-1×106/ml。取1 ml细胞,1000 r/min 4 ℃离心10 min,弃上清,加入1 ml预冷PBS,轻轻振荡使细胞悬浮。重复操作3次,弃上清。将细胞重悬于200μl Binding Buffer液中,加入 10μl Annexin VFITC和5μl Propidium Iodide,轻轻混匀,避光室温反应15 min。加入300μl Binding Buffer液,上机检测。
1.6 Western blotting检测海马LC-3和Beclin-1 将两组大鼠麻醉后断头取脑。根据图谱,在体视显微镜下快速分离海马,提取组织总蛋白。定量后按照30μg蛋白量上样,进行12%SDS-PAGE电泳,PVDF膜电转印,脱脂奶粉封闭,一抗(LC-3,1:400;Beclin-1,1:400)4℃孵育过夜,二抗IgG(1:5000)室温孵育1 h,ECL显色。同样方法进行内参照β-actin的Western blotting分析。以目的条带与内参照的光密度比值表示目的蛋白的相对表达。
1.7 统计学分析 应用SPSS13.0统计分析软件对数据进行统计分析,数据均以均值±标准差(χ±s)表示,进行t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 海马神经元形态改变 尼氏染色显示对照组大鼠海马锥体细胞层厚,细胞密度大,排列整齐、紧密,胞体饱满,突起明显。模型组大鼠海马锥体细胞层变薄,细胞间隙大,排列疏松,体积明显缩小,细胞核萎缩,突起减少(见图1)。
2.2 流式细胞术检测结果 模型组和对照海马神经元组细胞凋亡率分别为17.14±2.71和3.34±0.80,模型组高于对照组(P <0.05)。
2.3 海马组织LC-3和Beclin 1表达 LC-3的表达呈现深浅不同的两条条带LC-3Ⅰ和LC-3Ⅱ。对免疫印迹图像进行定量分析,结果显示模型组海马LC-3Ⅱ/LC-3Ⅰ比值和Beclin 1相对表达均高于对照组,差异具有统计学意义(P<0.05,见表1、图2)。

表1 两组大鼠海马LC-3和Beclin 1表达水平(n=5,χ±s)
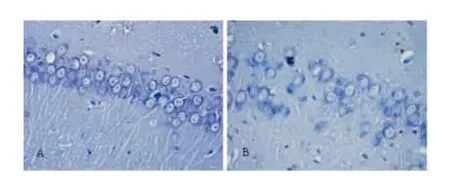
图1 大鼠海马尼氏染色图像(200×)。A:对照组;B:模型组

图2 两组大鼠海马LC-3和Beclin 1的表达
3 讨论
研究发现[5,6],抑郁症患者存在脑形态结构的改变,以海马和杏仁核等部位尤为明显。海马萎缩是抑郁症的病理特征之一[7]。本实验采用尼氏染色和透射电子显微镜观察海马神经元结构改变。结果表明模型组大鼠海马锥体细胞层变薄,细胞间隙大,排列紊乱、疏松,细胞结构不完整,甚至有细胞缺失,提示抑郁症大鼠海马部位存在明显的神经细胞死亡。细胞的死亡方式有程序性死亡和坏死,前者包括凋亡和自噬。创伤后应激障碍患者同样存在海马萎缩现象,其原因可能与海马部位存在明显的神经细胞凋亡现象有关[8,9]。
本研究建立应激抑郁模型,采用流式细胞术检测海马神经元的凋亡情况。结果表明,与对照组比较,模型组大鼠海马细胞凋亡率显著增高。提示慢性应激抑郁大鼠海马存在明显的细胞凋亡现象。哺乳动物的自噬相关基因有微管相关蛋白轻链-3(LC-3)和Beclin-1。在哺乳动物细胞内,存在两种形式的LC-3,即LC-3Ⅰ和LC-3Ⅱ。其中,LC-3Ⅰ向LC-3Ⅱ转化或者LC-3Ⅱ和LC-3Ⅰ的比例增大与自噬泡的形成数量相关,LC3-Ⅱ被认为是自噬体的标志分子[10]。Beclin-1参与自噬体的早期形成过程,是自噬重要的正调节因子。Yu等在成年大鼠大脑皮层、海马等部位检测到高表达的Beclin-1,提示这些部位细胞自噬活跃[11]。
本研究结果显示,抑郁症模型大鼠海马自噬标志分子LC-3Ⅱ比例增高,Beclin-1明显上调。这均提示抑郁症大鼠海马神经元存在明显的细胞自噬。
自噬也被称为Ⅱ型程序性死亡,是细胞通过单层或双层膜包裹待降解物形成自噬体,运送到溶酶体形成的自噬溶酶体并进行多种酶的消化和降解,以实现细胞本身的代谢需要和细胞器的更新。自噬对细胞起保护和引发死亡的双重作用[12]。正常情况下,细胞自噬处在比较低的基础水平。在轻度应激时,自噬作为促生存机制,被适度激活以保护细胞免于凋亡和坏死;而在严重刺激时,自噬被过度激活引起细胞发生程序性死亡,参与多种疾病的发生与发展。本研究结果提示,抑郁症大鼠海马神经元存在明显的凋亡和自噬,这可能是导致海马缩小的原因。凋亡和自噬二者关系复杂。海马神经细胞存在明显的细胞凋亡和自噬,两者在抑郁症发病中的关系有待进一步深入研究。
[1]Neumeister A,Wood S,Bonne O,et al.Reduced hippocampal volume in unmedicated,remitted patients with major depression versus controls[J].Biol Psychiatry,2005,57:935-937.
[2]Ahdidan J,Hviid LB,Chakravarty MM,et al.Longitudinal MR study of brain structure and hippocampus volume in major depressive disorder[J].Acta Psychiatr Scand,2011,123:211-219.
[3]Amico F,Meisenzahl E,Koutsouleris N,et al.Structural MRI correlates for vulnerability and resilience to major depressive disorder[J].J Psychiatry Neurosci,2011,36:15-22.
[4]Malykhin NV,Carter R,Seres P,et al.Structural changes in the hippocampus in major depressive disorder:contributions of disease and treatment[J].J Psychiatry Neurosci,2010,35:337-343.
[5]Drevets WC,Price JL,Furey ML.Brain structural and functional abnormalities in mood disorders:implications for neurocircuitry models of depression[J].Brain Struct Funct,2008,213:93-118.
[6]夏 军,陈 军,周义成,等.抑郁患者海马及杏仁核容积异常的MRI研究[J].中华放射学杂志,2005,39:140-143.
[7]Golub Y,Kaltwasser SF,Mauch CP,et al.Reduced hippocampus volume in the mouse model of posttraumatic stress disorder[J].JPsychiatr Res,2011,45:650-659.
[8]Li XM,Han F,Liu DJ,et al.Single-prolonged stress induced mitochondrial-dependent apoptosis in hippocampus in the rat model of post-traumatic stress disorder[J].J Chem Neuroanat,2010,40:248-255.
[9]Ding JL,Han F,Shi YX.Single-prolonged stress induces apoptosis in the amygdala in a rat model of post-traumatic stress disorder[J].J Psychiatr Res,2010,44:48-55.
[10]Wu JX,Dang YJ,Su W,et al.Molecular cloning and characterization of rat LC3A and LC3B-Two novel markers of autophagosome[J].Biochem Bio Res Commun,2006,339:437-442.
[11]Yu WH,Kumar A,Peterhoff C,et al.Autophagic vacuoles are enriched in amyloid precursor protein-secretase activities:implications for beta-amyloid peptide over-production and localization in Alzheimer’s disease[J].Int JBiochem Cell Biol,2004,36:2531-2540.
[12]Ciechomska IA,Gabrusiewicz K,Szczepankiewicz AA,et al.Endoplasmic reticulum stress triggers autophagy in malignant glioma cells underging cyclosporine A-induced cell death[J].Oncogene,2013,32:1518-1529.
