当前我省新版GMP认证存在问题及对策研究
2014-11-05福建省药品不良反应监测中心350001吴正善
福建省药品不良反应监测中心(350001)吴正善
福建省柘荣县食品药品监督管理局(355300)刘晓霞
自2011年3月国家实施《药品生产质量管理规范(2010年修订)》[1](以下简称“新版GMP”)以来,各地区加大宣传实施力度,部分药品生产企业已经率先通过新版GMP认证,发挥了良好的示范带头作用。但总体来看,距离实现预期目标仍有较大差距,有的地方推进缓慢,少数企业存在等待观望心理,实施进展不平衡的问题仍很突出,特别是无菌制剂生产要在2013年底实现预期目标,任务尤为紧迫。为更好地推进我省新版GMP,笔者从认证管理的角度对福建省2011年5月~2013年6月药品生产企业新版GMP认证检查中发现的主要问题进行分析,以期为相关工作提供参考。
1 检查工作基本情况
截止2013年6月底,我省共组织新版GMP现场检查17次,涉及企业16家(有1家企业2次申请),认证范围涉及片剂、胶囊剂、乳膏剂、软膏剂、搽剂、丸剂、洗剂、口服溶液剂、栓剂、糖浆剂、煎膏剂、原料药、中药饮片、医用氧(气态)等。检查结果见附表1。
2 现场检查发现的缺陷项目概况
2.1 缺陷项数量情况 经对现场检查报告的审查,17次现场检查合计发现缺陷233项,其中严重缺陷0项;主要缺陷18项;一般缺陷215项。单次检查发现主要缺陷最多者3项,最少者0项;单次检查发现一般缺陷最多者17项,最少者9项。
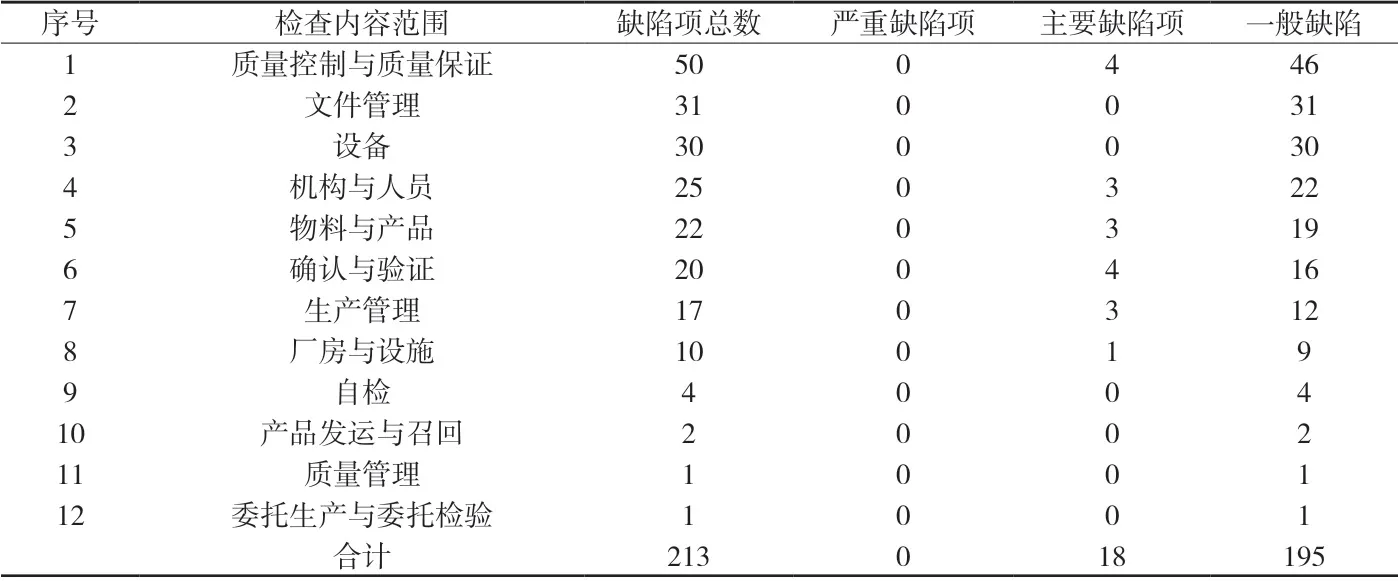
2.2 缺陷项分布情况 除总则及附则外,新版GMP正文的12章节中均发现存在缺陷项。通过对现场检查存在的缺陷项进行统计分析后发现,缺陷相对集中在质量控制与质量保证、文件管理等2个章节,其次为设备、机构与人员、物料与产品、确认与验证、生产管理、厂房与设施等6个章节,自检、产品发运与召回、质量管理、委托生产与委托检验等章节缺陷项较少。缺陷数目情况详见附表2。(注:该附表仅对GMP正文213条缺陷进行统计,未将20项附录缺陷项列入)
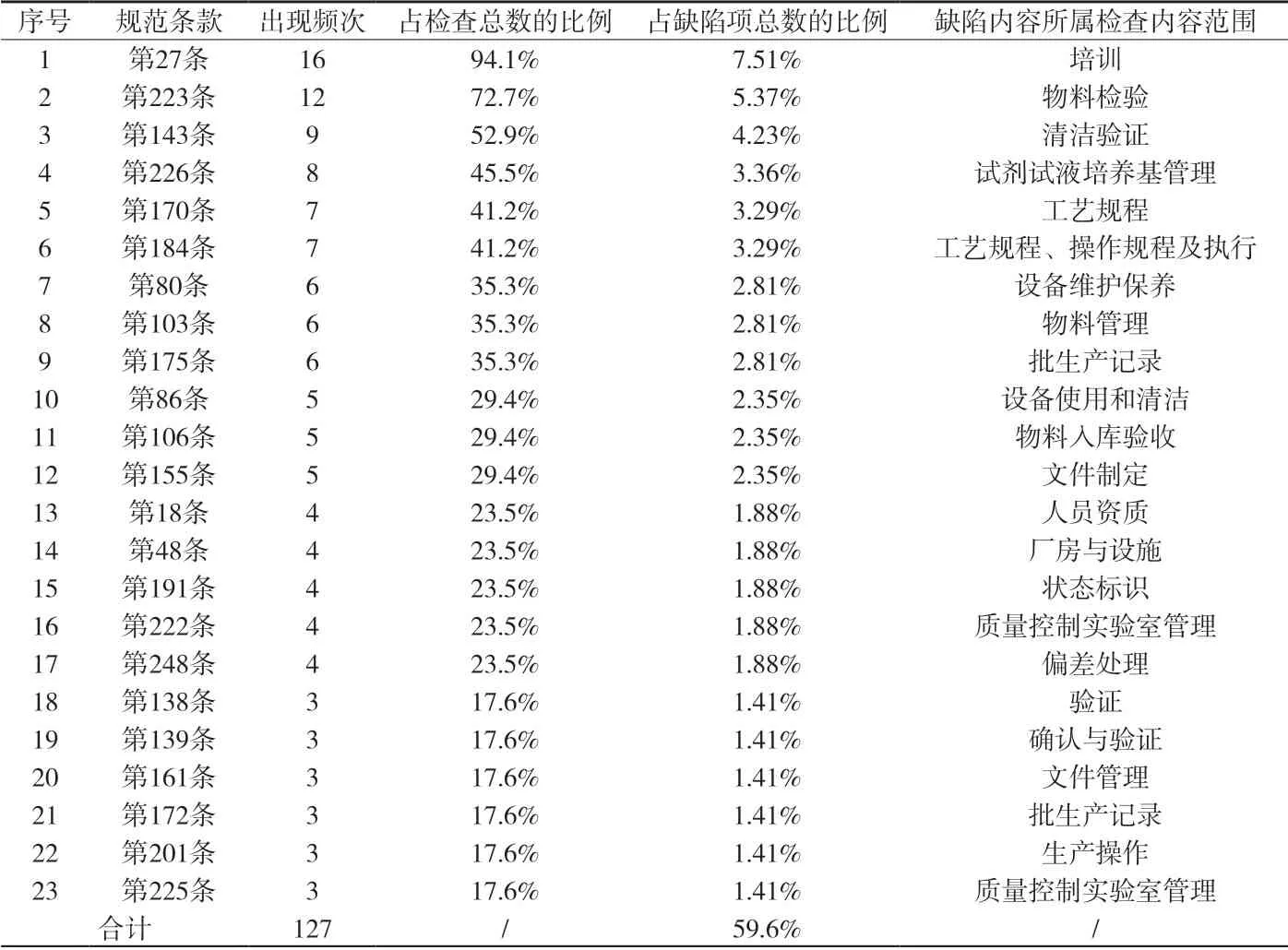
2.3 缺陷项出现频次情况 上述现场检查发现的213条缺陷项,共涉及规范内容96条,其中出现3次以上(含3次)的缺陷内容共有23项,合计130项,占检查发现总缺陷项目数的61.0%。各缺陷项出现频次情况详见附表3。
3 现场检查缺陷项目分析
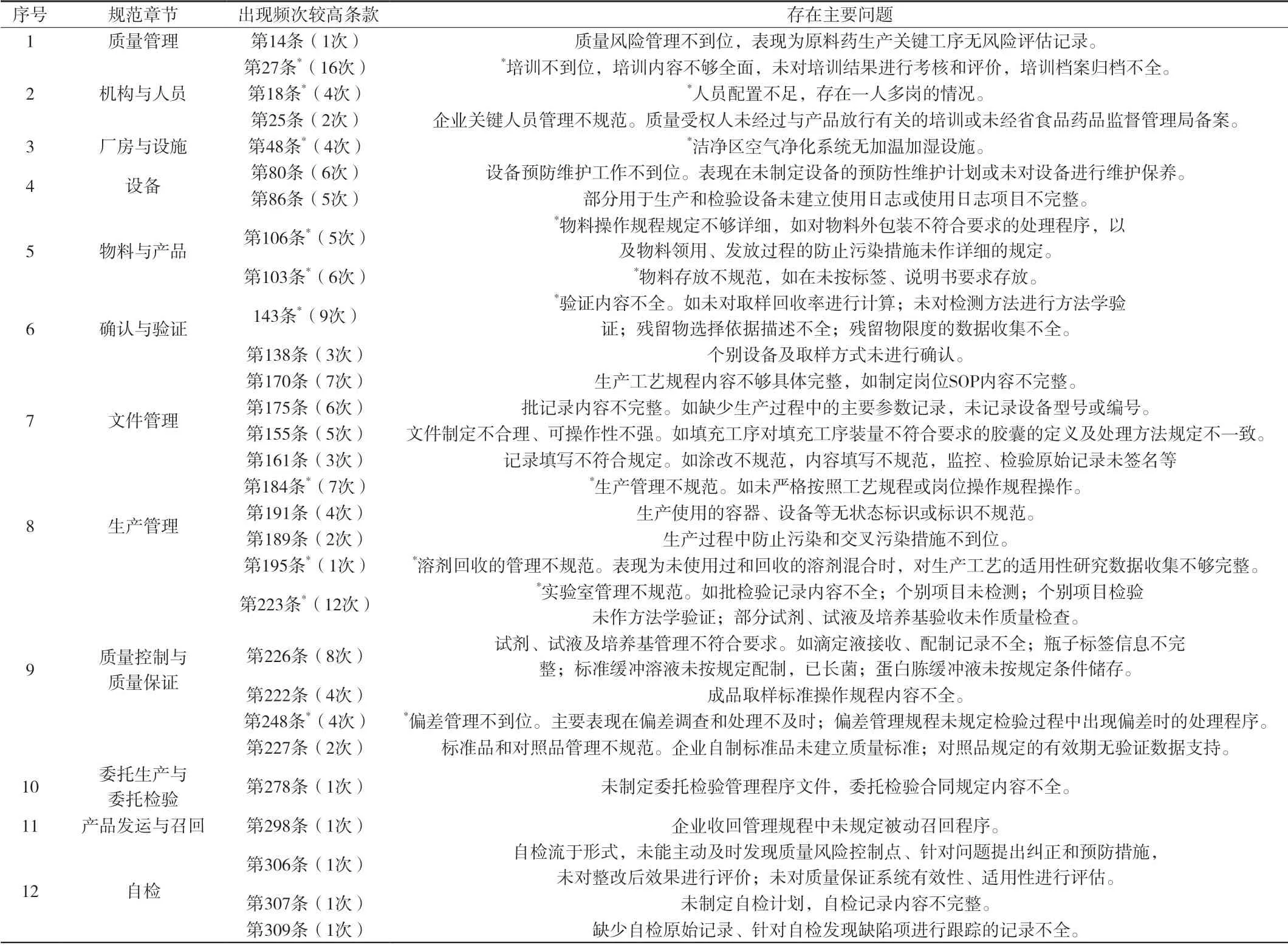
16家企业出现频次较高缺陷项目[2]及存在主要问题,详见附表4。
4 实施新版GMP存在的主要问题
经对检查中发现缺陷项目的综合分析,新版GMP实施过程中主要存在以下四方面问题。
4.1 部分企业对新版GMP实质理解不到位部分企业未能从质量管理体系和风险管理体系高度上准确把握新版GMP精髓,未完全主动将药品GMP的精髓有机地融入到其质量体系管理的各个环节中,产品质量的风险管理在生产操作中还未得到有效贯彻,将新版GMP简单的理解为硬件改造和软件增补。企业在改造新版GMP中,仍把95%的资金投在硬件改造上,硬件设计过度依赖设计院、机械设备过多依托设备厂家,不善于把质量管理体系各主要要素有机结合起来,摸索出一套适合新版GMP要求的体系架构。
4.2 企业质量管理制度与实际操作分离 部分企业未能结合自身的品种剂型特点、管理模式、人员结构、现有的生产条件以及如何有效降低质量风险的实际,客观地起草编写操作规程,而是更多地停留在表面文章上,生搬硬套、机械应用,导致制定的规程不具有操作的一致性和重现性,风险控制意识不强,与实际操作形成相分离,形成“二张皮”。
4.3 企业质量管理和岗位操作人员素质亟待提高 从上述缺陷项目中可以看出,企业有的岗位操作规程该规定的内容没有规定;有的生产或检验操作过程该记录的内容未记录、该复核的未复核;有的生产过程中出现偏差不知道该如何处理;有的仓管人员对产品不按规定放行等,均不同程度地反映出企业质量管理人员及技术人员质量管理意识淡薄,专业水平不高的问题。
4.4 检查员队伍专业水平参差不齐 目前药品GMP认证检查员的专业水平、检查能力与新版GMP要求还存在不少差距。部分认证检查员对条款的解读以及对缺陷项目的评价还存在一定差异。新版GMP现场检查要求检查员必须具备广泛的专业知识和丰富的药品生产经验,而部分资深检查员轮岗后基本无法参加现场检查,新培训检查员的知识和经验不足尚不能独立开展药品检查工作,由此造成高素质检查员抽调难的问题。

附表1 检查结果表
附表2 缺陷内容分布表(按出现频次高低排序)
附表3 现场检查项目出现频次情况表(按出现频次高低排序)
5 建议
5.1 严格执行规定,维护政策的严肃性 目前我省部分老企业仍存在等待观望的侥幸心理,希望国家总局今后会有延期实施或其他宽松政策出台。因此,笔者建议:①应进一步加大实施新版GMP的宣传力度,提高企业实施新版GMP的主动性与自觉性,并积极采取措施,帮助企业解决在实施新版GMP过程中遇到的实际困难和问题,推动新版GMP的有效实施;②对2013年底前未达到新版GMP要求的高风险生产企业,应严格按照规定一律责令停产,给还在等待观望的普通制剂生产企业以警示作用,同时也维护政策的严肃性。
5.2 注重源头设计,尽快出台医药设计领域的指导原则 质量源于设计,新版GMP强调企业应根据自己的使用目的、环境、用途等对设备、厂房、硬件设施系统等提出自己的期望使用需求说明,编制针对自身产品的个性化URS(用户需求说明)方案。URS是用户对该设备/系统的具体输出要求的详尽描述,是设备/系统的设计依据,决定了设备/系统的性能,是实现新版GMP的根本要素和风险管理的基础。笔者建议尽快出台医药设计领域的规范或指导原则,促进国内设计人员深入领会新版GMP精神,促进设计人员与GMP认证人员对新版GMP理解和认识的有机统一,从而使质量风险管理思想在设计的全过程中得以体现。
5.3 加大培训力度,提升企业人员素质据对企业实施新版GMP的调查摸底,绝大部分企业对实施新版GMP不是不想做,而是不知道怎么做才能少走弯路。新版GMP的规定如何准确地理解和把握,对此企业比较茫然。同时,针对新版GMP实施以来企业普遍存在的内部培训不到位,人员素质较低,质量管理意识不强等重点问题,建议省局及企业所在地设区市局能进一步加强对企业法人,质量管理人员以及关键技术岗位人员的重点培训,同时进一步加大对药品生产企业实施新版GMP的帮促指导力度,有效推动我省新版GMP的贯彻实施。
附表4 16家企业缺陷项目概况
5.4 建立专职检查员队伍,确保认证公平、公正 一支相对稳定的药品GMP检查员是保证检查任务完成的重要前提条件。药品GMP检查员专职化,既是国际通行的做法,也是切实强化培训、保证培训质量、提高检查员素质的有利条件。目前,北京市、广东省已率先积极探索专职检查员队伍的建设,并取得明显成效[3]。笔者建议,在省级药品认证机构中建立专职检查员队伍,让检查员有更多的时间钻研药品GMP专业的知识,有更多的时间参与检查,积累更多的实践经验。通过选派专职检查员参加,起到督促和指导企业正确实施GMP作用,并逐步提高我省药品GMP认证工作水平。同时,还应积极探索建立检查员选派、培训、监督、考核的一套管理机制,确保GMP检查工作能够更加规范、统一。
5.5 理性看待认证,妥善处理善后问题要认真贯彻落实原国家食品药品监督管理局、国家发展改革委、工业和信息化部、原卫生部《关于加快实施新修订药品生产质量管理规范促进医药产业升级有关问题的通知》(国食药监安〔2012〕376号)[4]确定的各项政策措施,鼓励有条件的企业积极改造,早日通过认证。对于不具备条件的企业,鼓励其主动放弃认证,允许其现有药品技术在规定期限内转让给已通过新修订药品GMP认证的企业。对于因实施新修订药品GMP而停产关闭的药品生产企业,要提前预判,制定预案,妥善处理善后问题,切实维护社会稳定。
