α-平滑肌肌动蛋白及纤溶酶原激活物抑制物-1在增生性瘢痕中的表达及意义
2014-11-01范巨峰
周 璐, 范巨峰
实验研究
α-平滑肌肌动蛋白及纤溶酶原激活物抑制物-1在增生性瘢痕中的表达及意义
周 璐, 范巨峰
目的通过检测分析α-平滑肌肌动蛋白及纤溶酶原激活物抑制物-1在增生性瘢痕及正常皮肤组织中表达的差异,阐明α-平滑肌肌动蛋白及纤溶酶原激活物抑制物-1与增生性瘢痕的关系及意义。方法通过荧光免疫组织化学的方法检测9例增生性瘢痕和9例正常皮肤组织中α-平滑肌肌动蛋白和纤溶酶原激活物抑制物-1的含量与分布,用共聚焦显微镜观察并拍照,用ImageJ软件处理共聚焦显微镜图像分别获得正常皮肤组织与增生性瘢痕中α-平滑肌肌动蛋白和纤溶酶原激活物抑制物-1的平均荧光强度。通过荧光免疫组化、共聚焦显微镜及ImageJ软件3种方法,定量分析 α-平滑肌肌动蛋白和纤溶酶原激活物抑制物-1与增生性瘢痕的关系。结果α-平滑肌肌动蛋白和纤溶酶原激活物抑制物-1在正常组织与增生性瘢痕组织中均有表达,但表达量及分布有所差别。通过分析荧光免疫组化图像中α-平滑肌肌动蛋白和纤溶酶原激活物抑制物-1的平均荧光强度发现:①α-平滑肌肌动蛋白在增生性瘢痕中的表达量较正常皮肤组织明显增高,差异有显著的统计学意义(P<0.01);②纤溶酶原激活物抑制物-1在增生性瘢痕与正常皮肤组织中的表达,差异无明显的统计学意义(P>0.01)。结论在正常皮肤与增生性瘢痕中,均有α-平滑肌肌动蛋白和纤溶酶原激活物抑制物-1的表达,α-平滑肌肌动蛋白在增生性瘢痕中的表达量明显高于正常皮肤组织,表明α-平滑肌肌动蛋白对增生性瘢痕的形成有一定意义;纤溶酶原激活物抑制物-1在增生性瘢痕与正常皮肤组织中的表达量差异无明的显统计学意义。
增生性瘢痕; α-平滑肌肌动蛋白; 纤溶酶原激活物抑制物-1; 荧光免疫组织化学
人体创伤的修复会导致瘢痕形成,增生性瘢痕及瘢痕疙瘩的病理学特征是成纤维细胞的增殖及基质蛋白的过度沉积[1]。增生性瘢痕与瘢痕疙瘩相比,具有挛缩的特性。增生性瘢痕的挛缩与细胞骨架运动密切相关,α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)则起到关键的作用[2]。 在组织器官纤维化的病理过程中纤溶系统有重要的作用[3],纤溶酶原激活物抑制物-1(plaminogen activator inhibitor-1, PAI-1)在瘢痕疙瘩中表达明显增高,但PAI-1与增生性瘢痕相关文献较少,二者关系至今并不明确。自2013年3月至2014年1月,笔者对α-SMA及PAI-1在增生性瘢痕和正常皮肤组织的表达是否存在差异进行了研究,从而为进一步地研究提供依据。
1 对象与方法
1.1 标本来源 标本均来自首都医科大学附属北京朝阳医院整形外科的手术患者,共18例,实验组与对照组所取组织均为手术中弃去组织。实验组增生性瘢痕9例。男性4例,女性5例;年龄15~42岁。形成时间1个月至2年,瘢痕组织取自面部、颈部及手部,受伤原因为烧伤及手术切口;对照组正常皮肤9例。男性3例,女性6例;年龄17~34岁。正常组织取自额部、眼睑及颈部,患者无病理性瘢痕家族史。
1.2 主要试剂 一抗抗体:兔抗人Anti-PAI1,Anti-alpha smooth muscle Actin antibody,均购自英国ABCAMBCAM公司;二抗抗体:羊抗兔DyLight 594 AffiniPure Goat Anti-Rabbit IgG, DyLight 488 AffiniPure Goat Anti-Rabbit IgG antibody,均购自美国EARTHOX公司;DAPI,武汉博士德生物公司。
1.3 实验方法 选用荧光免疫组化、共聚焦显微镜和ImageJ软件分析3种方法,利用对共聚焦显微镜拍照并分析图像,确定α-SMA及PAI-1在增生性瘢痕及正常皮肤组织中的表达量。实验步骤如下:①将组织用4%多聚甲醛固定12~14 h,用OCT包埋后冷冻切片机切片,厚度为30 μm;②用5%BSA将标本室温封闭1~2 h;③将一抗Anti-PAI-1及Anti-α-SMA抗体加入标本组织,抗体浓度为1∶100,在冰箱4 ℃放置12~14 h;④用PBS冲洗3次,每次5 min。冲洗完毕后,加入荧光二抗及细胞核染料DAPI,避光操作。荧光二抗抗体浓度为1∶200,室温孵育1.5~2.5 h;⑤用PBS冲洗4次,每次5 min。冲洗完毕后用抗荧光猝灭剂封片;⑥用Zeiss710-3channel激光共聚焦显微镜观察,设定参数后拍照,严格控制拍照条件;⑦使用ImageJ处理图像,分别得到每个样本中α-SMA和PAI-1的平均荧光强度,再通过SPSS 17.0软件分析结果。
2 结果
2.1 α-SMA在增生性瘢痕组织与正常皮肤组织中的表达 α-SMA在增生性瘢痕中的表达比在正常皮肤组织中明显增加。增生性瘢痕中α-SMA排列成束,方向一致整齐;正常皮肤组织中α-SMA多位于血管周围,表达量较少,与瘢痕组织中α-SMA分布差异明显(图1)。PAI-1在增生性瘢痕及正常组织中均有表达。正常皮肤组织中PAI-1在真皮表达广泛,表皮表达较少;在增生性瘢痕中PAI-1表达部位无明显差异(图2)。
2.2 用ImageJ软件分析 共聚焦图像中增生性瘢痕组织与正常皮肤组织中α-SMA及PAI-1的平均荧光强度,见表1,2。
3 讨论
增生性瘢痕与瘢痕疙瘩的特点是大量的成纤维细胞增生,胞外基质中胶原蛋白、糖蛋白、蛋白多糖等过度沉积,胶原纤维呈束状排列,丧失正常皮肤附属器的结构与功能[4]。在增生性瘢痕中,α-SMA是肌成纤维细胞的标志物之一,通常认为肌成纤维细胞可以表达α-SMA[5]。在肌成纤维细胞中,α-SMA的肌动蛋白微丝终末端位于肌成纤维细胞表面的一种附着复合物上,通过跨膜整合素与胞外纤连蛋白相连[6]。正常伤口愈合过程中,肌成纤维细胞暂时性表达,可引起伤口的收缩,随着真皮再塑形,含有α-SMA的肌成纤维细胞会凋亡消失,而病理性的愈合则可能使其持续表达[7]。Wang等[8]在猪的烧伤动物模型中发现,α-SMA的表达量和瘢痕的大小成反比,α-SMA表达量越高,瘢痕面积越小,并且会影响瘢痕的厚度和上皮再生的时间。陈蕾等[9]的研究结果表明,挛缩瘢痕组织中α-SMA、β-及γ- 胞质肌动蛋白均表达增加,在去除-SMA基因的小鼠中,创面收缩受抑制,TGF- 1可在一定范围内提高创面肉芽组织的收缩性,但其程度不及表达α-SMA的创面收缩性。作者认为,α-SMA是肌成纤维细胞产生及引发创面收缩、瘢痕挛缩的必要条件。
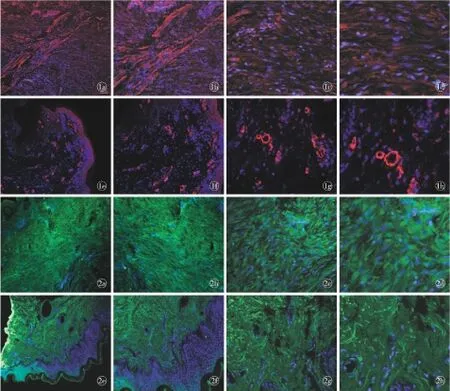
图1 共聚焦显微镜下增生性瘢痕组织与正常组织中α-SMA荧光免疫组化染色的表达情况 a.瘢痕组织(×6) b.瘢痕组织(×10) c.瘢痕组织(×24) d.瘢痕组织(×40) e.正常组织(×6) f.正常组织(×10) g.正常组织(×24) h.正常组织(×40)图2 共聚焦显微镜下增生性瘢痕与正常组织中PAI-1荧光免疫组化染色的表达情况 a.瘢痕组织(×6) b.瘢痕组织(×10) c.瘢痕组织(×24)d.瘢痕组织(×40) e.正常组织(×6) f.正常组织(×10) g.正常组织(×24) h.正常组织(×40)
Fig1 Expression of α-SMA immunofluorescence staining in hypertrophic scar tissue and normal tissue under microscopy. a. hypertrophic scar tissue (×6). b. hypertrophic scar tissue (×10). c. hypertrophic scar tissue (×24). d. hypertrophic scar tissue (×40). e. hypertrophic scar tissue (×6). f. hypertrophic scar tissue (×10). g. hypertrophic scar tissue (×24). h. hypertrophic scar tissue (×40).Fig2 Expression of PAI-1 immunofluorescence staining in hypertrophic scar tissue and normal tissue under microscopy. a. hypertrophic scar tissue (×6).b. hypertrophic scar tissue (×10). c. hypertrophic scar tissue (×24). d. hypertrophic scar tissue (×40). e. hypertrophic scar tissue (×6). f. hypertrophic scar tissue (×10). g. hypertrophic scar tissue (×24). h. hypertrophic scar tissue (×40).
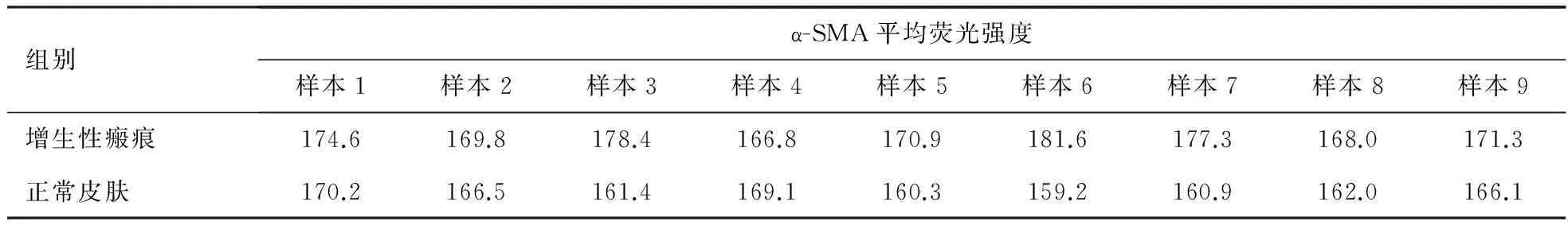
表1 α-SMA在增生性瘢痕与正常皮肤组织中的平均荧光强度
注:P<0.01(P=0.001),在增生性瘢痕中α-SMA的表达量明显高于正常皮肤组织
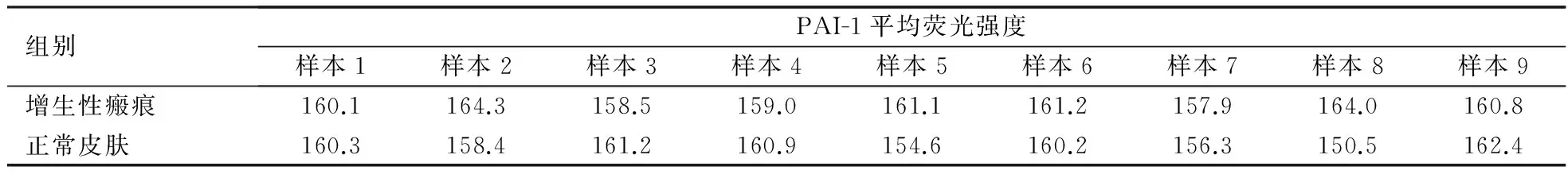
表2 PAI-1在增生性瘢痕与正常皮肤组织中的平均荧光强度
注:P>0.01(P=0.117),PAI-1在增生性瘢痕及正常皮肤组织中表达量无明显差异
我们的研究结果与大多数作者的结果一致,同样证实了α-SMA在增生性瘢痕中的表达比正常组织高。因此,我们在本实验的第2部分采用此方法研究PAI-1在增生性瘢痕中的表达。我们运用荧光免疫组化法、共聚焦显微镜和ImageJ软件分析蛋白的表达量。PAI-1属于丝氨酸蛋白酶抑制剂家族,是尿激酶型纤溶酶原激活物及组织型纤溶酶原激活物的主要生理抑制剂,由血管内皮细胞、血管平滑肌细胞、肝细胞等合成分泌[10]。
PAI-1与瘢痕疙瘩的形成有密切关联[11]。Tuan实验室发表了比较普通瘢痕与瘢痕疙瘩之间PAI-1及uPA的表达情况,结果显示,瘢痕疙瘩成纤维细胞PAI-1的表达量比普通瘢痕高,同时胶原蛋白的沉积也增多。 Tuan等[12]认为,PAI-1的过表达是瘢痕疙瘩的特征,并且认为,PAI-1可能是胶原蛋白产生与沉积的重要始动因素。PAI-1与瘢痕疙瘩的相关性是较为明确的。PAI-1与增生性瘢痕的相关文献很少。孙波[13]认为,PAI-1在增生性瘢痕中的表达上调,PAI-1 mRNA在增生性瘢痕中的相对表达量约为正常皮肤组织的2.7倍。
实验采用共聚焦图像来分析PAI-1在正常皮肤组织与增生性瘢痕中表达,结果显示,PAI-1在正常皮肤组织与增生性瘢痕中的表达量无明显差异,与文献结果不同。我们对孙波的研究结果分析认为尚存在一些问题:①文章中样本量(6例)较少;②实验中实时荧光定量PCR的内参基因选择β-actin基因是不可靠的;③研究结果的相对定量采用2-△△Ct法进行比较,计算结果是估计值,并不准确。
我们发现,PAI-1是TGF-β的下游信号分子。Bock等[14]的研究结果表明,TGF-β3在增生性瘢痕和正常皮肤组织中的表达量无差异。因此,我们认为,PAI-1在增生性瘢痕与正常皮肤组织中含量无差异,可能是由于TGF-β3在增生性瘢痕和正常皮肤组织中的表达量无差异所致。
[1] Sidgwick GP, Bayat A. Extracellular matrix molecules implicated in hypertrophic and keloid scarring[J]. J Eur Acad Dermatol Venereol, 2012,26(2):141-152.
[2] Ogawa R. Mechanobiology of scarring[J]. Wound Repair Regen, 2011,19 Suppl 1:s2-s9.
[3] Ray S, Ju X, Sun H, et al. The IL-6 trans-Signaling-STAT3 pathway mediates ECM and cellular proliferation in fibroblasts from hypertrophic scar[J]. J Invest Dermatol, 2013,133(5):1212-1220.
[4] Shin TM, Bordeaux JS. The role of massage in scar management: a literature review[J]. Dermatol Surg, 2012,38(3):414-423.
[5] Tomasek JJ, Gabbiani G, Hinz B, et al. Myofibroblasts and mechano-regulation of connective tissue remodelling[J]. Nat Rev Mol Cell Biol, 2002,3(5):349-363.
[6] Eyden B, Curry A, Wang G. Stromal cells in the human gut show ultrastructural features of fibroblasts and smooth muscle cells but not myofibroblasts[J]. J Cell Mol Med, 2011,15(7):1483-1491.
[7] Sarrazy V, Billet F, Micallef L, et al. Mechanisms of pathological scarring: role of myofibroblasts and current developments[J]. Wound Repair Regen, 2011,19 Suppl 1:s10-s15.
[8] Wang XQ, Kravchuk O, Winterford C, et al. The correlation of in vivo burn scar contraction with the level of alpha-smooth muscle actin expression[J]. Burns, 2011,37(8):1367-1377.
[9] 陈 蕾, 祁少海, Levinson H. α-平滑肌肌动蛋白在细胞、创面收缩中作用的初探[C]. 中华医学会烧伤外科学分会, 2012.
[10] Ferroni P, Roselli M, Portarena I, et al. Plasma plasminogen activator Inhibitor-1 (PAI-1) levels in breast cancer-relationship with clinical outcome[J]. Anticancer Res, 2014,34(3):1153-1161.
[11] Ghosh AK, Vaughan DE. PAI-1 in tissue fibrosis[J]. Journal of cellular physiology, 2012,227(2):493-507.
[12] Tuan TL, Wu H, Huang EY, et al. Increased plasminogen activator inhibitor-1 in keloid fibroblasts may account for their elevated collagen accumulation in fibrin gel cultures[J]. Am J Pathol, 2003,162(5):1579-1589.
[13] 孙 波. 纤溶酶原激活物抑制剂-1在增生性瘢痕和正常皮肤中差异性表达的研究[D]. 遵义医学院, 2011.
[14] Bock O, Yu H, Zitron S, et al. Studies of transforming growth factors beta 1-3 and their receptors I and II in fibroblast of keloids and hypertrophic scars[J]. Acta Derm Venereol, 2005,85(3):216-220.
Expressionandsignificanceofα-smoothmuscleactinandplaminogenactivatorinhibitor-1inthehypertrophicscar
ZHOULu,FANJu-feng.
(DepartmentofPlasticSurgery,BeijingChaoyangHospital,Beijing100020,China)
ObjectiveExpression and significance of α-smooth muscle actin and plaminogen activator inhibitor-1 in hypertrophic scar. To illustrate the expression and significance of α-smooth muscle actin and plaminogen activator inhibitor-1 in hypertrophic scar, we detect and analyze the expression quantity of α- and plaminogen activator inhibitor-1 in the hypertrophic scar and normal skin.MethodsWe use immunohistochmeistry to sign the expression of α-smooth muscle actin and plaminogen activator inhibitor-1 in 9 cases of hypertrophic scar and 9 cases of normal skin, then we can take photos with laser scanning confocal microscope and process images with ImageJ software. We can get the mean density of α-smooth muscle actin and plaminogen activator inhibitor-1 in hypertrophic scar and normal skin, after that we can analyze the relationship between α-smooth muscle actin/plaminogen activator Inhibitor-1 and hypertrophic scar.Results①In hypertrophic scar and normal skin, α-smooth muscle actin and plaminogen activator inhibitor-1 could express in both of them but there are some differences in expression quantity and distribution. ②Through analysis the mean density of α-smooth muscle actin and plaminogen activator inhibitor-1, we could find that the expression of α-smooth muscle actin is higher in hypertrophic scar and the difference between the two groups have remarkable statistical significance (P<0.01); the expression of plaminogen activator inhibitor-1 has no statistically significant difference between hypertrophic scar and normal skin (P>0.01).ConclusionBoth of α-smooth muscle actin and plaminogen activator inhibitor-1 are expressed in hypertrophic scar and normal skin. The expression of α-smooth muscle actin is higher in hypertrophic scar and shows important role in hypertrophic scar. The expression of plaminogen activator inhibitor-1 shows no statistically significant difference between hypertrophic scar and normal skin.
Hypertrophic scar; α-smooth muscle actin; Plaminogen activator inhibitor-1; Immunohistochmeistry
100020 北京,首都医科大学附属北京朝阳医院 整形外科
周 璐(1988-),女,山西人,硕士研究生.
范巨峰,100020,首都医科大学附属北京朝阳医院 整形外科,电子信箱: bestfan@126.com
10.3969/j.issn.1673-7040.2014.11.019
R619.6
A
1673-7040(2014)11-0692-04
2014-09-25)
