HER-2在恶性黑色素瘤中的蛋白表达、基因扩增及其临床意义
2014-11-01李福生肖明明徐绍年杜振广景士兵
李福生, 肖明明, 徐绍年, 杜振广, 王 亮, 黄 海, 景士兵
实验研究
HER-2在恶性黑色素瘤中的蛋白表达、基因扩增及其临床意义
李福生, 肖明明, 徐绍年, 杜振广, 王 亮, 黄 海, 景士兵
目的检测恶性黑色素瘤中HER2的蛋白表达、基因扩增情况,并探讨其临床意义。方法以石蜡包埋组织芯片为材料,分别采用免疫组织化学PV9000二步法与荧光原位杂交技术检测HER2蛋白在恶性黑色素瘤、色素痣中的表达及基因扩增。结果HER2蛋白在恶性黑色素瘤、色素痣中的表达阳性率分别为76.9%、25.0%,扩增阳性率分别为75.0%、30.0%;两者比较,差异具有统计学意义(χ2=12.480,P=0);在恶性黑色素瘤中HER2蛋白表达、基因扩增阳性率与浸润深度及淋巴结转移有关(P<0.05)。结论HER2与恶性黑色素瘤的发生、发展有关,可以将其作为判断恶性黑色素瘤生物学行为的重要参考指标。
恶性黑色素瘤; HER2; 免疫组织化学; 荧光
恶性黑色素瘤(malignant melanoma, MM)是起源于神经嵴黑色素细胞的高度恶性肿瘤,其侵袭力强、转移性高、发展迅速且预后极差。其发生发展是多种因素、多个步骤及阶段共同作用的过程[1]。自2013年11月至2014年7月,我们采用组织芯片免疫组化方法及免疫荧光原位杂交方法检测HER-2在恶性黑色素瘤和色素痣组织中的蛋白表达及基因扩增情况。
1 标本来源
收集2008年1月至2014年6月本科室存档的MM蜡块52例,色素痣20例。52例MM样本中,男性24例,女性28例;年龄22~76岁,平均(56.8±11.2)岁。有淋巴结转移者24例,无淋巴结转移者28例;根据肿瘤细胞浸润深度(Clark分级):Ⅰ级(表皮及附属器上皮)14例,Ⅱ、Ⅲ级(真皮乳头层)14例,Ⅳ级(真皮网状层)9例,Ⅴ级(侵及皮下组织)15例。所有患者术前均未接受放、化疗或免疫制剂。
2 实验方法
将蜡块切取1张5 μm切片,经HE染色后,在蜡块上选取相应区域,采用手工组织芯片制备仪(上海博南生物技术有限公司)制备直径为2 mm的组织芯片,从芯片蜡块上切取3张5 μm切片,分别进行HE染色、荧光原位杂交及免疫组织化学PV 9000二步法分析。
2.1 组织芯片蜡块制备 将受体蜡块放在37 ℃恒温台上,软化5 min;固定蜡块,利用2 mm点样针在受体蜡块上打孔,针点间隔1 mm。受体蜡块按9×5阵列打孔;打孔完成后,放于取样平台,将供体蜡块也放在取样平台上,使用点样针在预先做好取样标记的供体蜡块上取样,将点样针取出的样本填入受体蜡块的蜡孔中,组织芯片蜡块面朝下放在一玻片上轻拍,使组织芯片蜡块表面整齐;将组织芯片蜡块放在65 ℃烤箱中30 min,使其完全熔合;将自然冷却的组织芯片蜡块放在冷冻台上5 min,制备完毕(图1)。
2.2 免疫组织化学PV9000二步法 组织芯片蜡块切片脱蜡至水;蒸馏水冲洗, PBS浸泡5 min;3%H2O2室温孵育10 min,以消除内源性过氧化物酶的活性,PBS液冲洗2 min,3次;滴加稀释的HER2抗体(1∶100),37 ℃孵育2 h;PBS液冲洗2 min,3次;滴加二氨基联苯胺底物浓缩液,37 ℃孵育20 min,PBS液冲洗2 min,3次;滴加二氨基联苯胺底物缓冲液,37 ℃孵育20 min,PBS冲洗3次,每次2 min;显色剂显色;自来水充分冲洗,复染,脱水透明,封片。用PBS代替HER-2抗体作为阴性对照,阳性对照为已知的HER-2阳性乳腺癌组织切片。
2.3 荧光原位杂交法 组织切片在65 ℃下烘烤3 min。将组织切片浸于二甲苯中室温脱蜡2次,每次10 min,随后浸入100%乙醇中5 min;室温下,将组织切片依次置于100%乙醇、85%乙醇和70%乙醇中各2 min复水。组织切片室温浸入去离子水中3 min,用无绒纸巾吸取多余的水分,100 ℃沸水煮玻片20 min,再置于浓度100 μg/ml蛋白酶K中消化;将组织切片置于核酸杂交漂洗液中漂洗2次,每次5 min。1%甲醛室温固定10 min。玻片依次置于-20 ℃预冷的70%乙醇、85%乙醇和100%乙醇中各2 min脱水;将组织切片室温浸入丙酮溶液中2 min。自然干燥玻片。加热玻片至56℃,将10 μl探针混合物滴加于玻片杂交区域,立即加盖盖玻片,用橡皮胶封片,准备杂交仪器,共变性条件:83 ℃ 5 min,42 ℃ 16 h,玻片洗涤:0.3%乙基苯基聚乙二醇 65 ℃冲洗1.5 min, 0.1%乙基苯基聚乙二醇室温冲洗30 s,70%乙醇冲洗3 min。暗处自然干燥玻片;室温中将15 μl 4,6-二氨基-2-苯基吲哚复染剂滴加于玻片杂交区域,立即盖上盖玻片。暗处放置10~20 min,在Olympus BX51型荧光显微镜下选用合适的滤片组观察玻片,以>75%的细胞核内≥2个HER 2信号判断杂交成功。
2.4 结果判定标准 本实验研究染色结果判断标准参照阳性细胞半定量分级法。随机观察5个高倍镜下视野,每个视野计数100个细胞。①根据着色的强弱分级,不着色的视野为0分,与背景色一致的视野为1分,呈浅黄色的视野为2分,呈深黄色的视野为3分,呈棕黄色的视野为4分;②根据阳性细胞面积分级,呈阴性的视野为0分,阳性细胞面积/细胞总面积<25%的视野为1分,26%~50%的视野为2分,51%~75%的视野为3分,>75%的视野为4分。两者定性乘积分表达0、1分为阴性,≥2分为阳性表达。
荧光原位杂交结果判定标准:计数30个细胞,统计Ratio值(Ratio值=30个细胞核中红信号总数/30个细胞核中绿信号总数)。Ratio<1.8为阴性结果,提示该样本无HER-2基因扩增;Ratio>2.2为阳性结果,提示样本中HER-2基因发生扩增;Ratio在1.8~2.2,可增加计数细胞至100个,或重做荧光原位杂交实验来判断最终结果。
2.5 统计学处理 采用SPSS 17.0软件进行数据处理,采用χ2检验比较HER-2蛋白表达及基因扩增的阳性表达率及与MM浸润深度及淋巴结转移的关系,P<0.05差异有统计学意义。
3 结果
3.1 HER-2在色素痣及MM中蛋白表达及基因扩增情况 免疫组织化学结果显示,HER-2蛋白表达于细胞膜及细胞浆中。HER-2蛋白表达的阳性率在MM组和黑素痣组中分别为76.9%和25.0%,两组比较,差异具有统计学意义(χ2=16.615,P=0);HER-2基因扩增的阳性率在MM组和黑素痣组中分别为75.0%和30.0%,两组比较,差异具有统计学意义(χ2=12.480,P=0,图2,3)。
3.2 HER-2蛋白表达及基因扩增与MM临床病理学特征的关系 在MM中,随着肿瘤细胞浸润深度的增加,HER-2蛋白表达的阳性率增强,差异具有统计学意义(χ2=12.532,P=0.006,表1);基因扩增的阳性率也增强,差异具有统计学意义(χ2=14.547,P=0.002)。HER-2蛋白表达的阳性率在伴有淋巴结和无淋巴结中分别为95.8%和60.7%,两组比较,差异具有统计学意义(χ2=8.979,P=0.003);HER-2基因扩增的阳性率在伴有淋巴结和无淋巴结中分别为95.8%和57.1%,两组比较,差异有统计学意义(χ2=10.317,P=0.001)。
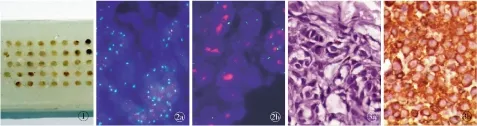
图1 组织芯片蜡块图2 荧光原位杂交法检测HER-2基因扩增情况 a.色素痣HER-2基因无扩增 b.MM中HER-2基因扩增图3 组织芯片免疫组织化学PV9000二步法检测HER-2蛋白表达情况 a.色素痣HER-2蛋白阴性表达(×400) b.MM中HER-2蛋白阳性表达(×400)
Fig1 Paraffin embedded tissue microarray.Fig2 FISH method for detection of the amplification of HER-2 gene. a. pigmented nevus without HER-2 gene amplification. b. amplification of HER-2 gene in malignant melonoma.Fig3 Tissue chip immunohistochemistry PV9000 two steps method to detect the expression of HER-2 protein. a. the negative of HER-2 protein in pigmented nevus (×400). b. the positive expression of HER-2 protein in malignant melonoma (× 400).
表1 MM中HER-2与临床病理学特征的关系
Tab1 The relationship between MM in the expression of HER-2 and clinicopathological characteristics
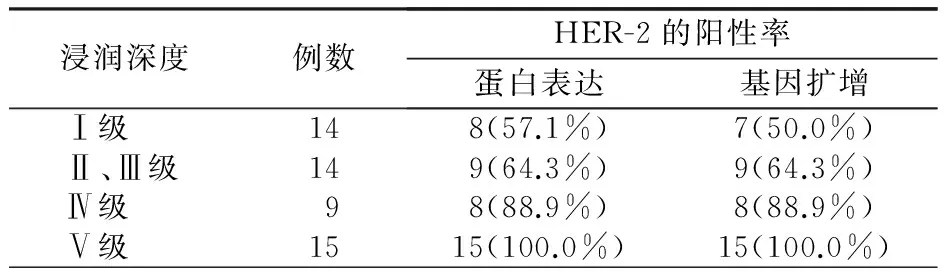
浸润深度例数HER-2的阳性率蛋白表达基因扩增 Ⅰ级148(57.1%)7(50.0%) Ⅱ、Ⅲ级149(64.3%)9(64.3%) Ⅳ级98(88.9%)8(88.9%) Ⅴ级1515(100.0%)15(100.0%)
4 讨论
近年来,分子生物学研究结果表明,肿瘤是一种基因异常变化的疾病。癌基因的激活和抑癌基因的失活在许多肿瘤中起着一定的作用。Her-2基因是癌基因,定位于人染色体17q21,具有酪氨酸激酶活性的细胞膜糖蛋白,属于酪氨酸激酶Ⅰ型受体家族。HER-2基因参与细胞的分裂、生长、繁殖的调控,与细胞运动、生长、生存能力的增强及癌细胞转移有关[2]。正常情况下,HER-2基因处于非激活状态,当受到某些致癌因素的作用后, 其结构或表达失控而被激活,转而具有肿瘤转化活性,促使细胞发生恶性转化[3-4]。HER-2的高表达已在多种肿瘤中发现, 如乳腺癌、胃癌、结直肠癌、膀胱癌、前列腺癌、骨肉瘤[3-9]。研究表明,30%以上的人类肿瘤组织中,伴有HER-2基因的过度表达,并与肿瘤分化程度、临床分期呈正相关, 且表达越高, 预后越差。HER-2基因结构的改变,如过度扩增表达促使细胞有丝分裂,在疾病启动阶段后期,这种机制使某些不正常细胞获得不受机体控制而独立生长的能力。HER-2的扩增与过量表达也是肿瘤恶变的重要分子事件。本组检测结果显示,MM中HER-2蛋白表达与基因扩增明显高于色素痣。提示恶性黑色素瘤的发生与HER-2异常表达有关。由此推测,HER-2基因过度表达与MM的发生发展密切相关,其在恶性黑色素瘤的侵袭转移过程中可能起促进作用。
[1] Kimbrough CW, McMasters KM, Davis EG. Principles of surgical treatment of malignant melanoma[J]. Surg Clin North Am, 2014,94(5):973-988.
[2] Iqbal N, Iqbal N. Human epidermal growth factor receptor 2 (HER2) in cancers: overexpression and therapeutic implications[J]. Mol Biol Int, 2014,2014:852748.
[3] Tolaney S. New HER2-positive targeting agents in clinical practice[J]. Curr Oncol Rep, 2014,16(1):359.
[4] Arteaga CL, Engelman JA.ERBB receptors: from oncogene discovery to basic science to mechanism-based cancer therapeutics[J]. Cancer Cell, 2014,25(3):282-303.
[5] Krishnamurti U, Silverman JF. HER2 in breast cancer: a review and update[J]. Adv Anat Pathol, 2014,21(2):100-107.
[6] Gomez-Martín C, Lopez-Rios F, Aparicio J, et al. A critical review of HER2-positive gastric cancer evaluation and treatment: from trastuzumab, and beyond[J]. Cancer Lett, 2014,351(1):30-40.
[7] Khelwatty SA, Essapen S, Seddon AM, et al. Prognostic significance and targeting of HER family in colorectal cancer[J]. Front Biosci (Landmark Ed), 2013,18:394-421.
[8] Siampanopoulou M, Galaktidou G, Dimasis N, et al. Profiling serum HER-2/NEU in prostate cancer[J]. Hippokratia, 2013,17(2):108-112.
[9] Gill J, Geller D, Gorlick R. HER-2 involvement in osteosarcoma[J]. Adv Exp Med Biol, 2014,804:161-177.
TheexpressionofHER-2protein,geneamplificationanditsclinicalsignificanceinmalignantmelanoma
LIFu-sheng,XIAOMing-ming,XUShao-nian,etal.
(DepartmentofBoneTumour,ThePeople′sHospitalofLiaoningProvince,Shenyang110016,China)
ObjectiveTo investigate the expression of HER-2 protein and gene amplification in malignant melanoma and evaluation of HER-2 in malignant melanoma occurrence, development and prognosis.MethodsUsing PV-9000 two steps method and in situ chemical hybridization to detect the expression of HER-2 protein, gene amplification in paraffin-embedded tissue chip material.ResultsThe positive rate of HER-2 expression in malignant melanoma, pigmented nevus were 76.9%, 25.0%; The positive rate of HER-2 gene amplification were 75.0%, 30.0%. There were significant differences between malignant melanoma and pigmented nevus in the expression and amplification of HER-2 (χ2=12.480,P=0); The expression and amplification of HER-2 in malignant melanoma had correlation with the depth of invasion and the lymph node metastasis (P<0.05).ConclusionHER-2 is closely related to the occurrence and development of malignant melanoma, and can be considered as an important index for determing the biological behavior of malignant melanoma.
Malignant melanoma; HER-2; Immunohistochemistry; Fluorescence
110016 辽宁 沈阳,辽宁省人民医院 骨肿瘤科(李福生,徐绍年,杜振广,王 亮,黄 海);辽宁省人民医院 病理科(肖明明,景士兵)
李福生(1980-),男,辽宁辽中人,主治医师,硕士研究生.
景士兵,110016,辽宁省人民医院 病理科,电子信箱:mypathology@163.com
10.3969/j.issn.1673-7040.2014.11.021
R739.5
A
1673-7040(2014)11-0700-03
2014-10-13)
