5-氨基酮戊酸介导的光动力疗法预防兔耳瘢痕增生的初步探讨
2014-11-01黄惠真
胡 丽, 李 昕, 黄惠真, 李 伟
实验研究
5-氨基酮戊酸介导的光动力疗法预防兔耳瘢痕增生的初步探讨
胡 丽, 李 昕, 黄惠真, 李 伟
目的探讨5-氨基酮戊酸介导的光动力疗法抑制兔耳瘢痕增生的效果。方法建立兔耳增生性瘢痕模型后,将108个增生性瘢痕块随机分为4组:空白对照组、单纯激光组、单纯5-氨基酮戊酸组及5-氨基酮戊酸介导的光动力治疗组。5-氨基酮戊酸介导的光动力治疗组在局部注射5-氨基酮戊酸后5 h行半导体激光照射,波长635 nm,功率密度100 mW/cm2,照射20 min。治疗后观察3周瘢痕的生长情况,测量瘢痕厚度及红斑指数,取材后行HE染色,观察真皮层厚度的变化,计算各组瘢痕增生指数,Masson染色观察胶原纤维排列情况,TUNEL染色观察成纤维细胞凋亡情况。结果5-氨基酮戊酸介导的光动力治疗组瘢痕厚度与红斑指数较其他3组均降低(P<0.05);真皮层厚度明显变薄,瘢痕增生指数较其他3组明显降低(P<0.05);Masson染色显示,5-氨基酮戊酸介导的光动力治疗组真皮层内胶原纤维较其他3组减少,且排列整齐有序;TUNEL染色显示,5-氨基酮戊酸介导的光动力治疗组成纤维细胞凋亡数量较其他3组明显增多(P<0.05)。结论应用5-氨基酮戊酸介导的光动力疗法可以预防兔耳瘢痕增生。
5-氨基酮戊酸; 光动力疗法; 增生性瘢痕
增生性瘢痕是创伤后组织过度修复的产物,发病机制尚不清楚。传统治疗方法包括局部注射激素、口服药物、放射治疗以及手术等[1-5],其疗效并不确切,可能伴有严重的不良反应,因此,对于增生性瘢痕,预防胜于治疗。光动力疗法(photodynamic therapy, PDT)已经成功用于治疗浅表的恶性肿瘤[6]以及葡萄酒色斑等非肿瘤疾病[7],其作用机制包括抑制局部血供和直接杀伤肿瘤细胞。鉴于增生性瘢痕与肿瘤存在相似的局部细胞增生和血供丰富的特性,自2012年1月至2013年12月,笔者采用5-氨基酮戊酸(aminolaevulinic acid, ALA)介导的光动力疗法作用于兔耳增生性瘢痕模型,初步探讨PDT预防增生性瘢痕的可能性。
1 材料与方法
1.1 实验动物与仪器
新西兰白兔12只均由本院动物实验中心提供。体质量2.5~3.0 kg,6个月龄,雌雄各半,分笼饲养。光敏剂5-氨基酮戊酸(日本COSMOS BIO公司),4 ℃避光保存;激光功率计(LP-3C型,中国北京物科光电技术有限公司);635 nm半导体激光仪(HPD5230-HHLF-FAC型,美国HPD公司);皮肤光度计(CR-400,日本美能达公司);石蜡切片机(THERMO公司);倒置显微镜(TS-100,日本NIKON公司)。
1.2 实验方法
1.2.1 建立兔耳增生性瘢痕模型 肌肉注射麻醉后备皮,在每只兔耳腹侧面于中线两侧远、中、近部位,远端创伤距兔耳尖端为2.0 cm,创伤间距1.0 cm,创伤距离兔耳内外侧缘1.5 cm,分别进行直径1.0 cm的圆形全层皮肤缺损6处,共144个,术中刮除软骨膜,术后创面予以暴露,连续动态观察创面的愈合情况。
1.2.2 实验过程 术后3周左右创面上皮化完成,表面痂皮脱落,出现瘢痕增生,质地较硬、充血,瘢痕中央部呈乳头状凸起,144个创面共形成108个增生瘢痕块,少部分创面瘢痕增生不明显。将创面分成4组:空白对照组、单纯激光组、单纯ALA组与ALA-PDT组。空白对照组不予任何处理;单纯激光组只照光,不给予ALA,激光输出功率为0.315 W,光斑直径2.0 cm,功率密度100 mW/cm2,能量密度120 J/cm2,照射20 min;单纯ALA组每个瘢痕块局部注射10 mg/ml ALA 0.2 ml,给药后不照光;ALA-PDT组每个瘢痕块局部注射10 mg/ml ALA 0.2 ml,给药后避光5 h,再行激光照射,能量同上,不照光处给予遮盖,治疗后避光24 h。
1.2.3 观察指标 治疗后1、2、3、7、14、21 d观察瘢痕变化情况并拍照,游标卡尺记录各组瘢痕的高度,皮肤光度计测量瘢痕的红斑指数。
1.2.4 标本取材和处理 治疗3周后取材,切取兔耳全层组织,周边带少许正常组织。4%甲醛固定24 h后,梯度乙醇脱水,石蜡包埋,沿瘢痕凸起最高点纵行切片,行HE和Masson染色。HE染色后,光镜下观察治疗后各组瘢痕组织的形态学变化,包括真皮层厚度以及成纤维细胞增生情况,使用ipp 6.0软件测量瘢痕最高点与周围正常组织的距离,计算瘢痕评估指数(scar evaluation index, SEI)。Masson染色观察胶原纤维排列。

1.3 统计学方法
所有数据输入Excel数据库,采用SAS 8.0统计软件进行统计学分析,P<0.05为差异具有统计学意义。
2 结果
2.1 大体观察
空白对照组增生块明显高于周围正常皮肤,中央乳头状突起,颜色暗红色,质地较硬;单纯激光组增生块突出皮面明显,颜色粉红色,质地较硬;单纯ALA组瘢痕稍高出皮面,颜色呈粉红,质地较硬;ALA-PDT组瘢痕组织无明显突出,色泽淡粉,质地接近正常(图1)。ALA-PDT组与其他3组相比,在治疗后1周红斑指数开始下降,各组间差异具有统计学意义(P<0.05),治疗后3周时瘢痕厚度和红斑指数均有明显下降,各组间差异具有统计学意义(P<0.05)。
2.2 组织学观察
2.2.1 HE染色 治疗后3周取材染色镜下观察发现,空白对照组、单纯激光组与单纯ALA组瘢痕组织的真皮层明显增厚,主要由大量增生的成纤维细胞及排列紊乱的胶原纤维组成;而ALA-PDT组瘢痕组织的真皮层较其他3组明显变薄,成纤维细胞和胶原纤维数量相对减少(图2)。
2.2.2 SEI计算 空表对照组的SEI值为1.927;单纯激光组SEI值为1.875;单纯ALA组SEI值为1.837;ALA-PDT组SEI值为1.313,与其他3组相比,差异具有统计学意义(P<0.05,图3)。
2.2.3 Masson胶原纤维染色 空白对照组、单纯激光组与单纯ALA组真皮层内可见大量排列紧密、紊乱粗大的绿染胶原纤维,浅层呈漩涡状排列;ALA-PDT组真皮层内绿染胶原纤维数量相对较少,排列规整(图4)。
2.2.4 TUNEL染色 凋亡的细胞染色表现为细胞核固缩,胞浆棕褐色深染。空白对照组、单纯ALA组及单纯激光组仍可见数量较多的成纤维细胞增殖,其间可见少量正常凋亡的成纤维细胞;ALA-PDT组镜下发现成纤维细胞数量已经明显减少,而其间凋亡的成纤维细胞明显增多(图5)。
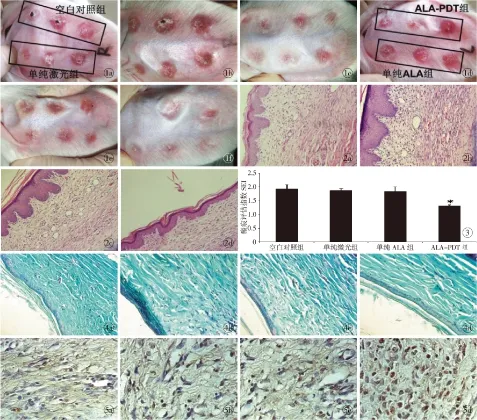
图1 实验前后大体观察 a.空白对照组和单纯激光组实验前 b.空白对照组和单纯激光组实验后1周 c.空白对照组和单纯激光组实验后3周 d.ALA-PDT组和单纯ALA组实验前 e.ALA-PDT组和单纯ALA组实验后1周 f.ALA-PDT组和单纯ALA组实验后3周图2 实验后3周各组真皮层厚度(HE ×200) a.空白对照组 b.单纯激光组 c.单纯ALA组 d.ALA-PDT组图3 治疗后3周各组间SEI比较图4 治疗后3周各组瘢痕Masson胶原染色(×200) a.空白对照组 b.单纯激光组 c.单纯ALA组 d.ALA-PDT组图5 治疗3周后各组瘢痕TUNEL染色(×200) a.空白对照组 b.单纯激光组 c.单纯ALA组 d.ALA-PDT组
Fig1 General observation before and after experiment. a. control group and laser irradiation group before experiment.b. control group and laser irradiation group after experiment at 1 week. c. control group and laser irradiation group after experiment at 3 weeks. d. ALA-PDT group and injection of ALA group before experiment. e. ALA-PDT group and injection of ALA group after experiment at 1 week. f. ALA-PDT group and injection of ALA group after experiment 3 weeks.Fig2 Dermal layer thickness of different groups after experiment at 3 weeks (HE×200). a. control group. b. laser irradiation group. c. injection ALA group. d. ALA-PDT group.Fig3 Comparison of SEI after experiment at 3 weeks.Fig4 Masson collagen staining after experiment at 3 weeks (×200). a. control group. b. laser irradiation group. c. injection ALA group. d. ALA-PDT group.Fig5 TUNEL staining after experiment at 3 weeks (×200). a. control group. b. laser irradiation group. c. injection ALA group. d. ALA-PDT group.
3 讨论
增生性瘢痕的本质在于成纤维细胞的过度增殖和以胶原为主的细胞外基质过度沉积,因此,成纤维细胞成为预防增生性瘢痕的关键因素之一。早期对增生性瘢痕的形态学研究结果已显示,增生性瘢痕组织具有较普通瘢痕和正常真皮多的微血管结构[8]。这种成纤维细胞过度增殖与局部血供丰富的病理生物学特性与肿瘤组织非常相似。1997年,DE Morris等发现,在兔耳创面上可以产生与人类病理瘢痕类似的真皮过度增生现象;1998年,李荟元等经过大量兔耳创面的实验观察,从多个角度研究了兔耳创面增生组织的特性,证实兔耳可以产生与人类增生性瘢痕相似的病理改变,并认定可以作为瘢痕研究的动物模型。
光动力疗法通过联合应用光敏剂及相应光源引起的光化学反应选择性作用于病变组织,该反应的机制在于光敏剂选择性地积聚在异常增殖或增生活跃的组织细胞内,通过吸收相应波长的激光能量发生光化学反应,随之产生大量活性氧自由基,尤其是单态氧,这些细胞毒性物质将诱导靶细胞坏死或凋亡[9];此外,PDT还可通过血管损伤机制间接清除靶组织而产生治疗作用[10]。ALA作为第2代光敏剂之一,是细胞合成血红素的前体,本身不具有光毒性作用,在体内代谢快,其在细胞内经一系列酶的作用下合成具有强光敏作用的原卟啉,然后继续被代谢形成血红素。ALA特征的吸收峰位于红光区,作用波长较长,穿透较深,已广泛应用于多种皮肤浅表肿瘤等疾病[11-13]。
前期研究中,鸡冠葡萄酒色斑模型已经证实ALA- PDT可以造成局部血栓形成,阻断治疗部位组织的血液供应[14]。在另一项研究中,人增生期瘢痕的成纤维细胞与ALA共培养后给予635 nm激光照射,结果发现在低强度的光照条件下,更多的成纤维细胞发生凋亡,而高强度的光照条件下则导致细胞坏死[15]。以往研究也表明,采用PDT治疗兔耳增生性瘢痕,瘢痕组织厚度变薄,TGF-β1表达降低,成纤维细胞凋亡增加[16-18]。
本研究初步观察了ALA-PDT对兔耳瘢痕增生的抑制作用,根据观察结果与光动力疗法作用机制,我们认为其抑制作用与瘢痕内成纤维细胞凋亡密切相关,此外,微血管数量有无减少仍在进一步地研究中。
[1] Toshihiko H, Hiroshi F, Yuhei Y. A new uniform protocol of combined corticosteroid injections and ointment application reduces recurrence rates after surgical keloid/hypertrophic scar excision[J]. Dermatol Surg, 2012,38(6):893-897.
[2] Heloise G. Intradermal tacrolimus prevent scar hypertrophy in a rabbit ear model: a clinical, histological andspectroscopical analysis [J]. Skin Re Technol, 2011,17(2):160-166.
[3] Ko JH, Kim PS, Zhao Y, et al. HMG-CoA reductase inhibitors (statins) reduce hypertrophic scar formation in a rabbit ear wounding model[J]. Plast Reconstr Surg, 2012,129(2):252-261.
[4] Mousavi SR, Raaiszadeh M, Aminseresht M, et al. Evaluating tamoxifen effect in the prevention of hypertrophic scars following surgical incisions[J]. Dermatol Surg, 2010,36(5):665-669.
[5] Bischof M, Krempien R, Debus J, et al. Postoperative electron beam radiotherapy for keloids: objective findings and patient inself-assessment[J]. Int J Dermatol, 2007,46(9):971-975.
[6] O′Connor AE, Gallagher WM, Byrne AT. Porphyrin and nonporphyrinphotosensitizers in oncology: preclinical and clinicaladvances in photodynamictherapy[J]. Photochem Photobiol, 2009,85(5):1053-1074.
[7] Riddle CC, Terrell SN, MenserMB, et al. Areview of photodynamic therapy (PDT) for the treatment of acne vulgaris[J]. J Drugs Dermatol, 2009,8(11):1010-1019.
[8] Kischer CW, Thies AC, Choaphil M . Perivascular myofibroblasts and microvascular occlusion in hypertrophic scars and keloids[J]. Hum Pathol , 1982, 13(9):819- 824.
[9] Babilas P, Landthaler M, Szeimies RM. Photodynamic therapy in dermatology[J]. Eur J Dermatol, 2006,16(4):340-348.
[10] Kalka K, Merk H, Mukhtar H, et al. Photodynamic therapy in dermatology[J]. J Am Acad Dermatol, 2000,42(3):389-413.
[11] Salim A, Leman JA, McColl JH, et al. Randomized comparison ofphotodynamic therapy with topical 5-aminolaevulinic acidin Bowen′s disease[J]. Br J Dermatol, 2003,148(3):539-543.
[12] Wang HW, Lv T, Zhang LL, et al. A prospective pilot study to evaluate combined topical photodynamic therapy and surgery for extramammarypaget′sdisease[J]. Lasers Surg Med, 2013,45(5):296-301.
[13] Roozeboom MH, Aardoom MA, Nelemans PJ, et al. Fractionated 5-aminolevulinic acid photodynamic therapy after partial debulking versus surgical excision for nodular basal cell carcinoma: a randomized controlled trial with at least 5-year follow-up[J].J Am Acad Dermatol, 2013,69(2):280-287.
[14] Li W, Yamada I, Hashimoto K, et al. Photodynamic therapy with intradermal administration of 5-aminolevulinic acid for port-wine stains[J]. J Dermatolog Treat, 2010,21(4):232-239.
[15] Li X, Zhou ZP, Hu L, et al. Apoptotic cell death induced by 5-aminolaevulinic acid-mediated photodynamic therapy of hypertrophic scar-derived fibroblasts[J]. J Dermatolog Treat, 2014,25(5):428-433.
[16] 蔡 宏, 顾 瑛, 曾 晶, 等. 光动力学疗法对兔耳增生性瘢痕作用的初步研究[J]. 中华整形外科杂志, 2007,23(5):425-427.
[17] 肖 燕, 林 军, 欧阳天祥, 等. 光动力学疗法对兔耳增生性瘢痕的影响[J]. 中国美容医学, 2010,19(8):1161-1163.
[18] 曾维惠, 王倩倩, 覃静净, 等. ALA-PDT对兔耳增生性瘢痕抑制效应及作用机制的初步研究[J].中国美容医学, 2011,20(1):83-86.
Preventionofhypertrophicscarsby5-aminolaevulinicacid-mediatedphotodynamictherapyinarabbitearmodel
HULi,LIXin,HUANGHui-zhen,etal.
(DepartmentofPlasticSurgery,ShanghaiNinthPeople′sHospitalAffiliatedShanghaiJiaoTongUniversitySchoolofMedicine,Shanghai200011,China)
ObjectiveTo investigate the effects of 5-aminolaevulinic acid-mediated photodynamic therapy (ALA-PDT) on hypertrophic scars in a rabbit ear model.MethodsThe acute model of dermal hypertrophic scar was established in the rabbit ears. Totally 108 scar wounds were randomly divided into 4 groups: the blank control group, the laser treatment group, the ALA injection group and the ALA-PDT group. In the ALA-PDT group, 5 h after intra-dermal injection of ALA, the scars were irradiated at 635 nm wavelength, 100 mW/cm2for 20 min. Three weeks after treatment, the scars thickness and erythema index were measured, and the specimens were harvested for histological analysis by HE and Masson staining.ResultsThe thickness, erythema index and the scar elevation index were significantly decreased while the number of apoptosis of fibroblasts increased in the ALA-PDT group compared to the other groups. Well organized collagen fiber was observed in the ALA-PDT group by Masson staining.ConclusionALA-PDT could prevent the growth of hypertrophic scars in rabbit ears.
5-aminolaevulinic acid; Photodynamic therapy; Hypertrophic scar
国家自然科学基金资助项目(81071565)
200011 上海,上海交通大学医学院附属第九人民医院 整复外科(胡 丽,黄惠真,李 伟);郑州大学第一附属医院 皮肤科(李 昕)
胡 丽(1989-),女,安徽桐城人,硕士研究生.
李 伟,200011,上海交通大学医学院附属第九人民医院 整复外科,电子信箱:liweiboshi@163.com
10.3969/j.issn.1673-7040.2014.11.020
R619.6
A
1673-7040(2014)11-0696-04
2014-10-10)
