气相色谱-质谱法测定猪可食性组织中3种β-兴奋剂残留的基质效应
2014-10-22杨建文王宗楠贺利民
卞 愧,林 涛,刘 敏,杨建文,王宗楠,贺利民*
(1.华南农业大学兽医学院兽医药理毒理研究室,广东 广州 510642;2.东莞出入境检验检疫局综合技术中心,广东 东莞 523000)
β-兴奋剂主要用于防治人、兽支气管哮喘及痉挛[1],由于其可提高动物的饲料转化率和瘦肉率,常被非法用作饲料添加剂。但长期使用或滥用β-兴奋剂会造成其在可食性动物组织中残留,人食用后会引起肌肉震颤、心悸和过敏等急性中毒,世界上大多数国家已禁止其作为生长促进剂应用于食品动物生产[2]。建立科学、可靠的β-兴奋剂残留分析检测方法具有重要意义。
基质效应(matrix effects,ME)一般指试样中的非待测组分影响待测物浓度或质量测定的准确度、引起待测物响应值增加或减少的现象[3-5]。随着植物源基质中农药残留测定中基质效应现象研究的深入和措施的有效实施[6-8],动物源基质中兽药残留测定中的基质效应现象已引起国内外研究人员的广泛关注,已有分别从样品提取[9]、液液萃取[10]和固相萃取净化[11]、同位素标记[12,13]及去除基质中的磷脂[14]等方面进行的考察,在减少和补偿基质效应的措施方法上都取得了较大的进展,但这些研究大都是探讨液相色谱-串联质谱多反应监测模式下的基质效应现象,涉及β-兴奋剂残留测定中的基质效应研究相对较少[15-17]。为此,本研究在已有 β-兴奋剂残留分析检测方法基础上[18],探讨气相色谱-质谱法测定猪肝和肌肉组织中克伦特罗、沙丁胺醇及莱克多巴胺等β-兴奋剂残留的基质效应,研究不同状态(新鲜与冻干粉)及不同重量的猪组织试样产生的基质效应差异,为有效消除或补偿β-兴奋剂残留测定中的基质效应提供理论依据。
1 实验部分
1.1 仪器与试剂
GCMS-QP2010(日本岛津公司);IKA高速组织匀浆机(德国 IKA公司);冻干机(德国Christ公司);纯水机(德国Millipore公司)。
莱克多巴胺对照品(含量≥98.5%)、克伦特罗对照品(含量≥98.5%)、沙丁胺醇对照品(含量≥98.5%)均购自德国 Dr.Ehrenstorfer公司;N,O-双三甲基硅基三氟乙酰胺+三甲基氯硅烷(99+1,v/v)(Sylon BFT)衍生剂(美国 Sigma-Aldrich公司);甲苯(色谱纯)(美国Fisher公司);乙腈等其他试剂均为分析纯(广州化学试剂厂)。
β-兴奋剂标准储备液(100 mg/L):分别准确称取克伦特罗、沙丁胺醇及莱克多巴胺对照品10 mg,用甲醇溶解,定容至100 mL,-20℃避光保存。
β-兴奋剂混合标准工作液:取适量各标准储备液,用甲醇稀释配制成3种 β-兴奋剂的混合标准溶液。
1.2 样品处理
1.2.1 猪组织冻干粉的制备
分别准确称取1、2、4、5及10 g猪肉和猪肝组织匀浆于西林瓶中(西林瓶先恒重,称量),于-80℃冰箱冷冻12 h,转到冷冻干燥机上于-80℃真空冷冻24 h,再次称重后待提取。
1.2.2 猪组织鲜样和冻干粉的前处理
西林瓶中的猪组织冻干粉用15 mL乙腈和1 mL 10%(质量分数)的碳酸钠溶液转移至50 mL离心管中,涡旋,超声5 min,振荡20 min,于4℃下以8000 r/min离心10 min。分取1 mL上清液于有塞玻璃试管中,50℃水浴氮气吹干。同时,称取与冻干组织相应重量的各鲜样同步处理。
将吹干的样品试管置于80℃烘箱中干燥5 min,取出分别加入100 μL 甲苯和100 μL BFT 衍生剂,涡旋混合30 s,放入烘箱衍生1 h;取出冷却后用甲苯定容至500 μL,涡旋混合,上机检测。
1.3 色谱-质谱条件
1.3.1 色谱条件
色谱柱:毛细管柱HP-5MS(30 m×0.25 mm×0.25 μm);进样口温度:250℃;炉温程序:初始温度70℃,保持1 min,然后以35℃/min升至220℃,保持1 min,以35℃/min升至280℃,再以10℃/min升至290℃,保持4 min;载气:高纯氦气;柱流速0.8 mL/min,不分流进样。
1.3.2 质谱条件
电子轰击离子(EI)源:源温230℃;电子能量:70 eV;接口温度:290℃。选择离子监测(SIM)方式,克伦特罗特征离子:m/z 86(定量离子)、212、262、277;沙丁胺醇特征离子:m/z 86、350、369(定量离子)、440;莱克多巴胺特征离子:m/z 179、234、250(定量离子)、502。
1.4 基质效应评价方法
按照Matuszewski等[12]提出的提取后添加法定量评价基质效应强度。分别测定空白提取液与纯溶剂中添加同浓度分析物的离子响应强度,计算二者的相对比值来评价基质效应。
1.5 统计分析
所有数据采用SPSS 17.0软件进行多因素方差分析。
2 结果与讨论
2.1 仪器条件优化
参考农业部1031号公告-3-2008标准及文献[19]优化仪器条件,实验表明,使用 HP-5MS毛细管色谱柱在优化的色谱条件下目标分析物具有良好的色谱行为,可与杂质实现有效分离。采用全扫描模式获得3种β-兴奋剂药物的三甲基硅醚衍生物的质谱图如图1所示,据此选择每种分析物灵敏度相对较高和稳定的4个碎片离子进行定性、定量分析。
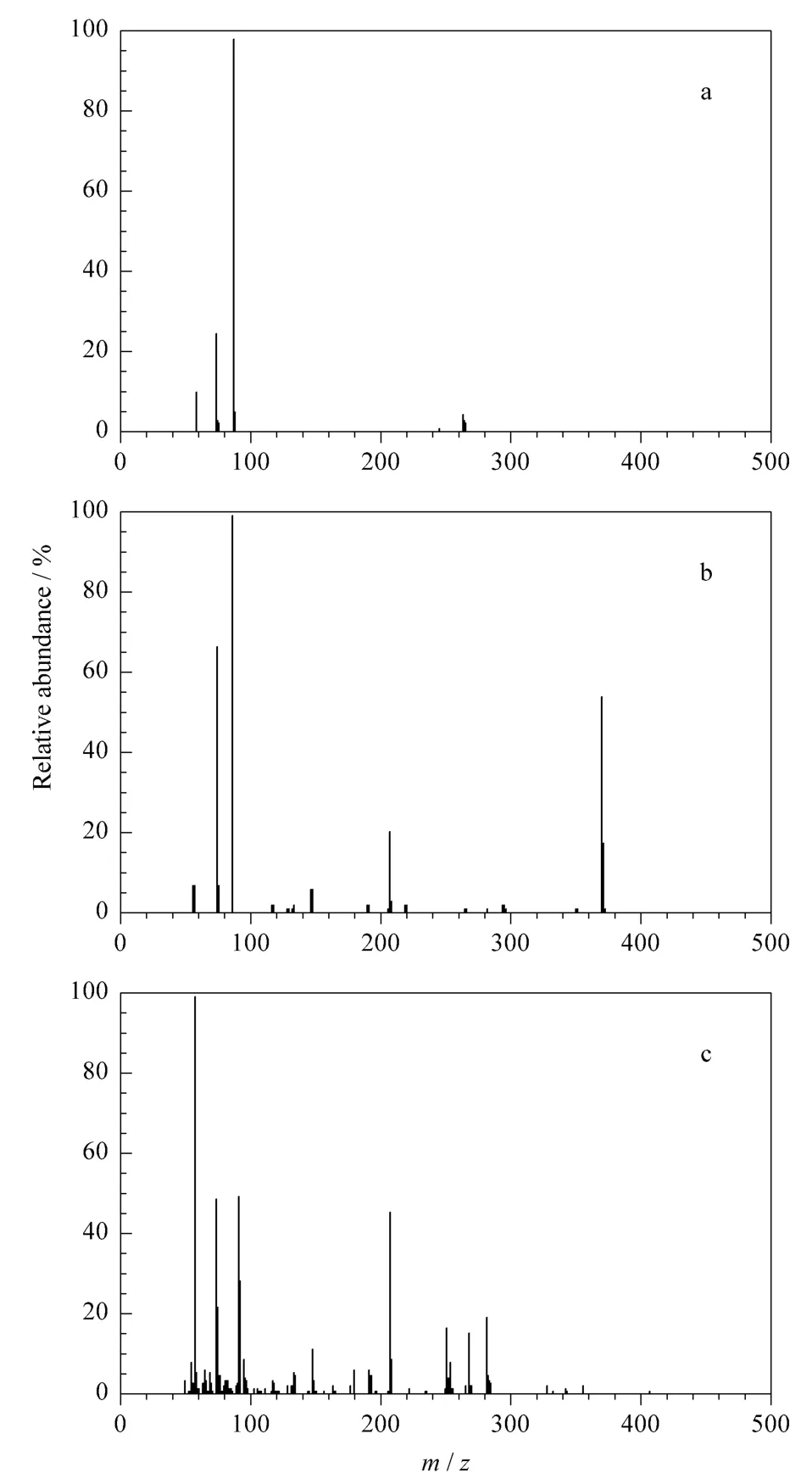
图1 3种分析物的质谱图Fig.1 Mass spectra of the three β-agonist drugs
2.2 猪组织冻干粉的相对重量
根据不同称样量时猪组织试样冻干前后的重量计算猪肝脏和肌肉冻干粉占相应鲜肝脏和肌肉的相对重量分别为30.8%~35.0%和28.2%~30.0%,如图2所示。
2.3 鲜猪肝脏与其冻干粉的基质效应比较
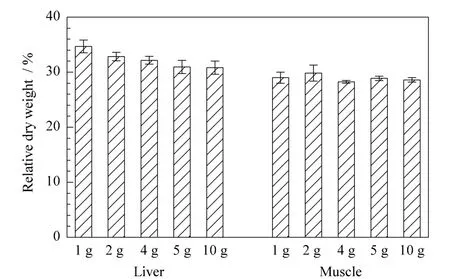
图2 猪肝脏和肌肉冻干粉占相应鲜组织的相对重量(n=3)Fig.2 Relative weight of freeze-dried pig liver and muscle to their corresponding fresh samples(n=3)
采用1.2节前处理方法和1.3节仪器条件检测,3种β-兴奋剂呈现显著的基质增强效应。考察猪肝脏基质状态和基质重量2个因素对3种分析物ME的影响。SPSS多因素方差分析表明,样品状态(鲜样和冻干粉)对3种分析物ME的影响差异不显著(P>0.05);基质重量对3种分析物响应的影响差异均显著(P<0.05),结果见表1。
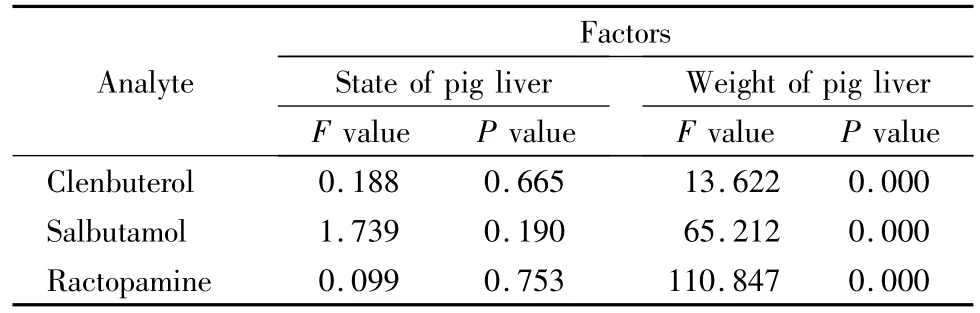
表1 猪肝状态及重量对3种分析物基质效应的影响Table 1 Influence of pig liver state and its weight on matrix effects of the three analytes
进一步分析基质状态(鲜猪肝及其冻干粉)对ME的影响。鲜肝脏中克伦特罗、沙丁胺醇及莱克多巴胺的ME分别为179%、317%及1076%,肝脏冻干粉中克伦特罗、沙丁胺醇及莱克多巴胺的ME分别为178%、312%及1081%,二者间各药物的基质效应差异均不显著(P>0.05)。由于在冻干的过程中,只是失去了动物组织中的水,其他成分没有变化,在本研究优化的前处理方法条件下,鲜样与其相应冻干粉的基质提取成分类似,所以目标分析物的基质效应无显著差异。
采用GC-MS分析3种药物存在高的基质增强效应,特别是基质中莱克多巴胺的响应是纯溶剂中的10倍以上,使用基质匹配标准校正尤为重要。鲜猪肝及其相应冻干粉中3种β-兴奋剂的典型选择离子色谱图见图3。
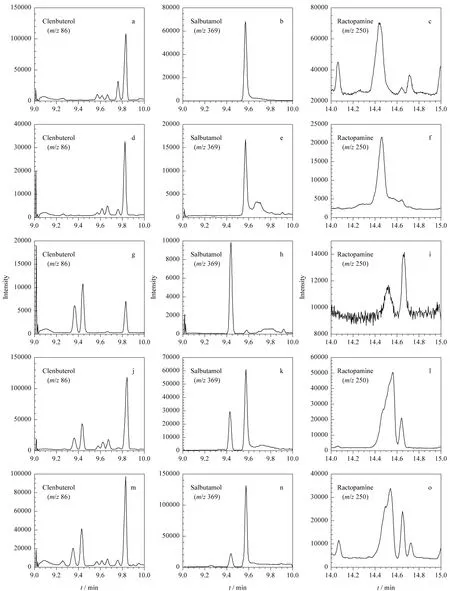
图3 纯溶剂与猪肝组织试样添加3种β-兴奋剂的选择离子色谱图Fig.3 Typical ion chromatograms of the three β-agonists in pure solvent and the spiked pig liver samples
鲜猪肝与其冻干粉的实验结果表明,试样中水分对3种β-兴奋剂ME的影响较小,猪肝冻干粉的基质效应与相应猪肝脏新鲜组织产生的基质效应相当。在实际样品中β-兴奋剂残留分析测定时,可以考虑用处理好的冻干粉萃取物来配制基质匹配标准溶液,以提高残留分析的科学性和准确性,冻干粉与鲜样匹配重量可以参考图2结果。同时,单因素方差分析表明,1 g和2 g猪肝样品中克伦特罗的ME与其他实验猪肝重量样品间的ME差异显著(P<0.05),沙丁胺醇的ME只有4 g与5 g样品间的ME差异不显著(P>0.05),其他样品间差异显著(P<0.05);不同猪肝重量间莱克多巴胺的ME差异均显著(P<0.05)。这表明试样重量对不同化合物的基质效应的影响是不同的。随着试样基质重量增加,其干物质的量也相应增加,干物质中含有的基质效应物质也随之增加,从而导致ME在一定范围内随重量增加而增强;当样品重量增加到一定程度时,可能是一定量的提取液可以提取出来的基质效应物质的量达最大,所以ME不再继续增强。因此,在一定条件下,称取合适重量的样品进行残留分析也是值得考虑的。不同重量猪肝中3种β-兴奋剂的ME大小见图4。
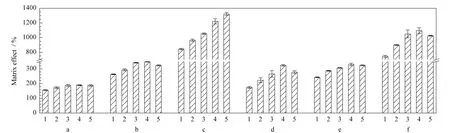
图4 样品重量对猪肝脏与肌肉组织中3种β-兴奋剂的基质效应影响(n=3)Fig.4 Influence of sample weight on matrix effects of the three β-agonists in pig liver and muscle tissues(n=3)
2.4 鲜猪肉与其冻干粉的基质效应比较
多因素方差分析表明,猪肉基质状态和基质重量对3种分析物ME的影响与猪肝中类似,猪肉样品状态(鲜样和冻干粉)对3种分析物的ME的影响差异不显著(P>0.05),猪肉重量对3种分析物的ME影响显著(P<0.05),结果见表2。
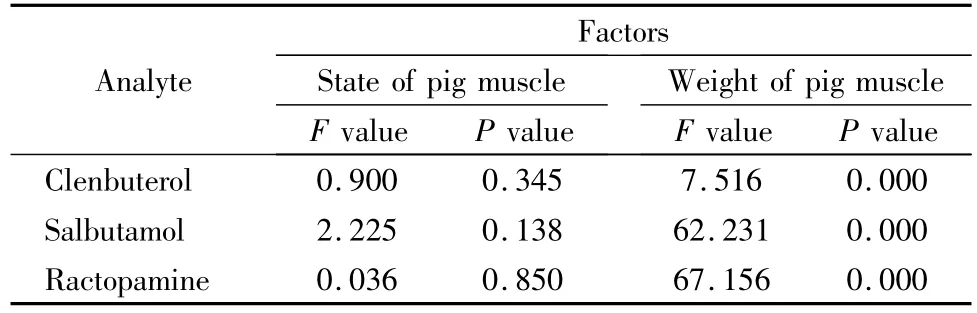
表2 猪肉状态及重量对3种分析物基质效应的影响Table 2 Influence of state of pig muscle and its weight on matrix effects of the three analytes
依据上述ME的计算方法,鲜猪肉中克伦特罗、沙丁胺醇及莱克多巴胺的ME分别为244%、295%及918%,猪肉冻干粉中克伦特罗、沙丁胺醇及莱克多巴胺的ME分别为262%、301%及920%。单因素方差分析表明,鲜猪肉及其冻干粉中3种β-兴奋剂的ME与猪肝中的分析结果类似,二者ME差异不显著(P>0.05),进一步说明因鲜猪组织与其相应冻干粉的基质提取成分类似,所以目标分析物的基质效应无显著差异。鲜猪肉及其相应冻干粉中3种β-兴奋剂的典型选择离子色谱图见图5。
进一步比较不同重量猪肉的ME,克伦特罗的ME 为5 g>10 g>4 g>2 g>1 g,1 g样品与4 g、5 g及10 g样品,2 g样品与5 g样品的ME差异显著(P<0.05);沙丁胺醇的ME为5 g>10 g>4 g>2 g>1 g,只有5 g与10 g样品的 ME差异不显著(P>0.05),其他样品差异显著(P<0.05);莱克多巴胺的ME为5 g>4 g>10 g>2 g>1 g,只有4 g与10 g样品的ME差异不显著(P>0.05),其他重量样品的ME差异显著(P<0.05)。单因素方差分析表明,在一定的重量范围内(1~5 g),与猪肝组织类似,ME随着样品重量增大而增强;但为什么当样品重量大于5 g时,猪肉组织中3种分析物的ME均随样品重量增加而减小,是否是提取不完全还需深入实验研究。不同重量猪肉中3种β-兴奋剂的ME见图4。
3 结论
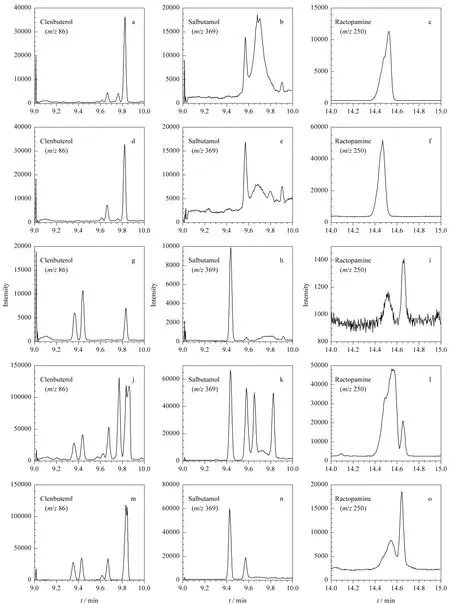
图5 纯溶剂标准与猪肉组织试样添加3种β-兴奋剂的选择离子色谱图Fig.5 Typical ion chromatograms of the three β-agonists in pure solvent and the spiked pig muscle samples
本实验系统评价了GC-MS检测模式下,不同基质重量、不同基质状态(鲜样和冻干粉)的猪肝脏和肌肉组织中克伦特罗、沙丁胺醇及莱克多巴胺等3种β-兴奋剂的基质效应。方差分析结果表明:不同基质重量的基质效应差异显著(P<0.05),不同基质状态猪肝脏和肌肉组织的鲜样及其冻干粉的基质效应差异不显著(P>0.05)。猪可食性组织相应冻干粉有望作为通用基质,用于GC-MS测定β-兴奋剂残留中基质效应的校正,也为动物性食品中药物残留检测的基质效应研究提供理论基础。
[1]Zhai F L,Lai K Q,Zhang Y L,et al.Food Science(翟福丽,赖克强,张衍亮,等.食品科学),2011,32(5):351
[2]Zhang H T,Wang Z L,Deng R G,et al.Food Science(张海棠,王自良,邓瑞广,等.食品科学),2009,30(3):175
[3]Savant R H,Banerjee K,Utture S C,et al.J Agric Food Chem,2010,58(3):1447
[4]Gonzalez-Rodriguez R M,Cancho-Grande B,Simal-Gandara J.J Chromatogr A,2009,1216(32):6033
[5]Matuszewski B K,Constanzer M L,Chavez-Eng C M.Anal Chem,1998,70(5):882
[6]Poole C F.J Chromatogr A,2007,1158(1/2):241
[7]Wang L Z,Zhou Y,Chen Y,et al.Chinese Journal of Chromatography(王连珠,周昱,陈泳,等.色谱),2012,30(2):146
[8]Xu X L,Zhao H X,Li L,et al.Chinese Journal of Chromatography(许秀丽,赵海香,李礼,等.色谱),2012,30(3):267
[9]Yadav M,Trivedi V,Upadhyay V,et al.J Chromatogr B,2012,885/886:138
[10]Jiang H,Cao H,Zhang Y,et al.J Chromatogr B,2012,891/892:71
[11]Wang P,Jiang X H,Wang L.Chinese Journal of New Drugs(王鹏,蒋学华,王凌.中国新药杂志),2011,20(20):1953
[12]Matuszewski B K,Constanzer M L,Chavez-Eng C M.Anal Chem,2003,75(13):3019
[13]Chen Y,Zhu J,Yu Z S,et al.Chinese Journal of Chromatography(陈跃,朱军,于忠山,等.色谱),2012,30(11):1148
[14]Lahaie M,Mess J N,Furtado M,et al.Bioanalysis,2010,2(6):1011
[15]Shao B,Jia X F,Zhang J,et al.Food Chem,2009,114(3):1115
[16]Moragues F,Igualada C.Anal Chim Acta,2009,637(1/2):193
[17]Wang L Q,Zeng Z L,Shu J H,et al.Chinese Journal of Analytical Chemistry(王立琦,曾振灵,束建花,等.分析化学),2012,40(9):1445
[18]Liu M,Liu R,Wang L Q,et al.Journal of Instrumental Analysis(刘敏,刘戎,王立琦,等.分析测试学报),2012,31(3):290
[19]Wu P G,Chen H H,Wang Q,et al.Chinese Journal of Chromatography(吴平谷,陈慧华,王强,等.色谱),2008,26(1):39
