哮喘合并侵袭性肺曲霉病
2014-09-28石亚琴吴晓东程旻桦
石亚琴,施 毅,吴 婷,吴晓东,程旻桦,苏 欣
0 引 言
近年来,随着艾滋病、器官移植和肿瘤化疗等严重免疫抑制人群的增加,侵袭性肺曲霉病(invasive pulmonary aspergillosis,IPA)发病率快速上升,其病情重,进展快,病死率高且易被误诊[1]。慢性气道炎症性疾病,如哮喘和慢阻肺等免疫轻度缺陷人群的IPA发病率也高于普通人群。另外,反复全身激素与抗生素治疗,也是其罹患IPA的易感因素[2-3],但临床医师对此认识不充分。现将2014年金陵—梅奥教学大查房中我院1例严重哮喘合并IPA病例的诊治过程及其临床特点和经验教训进行分析讨论。
1 病例介绍
患者男性,61岁。因“反复发作性喘息50余年,加重1月余,发热20天”于2009年10月1日来我院就诊。患者自2009年8月底出现气喘加重,伴发热,咳少量黄痰。查血常规:白细胞7.9×109/L,中性粒细胞80%。胸部CT:两上肺陈旧性结核,肺气肿。外院先后给予头孢匹胺抗感染治疗,吸入支气管扩张剂平喘,静脉滴注甲泼尼龙(40 mg,3次/d),同时应用氟康唑(大扶康)预防真菌感染。2009年9月25日复查胸部CT示两肺浸润影,以右上肺为主,伴空洞形成,见图1。同时,患者出现高热,体温最高39.4℃,咳大量黄脓痰、咯血,遂于同年10月1日入我科治疗。
患者既往确诊支气管哮喘50余年,自2007年以来规律吸入高剂量糖皮质激素和长效β2受体激动剂(ICS/LABA)联合应用。平均每年1次因上呼吸道感染导致哮喘急性发作而至医院就诊,需静脉使用激素治疗。平时无明显夜间憋醒及活动受限症状。2008年肺功能检查显示中重度阻塞性肺通气功能障碍。否认高血压、糖尿病史。

图1 患者2009年9月25日胸部CT示两肺浸润影伴空洞形成
入院体格检查:T 38.8℃,P 105次/分,R 20次/分,BP 135/80mmHg(1mmHg=0.133kPa)。呼吸急促,右上肺叩诊浊音,两肺呼吸音低,闻及哮鸣音及湿啰音。实验室检查:白细胞16.2×109/L,中性粒细胞88%,CRP 111mg/L,空腹血糖11 mmol/L,清蛋白26g/L。血气分析示Ⅱ型呼吸衰竭。痰培养为鲍曼不动杆菌生长。痰涂片未见真菌孢子及菌丝。血清G试验2580 pg/mL、半乳甘露聚糖(galactomannan,GM)试验2.66 pg/mL。T淋巴细胞(CD3+)50%,T辅助诱导细胞(CD4+)12%,T抑制杀伤细胞(CD8+)37%,T 辅助/T 抑制0.32,IgE 69.3IU/mL。
诊疗经过:入院时查痰培养与血培养结果均为耐甲氧西林凝固酶阴性葡萄球菌,多次痰抗酸染色阴性。入院后给予亚胺培南、伊曲康唑和利奈唑胺静脉滴注抗感染治疗。同时给予雾化吸入激素布地奈德及支气管扩张剂沙丁胺醇,静脉滴注甲泼尼龙(40 mg,1次/d)治疗哮喘。治疗4d后体温恢复正常,喘息症状好转,血培养及痰培养无致病菌生长,停亚胺培南及利奈唑胺,全身激素逐渐减量至停用。但其后2次痰培养生长曲霉(2+),继续静脉伊曲康唑治疗1个月后,患者临床症状稳定,出院口服伊曲康唑口服液治疗。出院5 d后患者咳嗽加剧,咳痰量增多,咯血,胸闷气喘症状较前加重,且出现双下肢浮肿。痰真菌培养示烟曲霉(2+)。2009年11月16日胸部CT显示两上肺空洞性病变,范围较前缩小,患者再次入院,给予卡泊芬净联合伊曲康唑抗真菌治疗。2009年11月30日患者突发喘息症状加重,不能平卧,查体两肺闻及广泛哮鸣音,右肺呼吸音偏低。胸片示右侧气胸,给予右侧胸腔闭式引流以及负压吸引2周,引流管气体持续溢出,复查CT显示气胸破口仍无愈合迹象,见图2。遂于12月29号行右上肺叶切除术。术后病理诊断为IPA,见图3。术后痰真菌培养转阴。继续给予伏立康唑联合卡泊芬净治疗2个月,出院后口服伏立康唑片继续治疗。2010年4月5日,患者再次出现咳嗽咳痰,痰中带血,伴低热,胸部CT显示左上叶病灶较前有所增加,见图4。患者第3次入院治疗,停口服伏立康唑,改为静脉滴注伏立康唑和卡泊芬净加强抗真菌治疗2周。症状明显好转,出院后口服伏立康唑片治疗,同时吸入ICS/LABA治疗哮喘。多次复查胸部CT示左肺病灶明显吸收,见图5。2010年8月停口服伏立康唑。门诊继续随访,并给予ICS/LABA长期吸入控制哮喘。

图2 患者2009年11月30日胸部CT示交通性气胸不能愈合
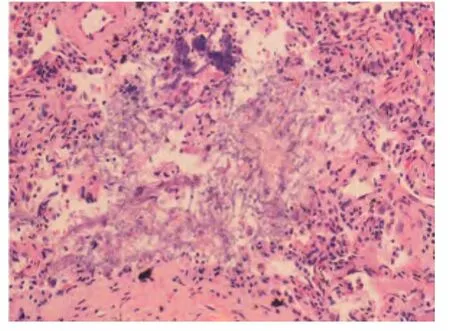
图3 肺组织术后病理示肺曲霉感染(HE×200)
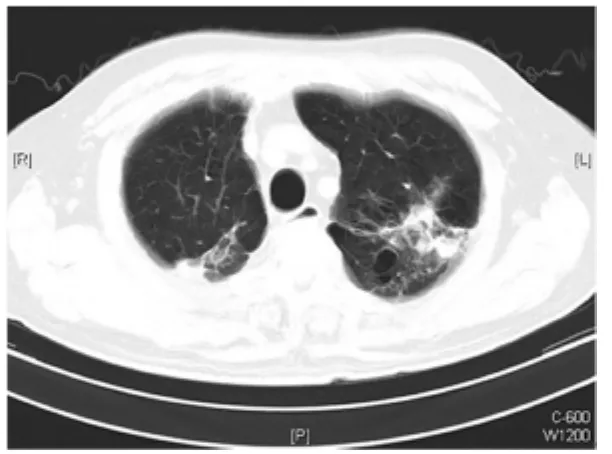
图4 患者2010年4月5日胸部CT显示左上叶病灶较前有所增加

图5 患者2010年8月2日胸部CT示左肺病灶明显吸收
2 病例讨论
呼吸科实习医师石亚琴:严重哮喘病人合并肺部浸润影,同时痰培养出曲霉时,需要和变应性支气管肺曲霉病(allergic bronchopulmonary aspergillosis,ABPA)进行鉴别,此例患者不考虑为ABPA,因为参照Grenberger和Patternson界定的ABPA诊断标准为:①支气管哮喘;②存在或以前曾有肺部浸润;③中心型支气管扩张;④外周血嗜酸性细胞增多;⑤烟曲霉变应原速发性皮肤试验阳性;⑥烟曲霉变应原沉淀抗体阳性;⑦血清抗曲霉特异性IgG抗体增高;⑧血清总IgE浓度增高。本例患者血清总IgE和特异性的IgE正常,影像学无中心性支气管扩张,并且外周血无嗜酸性细胞增多的现象[4]。
根据2008年的IDSA曲霉病指南,对确诊或临床诊断的侵袭性肺曲霉感染患者治疗时首选伏立康唑。重症患者可以考虑联合治疗,通常推荐伏立康唑联合卡泊芬净,疗程至少12周以上[5-6]。疗程的长短根据治疗反应而确定。停止抗真菌治疗的前提是影像学病灶消失或稳定不变、曲霉清除以及免疫功能恢复[7]。
本例患者长期规律吸入高剂量ICS+LABA治疗哮喘,但未控制哮喘。此次哮喘严重发作,给予静脉或者口服糖皮质激素后,病情有所控制,但并未达到哮喘的完全控制[8]。这给IPA的治疗和预防带来了困难。
呼吸科苏欣副主任医师:全面准确诊断是正确治疗的前提。对于该患者来说,我们需要从两方面评估。一方面评估患者的基础疾病状况,包括其哮喘的控制水平、严重程度,哮喘的相关用药对机体免疫状况的影响;另一方面要评估肺部感染的严重度、致病病原体种类及其耐药状况,以选择合适的抗感染治疗方案。
首先,患者长期吸入高剂量皮质激素联合长效β受体激动剂治疗哮喘,虽然平时症状得到控制,但稳定期肺功能存在中重度气流阻塞,并且每年均有哮喘急性加重,因此未达到哮喘总体控制。患者的胸部CT显示存在明显肺气肿及肺大疱,提示患者存在肺结构改变。这些均提示患者罹患IPA的风险增大。患者此次急性哮喘发作后接受了大剂量全身糖皮质激素治疗后,CD4+T淋巴细胞绝对计数显著降低,说明患者存在免疫抑制。基础疾病及免疫抑制导致患者易发生肺部真菌感染。其次,我们需要评估患者此次肺部感染的严重度。患者入院时为两肺多发浸润空洞影,快速进展,血气示呼吸衰竭,诊断为重症肺炎,收入ICU治疗。病原学检测血培养及痰培养均为耐药凝固酶阴性葡萄球菌,真菌血清学检测及培养均为阳性。因此该患者为二重感染,需要同时治疗耐药细菌和真菌感染。在给予充分抗感染治疗2周后再次评估时发现,细菌学检测阴性,但烟曲霉持续存在。停止抗细菌治疗药物,单用抗曲霉治疗。在经历长达近1年的抗真菌治疗过程中,患者还反复发生自发性气胸、低蛋白血症、电解质紊乱和充血性心衰等疾病相关或药物相关的并发症,根据文献报道,这类患者病死率极高。虽然经过1年的内外科协同治疗,我们成功挽救了患者的生命,但我们还要认识到,诊疗仍未结束。严重哮喘的长期治疗及如何预防再次发生严重肺部感染仍旧是这个病人面临的问题。既往慢性肺病及此次严重感染导致的肺结构破坏、长期吸入高剂量激素和反复急性加重时全身糖皮质激素的使用等使得该患者再次罹患IPA等感染的风险持续存在。而反复呼吸道感染是该患者哮喘急性发作的主要诱发因素,两者相互作用,形成了恶性循环。
如何实现该患者哮喘的控制,打破这一恶性循环?抗IgE抗体是治疗严重哮喘的新药物,能够有效的减少严重哮喘患者的急性加重次数[9]。但该患者反复血IgE水平正常,缺乏预测抗IgE抗体治疗有效的表型特征。长期的哮喘可以导致患者的气道平滑肌增生等改变,发生气道重塑[10]。支气管热成型术(bronchial thermoplasty,BT)是近年来严重哮喘治疗的新方法。通过射频消融气道平滑肌(airway smooth muscle,ASM)以减少气道收缩,从而减轻哮喘症状,且疗效持久,可以明显减少中重度哮喘的急性加重次数[11]。为了评估哮喘患者经支气管热成型术治疗安全性和疗效持久性,美国科罗拉多州国立犹太健康中心的博士等进行5年的随访研究。结果显示:受试者术后严重哮喘急性发作和因呼吸道症状而急诊就医的比例均持续减少。当重度持续性哮喘患者在吸入高剂量ICS/LABA后,症状仍难以控制时,可以考虑选用这种治疗方法[12]。
IPA最常发生于免疫严重受损的人群,也可见于免疫轻度受损的人群。虽然其发病率较低,但其病情重,进展快,病死率很高,并且容易误诊。根据发病危险因素、临床特征、微生物检查和组织病理学证据,IPA的诊断分为确诊,临床诊断和拟诊3级。确诊需要从病变肺组织获取病理学和微生物学的证据。而具有危险因素、临床特征和微生物学依据,但没有病理学证据时,为临床诊断。只具有危险因素和临床特征者为拟诊[5,13]。临床上,由于种种原因,确诊IPA十分不易,大多数病人为临床诊断或拟诊。该例患者具有长期的激素吸入治疗史,近期大剂量静脉激素和广谱抗菌药治疗等危险因素,患者出现高热、咳黄脓痰和咯血等症状,胸部CT显示两肺多发空洞性病变,快速进展。微生物学检查,包括痰培养、血清G试验和GM试验,均提示肺真菌感染。最终,患者右上肺切除术后病理证实肺曲霉感染。据此,该例患者确诊为IPA。
肺曲霉感染合并哮喘存在,加重了临床治疗的难度。曲霉感染可通过变态反应进一步加重哮喘发作;反过来,哮喘反复发作不易控制,导致糖皮质激素的应用增加,也增加了曲霉感染可能性[14]。呼吸道病原体定植与感染又可加重气道重塑[10]。
总之,哮喘是常见的慢性气道炎症性疾病,大部分病人可以通过合理的治疗获得控制,预后良好。但严重哮喘仍旧是临床治疗的难题,是目前研究的重点。而IPA是死亡率极高的严重疾病。当哮喘合并IPA其治疗难度增大。及时正确诊断、尽早有效抗真菌治疗是关键。
呼吸科施毅主任医师:此例患者因哮喘急性发作而静脉使用了大剂量糖皮质激素,诱发了以侵袭性肺曲霉感染为主的多种病原菌感染并存的医院获得性肺炎,同时发生了呼吸衰竭、交通性气胸、低蛋白血症等多种并发症,治疗难度大。在长时间采用联合抗曲霉药物治疗效果仍旧不理想,患者生命受到严重威胁。该患者及时选择手术治疗很关键。根据IDSA指南,对于曲霉肺部病变的手术切除可以提供一个明确的诊断,同时可以去除局部的病灶。病变与大血管或心包相邻、单个空洞病变引发咯血或胸膜间隙受侵的患者可从外科治疗获益。患者是否采取外科治疗取决于病变严重程度、机体耐受能力以及替代性药物治疗的潜在作用等因素[5,7]。考虑到患者气胸不能自愈,且病情危急,与心胸外科医师讨论后,决定行右上肺切除术。事实证明,术前连续10余次痰真菌培养烟曲霉(+),而术后第1次痰真菌培养(-),提示此次手术去除了病变最为严重的持续排菌的病灶,阻止了病变进一步扩散,治愈了气胸,为最终治疗成功起到重要作用[15]。这也体现多学科合作的重要性。
以外,哮喘及IPA并发症的及时发现与处理也很重要,患者气胸发生时表现为突发气喘加重,不能平卧。气胸侧呼吸音减低不明显且可闻及广泛哮鸣音,如果没有想到气胸可能并及时拍片检查,只是一味增加糖皮质激素用量,将贻误治疗时机,造成病人死亡。
梅奥医学中心Wylam教授:严重哮喘发展至后期,具有慢阻肺的临床和病理生理特征,表现为气体陷闭、肺气肿和肺实质的破坏,同时还存在气道平滑肌的改变[16]。这些肺结构改变增加了肺曲霉病发生风险。
曲霉病的发生、发展与宿主的免疫状况以及曲霉孢子多少、感染途径等因素有关。目前已经发现184种曲霉,其中40种为条件致病性曲霉。其中以烟曲霉最为常见且致病力最强[17]。曲霉可以通过气溶胶吸入等途径引起感染。曲霉吸入呼吸道后有五种结局:病原被清除、形成曲霉球、慢性坏死性肺曲霉病(chronic necrotizing pulmonary aspergillosis,CNPA)、IPA或ABPA。宿主基础疾病及免疫状况是决定不同结局的主要因素。免疫正常的宿主吸入曲霉孢子后可很快清除,存在肺结构异常如结核导致的陈旧性空洞等宿主容易发生曲霉球,存在慢性肺部疾病以及轻度免疫缺陷患者易发生CNPA,对于严重免疫缺陷尤其是接受骨髓移植或者慢性免疫抑制治疗的患者较易发生IPA,具有特异质的患者可导致ABPA[17-18]。宿主通过病原模式识别受体识别病原。曲霉内层细胞壁包含β-葡聚糖,甘露聚糖,壳多糖和半乳甘露聚糖等[18]。曲霉进入机体后,其表面的糖结构与免疫细胞表面模式识别受体结合,启动固有免疫系统释放细胞因子和趋化因子,促进巨噬细胞和树突状细胞对孢子的吞噬。C型凝集素和 Toll样受体是模式识别重要受体,通过MyD88非依赖性通路或依赖性通路,触发一系列的炎症反应[18]。
曲霉球是常见的曲霉致病形式[17],其主要症状是咯血[19]。诊断依靠X线或CT检查。特征性表现为菌球上方与空洞壁之间有新月形透亮区,往往无液平,体位摄影示曲霉球可随体位改变而活动[20]。手术切除可治愈曲霉球[21]。对于不能手术治疗的患者,腔内注射两性霉素B对于控制曲霉球引起的出血具有良好的短期疗效[22]。
IPA易发生于免疫抑制的患者,是肺曲霉病中最严重的类型,诊断和治疗困难。来自梅奥医学中心的研究显示,在1996年至2003年期间在该医院接受异基因造血干细胞移植(HSCT)的71位患者尸检发现肺曲霉病占总并发症的11%[23]。GM是曲霉细胞壁的一种特异抗原成分,在曲霉侵犯组织早期即可释放入血。因此检测血清中GM抗原成为早期诊断手段。其特异性大于85%,敏感性介于29% ~100%[24]。影像学检查早期显示胸膜下单发或多发结节状或斑片状阴影,数天之后病灶周围出现晕轮征(halo sign),表现为围绕结节的密度高于肺实质但低于结节的环形带。晕轮征具有早期诊断的价值[25]。后期结节周围坏死吸收形成含气空腔,出现新月征(crescent sign)或者空洞,这是IPA较为特征的征象[26]。
CNPA为缓慢起病,呈慢性过程。患者存在轻度的免疫抑制,常见于慢性肺部疾病如慢阻肺、肺结核或长期小剂量激素治疗的患者。有研究表明表面活性蛋白A2和TLR4的单核苷酸多态性(SNPs)与CNPA相关,同时CNPA患者较易出现低IL-10和TGF-β1[27]。几乎所有的 CNPA 患者需要进行系统的抗真菌治疗,目前可选择药物有伊曲康唑、伏立康唑、泊沙康唑和两性霉素B。对于病程迁延、反复咯血、可以耐受手术的患者,可以行手术治疗[28]。
3 结 语
本例患者的哮喘病史及长期激素治疗致患者罹患IPA,IPA作为肺曲霉病最严重的类型治疗困难、死亡率高,当哮喘同时合并IPA时,治疗难度进一步增大。面对此类患者早期正确的诊断、有效的抗真菌治疗以及多学科合作综合治疗是患者成功治疗的关键。
[1]Castón JJ,Linares MJ,Gallego C,et al.Risk factors for pulmonary Aspergillus terreus infection in patients with positive culture for filamentous fungi[J].Chest,2007,131(1):230-236.
[2]Samarakoon P,Soubani A.Invasive pulmonary aspergillosis in patients with COPD:a report of five cases and systematic review of the literature[J].Chron Respir Dis,2008,5(1):19-27.
[3]Tutar N,Metan G,Koc AN,et al.Invasive pulmonary aspergillosis in patients with chronic obstructive pulmonary disease[J].Multidiscip Respir Med,2013,8(1):59.
[4]高卫卫,苏 欣,施 毅.16例ABPA临床特征及误诊分析[J].临床肺科杂志,2013,18(10):1798-1799.
[5]Walsh TJ,Anaissie EJ,Denning DW,et al.Treatment of aspergillosis:clinical practice guidelines of the Infectious Diseases So-ciety of America[J].Clin Infect Dis,2008,46(3):327-360.
[6]施 毅.侵袭性肺真菌病诊治的再认识[J].中华结核和呼吸杂志,2011,34(2):83-85.
[7]张 静,何礼贤.侵袭性肺真菌病诊治指南解读[J].中国药物应用与监测,2011,8(5):261-264.
[8]Bateman E,Hurd S,Barnes P,et al.Global strategy for asthma management and prevention:GINA executive summary[J].Eur Respir J,2008,31(1):143-178.
[9]Cho JY.Recent advances in mechanisms and treatments of airway remodeling in asthma:a message from the bench side to the clinic[J].Korean J Intern Med,2011,26(4):367-383.
[10]Vignola AM,Mirabella F,Costanzo G,et al.AIrway remodeling in asthma[J].Chest,2003,123(3 Suppl):S417-S422.
[11]Cox G,Thomson NC,Rubin AS,et al.Asthma control during the year after bronchial thermoplasty[J].N Engl J Med,2007,356(13):1327-1337.
[12]Wechsler ME,Laviolette M,Rubin AS,et al.Bronchial thermoplasty:Long-term safety and effectiveness in patients with severe persistent asthma[J].J Allergy Clin Immunol,2013,132(6):1295-1302.
[13]何礼贤,邵长周.侵袭性肺曲霉病的分级诊断和治疗[J].中华结核和呼吸杂志,2006,29(5):297-298.
[14]胡莉娟,朱 蕾,何礼贤,等.支气管哮喘继发肺曲霉菌感染[J].中华结核和呼吸杂志,2006,29(12):854-856.
[15]Azzola A,Passweg JR,Habicht JM,et al.Use of lung resection and voriconazole for successful treatment of invasive pulmonary Aspergillus ustus infection[J].J Clin Microbiol,2004,42(10):4805-4808.
[16]Barnes PJ.Chronic obstructive pulmonary disease[J].New Engl J Med,2000,343(4):269-280.
[17]Soubani AO,Chandrasekar PH.The clinical spectrum of pulmonary aspergillosis[J].Chest,2002,121(6):1988-1999.
[18]Park SJ,Mehrad B.Innate immunity to Aspergillus species[J].Clin Microbiol Rev,2009,22(4):535-551.
[19]Aspergillus in persistent lung cavities after tuberculosis.A reportfrom the Research Committee of the British Tuberculosis Association[J].Tubercle,1968,49(1):1-11.
[20]Roberts CM,Citron KM,Strickland B.Intrathoracic aspergilloma:role of CT in diagnosis and treatment[J].Radiology,1987,165(1):123-128.
[21]Lejay A,Falcoz PE,Santelmo N,et al.Surgery for aspergilloma:time trend towards improved results?[J]Interact Cardiovasc Thorac Surg,2011,13(4):392-395.
[22]Kravitz JN,Berry MW,Schabel SI,et al.A modern series of percutaneous intracavitary instillation of amphotericin B for the treatment of severe hemoptysis from pulmonary aspergilloma[J].Chest,2013,143(5):1414-1421.
[23]Sharma S,Nadrous HF,Peters SG,et al.Pulmonary complications in adult blood and marrow transplant recipients:autopsy findings[J].Chest,2005,128(3):1385-1392.
[24]Mennink-Kersten MA,Donnelly JP,Verweij PE.Detection of circulating galactomannan for the diagnosis and management of invasive aspergillosis[J].Lancet Infect Dis,2004,4(6):349-357.
[25]Greene RE,Schlamm HT,Oestmann JW,et al.Imaging findings in acute invasive pulmonary aspergillosis:clinical significance of the halo sign[J].Clin Infect Dis,2007,44(3):373-379.
[26]朱小敏,周 新.侵袭性肺曲霉病的诊断与治疗[J].中国呼吸与危重监护杂志,2005,4(4):316-320.
[27]Sambatakou H,Pravica V,Hutchinson I,et al.Cytokine profiling of pulmonary aspergillosis[J].Int J Immunogenet,2006,33(4):297-302.
[28]Endo S,Sohara Y,Murayama F,et al.Surgical outcome of pulmonary resection in chronic necrotizing pulmonary aspergillosis[J].Ann Thorac Surg,2001,72(3):889-893.
