分解反应自催化性质快速鉴别的实验方法
2014-09-21陈利平陈网桦张彩星高海素路贵斌周奕杉
杨 庭 陈利平 陈网桦 张彩星 高海素 路贵斌 周奕杉
(南京理工大学化工学院安全工程系,南京210094)
1 引言
国内外针对自催化分解反应开展了很多研究,认为许多物质(尤其是含能材料)的分解均具有一定的自催化特性.1-3但在很多研究中,人们往往将具有自催化分解特性的物质按照n级分解动力学分析,这很可能导致危险性评估出现偏差,因为符合自催化分解特性的物质诱导期长,但一旦引发后反应速率迅速升高,与n级分解的物质相比,更难以察觉,也更加危险.因此在进行分解动力学分析时,首先需要判定物质分解的类型,然后才能选用相应的动力学模型进行计算,得到比较准确的评估结果.
判定物质分解是否具有自催化特性的方法很多,其中最常用的方法是通过差示扫描量热仪(DSC)等温实验(简称“等温法”)进行表征,如图1所示:4,5若物质放热速率随时间逐渐下降,并且其比放热量与动态DSC相当,说明其分解遵循n级规律;若物质在等温实验中出现钟形放热速率曲线,则说明这种物质的分解具有自催化特性.目前,等温法已成为国内外验证自催化分解特性比较通用的方法.6-8但该方法存在等温温度的选择问题:5若温度选择过高,有可能只得到部分检测信号,得出物质分解不符合自催化特性的结论;温度过低,诱导期会比较长,实验量较大.
此外,文献9,10介绍了通过一级反应动力学的表观活化能判断自催化分解反应的方法,尽管该方法通过实践证明可行有效,但仍然存在需对实测数据进行拟合、处理相对复杂的缺点.
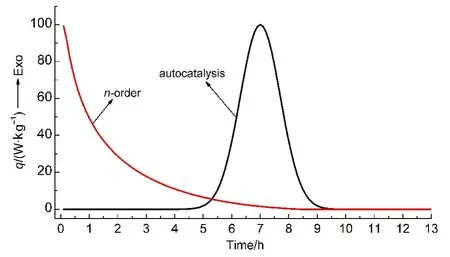
图1 具有n级和自催化热分解性质的等温DSC的放热速率(q)曲线5Fig.1 Isothermal DSC curves of exothermic rate(q)for thermal decomposition with characters of nth-order and autocatalysis5
Roduit等11通过理论模拟发现:对于具有自催化特性的物质,若使其一小部分物质先分解,那么其动态DSC曲线将会发生较大变化,这种变化会在峰形、起始分解温度(Tonset,放热曲线上升段最大斜率点的切线与基线的交点温度)以及峰温上得到体现;反之,对于符合n级分解规律的物质,一小部分物质的分解并不影响该物质动态DSC曲线的峰形、起始分解温度以及峰温.笔者认为可以利用自催化反应和n级反应在DSC动态扫描中的这种区别,判定分解反应是否具有自催化特性.为此,选择两类常见的具有一定热危险性的化学物质(硝基类化合物及有机过氧化物)进行实验验证,其中,硝基类化合物为硝酸异辛酯(EHN)和2,4-二硝基甲苯(2,4-DNT),有机过氧化物为过氧化二异丙苯(DCP)和过氧化氢异丙苯(CHP).对于这4种物质,首先基于Roduit所提出的理论方法进行实验,判定物质分解是符合n级规律还是自催化特性,然后利用等温DSC验证所得结论的准确性.
Luo等12曾利用一种称为“中断恒温法”的DSC实验方法对蛋白质变性过程进行研究,该方法的主要思想是在蛋白质吸热过程中终止升温,转为保温阶段,保温一定时间后降温,然后按照同样的升温速率对样品进行扫描,以确定蛋白质在孵化后期是否具有热稳定性.本文利用相似的理念,提出本文所用到的自催化分解判定方法,简称为“中断回扫法”.
2 实验方法及理论基础
2.1 实验试剂
EHN,质量分数97%;2,4-DNT,质量分数99%;DCP,质量分数99%;以上三种物质均为阿拉丁试剂.CHP,质量分数大于70%(含有0.5%碳酸钠作为稳定剂),国药试剂(沪式).
2.2 实验设备及实验条件
本文所用DSC为梅特勒-托利多生产的DSC-1;由于物质分解大都产生气体,而气体产物也有可能会催化物质分解,因此本文实验所用的坩埚均为高压密闭不锈钢坩埚并配有镀金垫片,容量为30 μL.动态DSC的温升速率均为10°C·min-1.等温DSC的实验温度基于动态实验的结果确定.
2.3 中断回扫法实验步骤及理论依据
2.3.1 实验步骤
中断回扫法的实验过程可由图2简单描述.
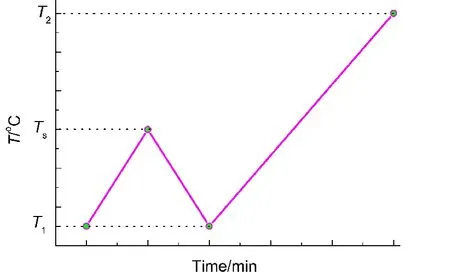
图2 中断回扫方法示意图Fig.2 Schematic diagram of the interruption and rescanning method
对于待测试样品,首先进行一个动态扫描实验,得到样品的起始分解温度、峰温、分解终止温度等参数.在此基础上,重新装样用同样的升温速率进行动态扫描,由起始温度T1升温至中断温度Ts,该温度需要参考第一次动态DSC实验中的Ti(热流偏离基线的温度)以及Tonset后确定,要确保有一小部分待测样品发生分解,然后将样品降温至T1;接着由T1按相同的升温速率升温至终止温度T2.将该过程所得的测试结果与直接由T1升温至T2的测试曲线比较,进而可判断物质分解是否具有自催化特性.当然,物质的分解往往是多个步骤组成的,中断回扫实验所涉及的是中断温度附近的分解.
在本文中,为了更好地比较测试结果,每一个样品均选择三个中断温度重复实验.同时,为了便于描述,本文将T1升温至Ts的过程称为一段测试,由T1升温至T2的过程称之为二段测试.
2.3.2 理论依据5,13,14
对于符合n级分解动力学的物质,其分解可以简化描述为:
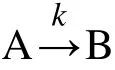
根据文献,13,14较为常用的反应速率方程可以表示为:
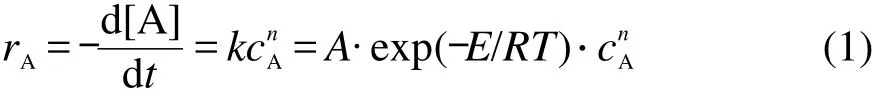
其中,k为反应速率常数,A为指前因子;E为反应活化能,J·mol-1;T为反应温度,K;cA为反应物A的浓度,mol·L-1;n为反应级数.
一旦物质分解的放热速率达到DSC的检测灵敏度,DSC的热流曲线便会开始偏离基线,样品分解生成产物B,同时反应物A的浓度开始降低.所以按照中断回扫法将坩埚中剩余样品再次动态扫描时,实际上可以认为是对同样的样品进行DSC测试,只是样品A的质量稍有减少.
而对于具有自催化分解特性的物质,其分解过程可以简化描述为:
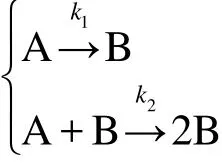
根据文献,13,14较为常用的反应速率方程可以表示为:
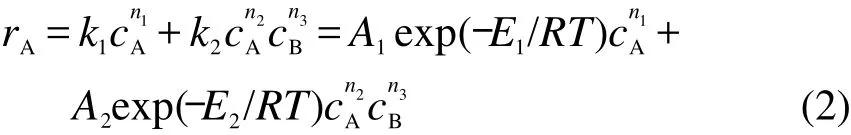
其中,k1、k2分别为两步反应的反应速率常数,A1、A2分别为第1步和第2步反应的指前因子;E1和E2分别为第1步和第2步反应的活化能,J·mol-1;cB为B物质的浓度,mol·L-1;n1以及n2分别为第1步和第2步反应的反应级数.
根据式(2)可以看出,对于具有自催化分解特性的物质,放热速率不但与A的浓度有关,同样与B的浓度也有关系.因此其放热速率会受到B的影响,A分解会产生一定量的B,而B会催化A的分解,缩短了A直接生成B的诱导期,加快了反应进程,产生更多的B,从而使反应速度不断加快.因此当在一段测试中产生一定的B后,二段测试在较低的温度便会达到最大分解速率.
由此可见,对于分解具有自催化性质的物质,其部分分解会明显影响样品稳定性;而对于非自催化的物质,物质的部分分解对整个体系的分解特性影响不大.
3 动态DSC实验结果及分析
3.1EHN
EHN是一种重要的十六烷烃值改进剂,可以显著提高柴油的十六烷烃值,降低点火能.15此外还可以作为液态推进剂的助剂,16应用广泛.该物质是一种典型的―O―NO2化合物,国内外学者均对其热分解特性进行过深入研究.17-20该物质在室温下较为稳定,但温度超过100°C便有分解的可能性.
这里对EHN进行了4次DSC动态实验,分别记为EHN-1#-EHN-4#.其中,EHN-1#由25°C直接线性升温至300°C,由图3可知,EHN分解放热峰的Ti和Tonset分别为150和190 °C.这里分别取180、190以及200°C为中断温度,将样品由25°C升至中断温度再冷却至25°C,最后由该温度线性升温至300°C,得到二段测试的DSC曲线.具体测试结果见图3,图3为4次实验的比放热速率(q)曲线,为了突出研究的主要温度范围,本文所有的动态DSC曲线均只列出放热峰部分.
由图3可知,4次实验的峰形变化不大.为了更好地比较4次实验起始分解温度以及峰温的变化,表1列出了4次实验的测试条件及测试结果,对于EHN-2#-EHN-4#,表中所列的各个参数均是二段测试结果.
根据图3以及表1可以看出,4次实验的Tonset均在188-191°C之间,峰温均在214-215°C之间,由于Tonset的值取决于基线以及放热峰上升段斜率最大的点切线,因此4次实验偏差稍大,但峰温的差别极小,同时比放热量(ΔHr)由于一段测试分解程度不同而差别较大.由此可以看出,EHN的部分分解对样品的起始分解温度尤其峰温影响较小.
3.22,4-DNT
2,4-DNT是一种重要的中间体原料,常用于制造染料中间体以及炸药.鲍士龙等9曾利用等温DSC以及瑞士方法对2,4-DNT的自催化分解特性进行鉴别,是一种已经被证明过的具有自催化特性的物质.
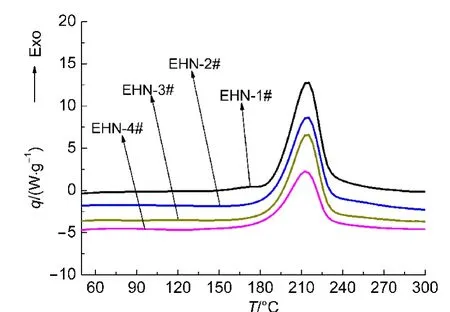
图3 EHN二段测试的比放热速率曲线Fig.3 Curves of exothermic rate for second tests of EHN
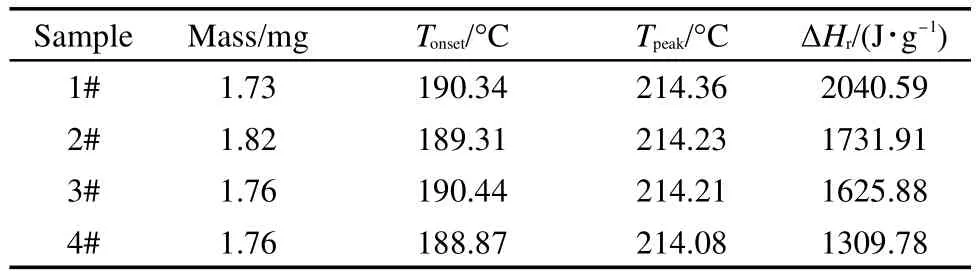
表1 EHN的4次实验DSC测试条件及测试结果Table 1 Conditions and results of four DSC tests for EHN
与EHN类似,也利用4组实验进行判定,其中DNT-1#是从25°C直接升温至450°C;DNT-2#-DNT-4#的中断温度分别为300、310、320 °C.4次实验的测试结果列于图4和表2.
由图4中DNT-1#可以看出,2,4-DNT分解有两个连续的放热峰;4次实验的第一个放热峰的峰形差别较大,尤其是DNT-4#,其峰形和DNT-1#相比较为平缓,且4次实验的峰温差距较大.同时也可以发现,二段实验对2,4-DNT的第二个放热峰几乎没有影响,这是由于在中断温度并没有触发后期的分解.
由表2可知,部分2,4-DNT的分解会对二段测试的起始分解温度以及峰温产生较大影响.中断温度延后10°C,二段测试的起始分解温度以及峰温都会提前数十度.特别是DNT-4#,起始分解温度相对于DNT-1#提前63.14°C,峰温提前36.96°C,变化非常明显,其比放热量也随中断温度的延后而逐渐减小.
3.3DCP
为了证明该方法不仅适用于硝基类化合物,本文也选取了两种有机过氧化物进行实验.
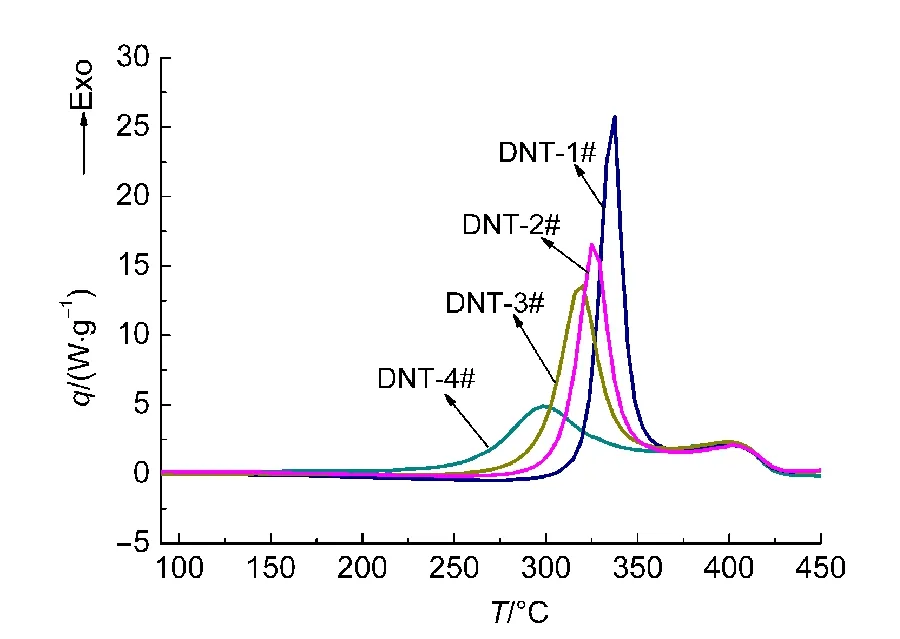
图4 2,4-DNT二段测试的比放热速率曲线Fig.4 Curves of exothermic rate for second tests of 2,4-DNT
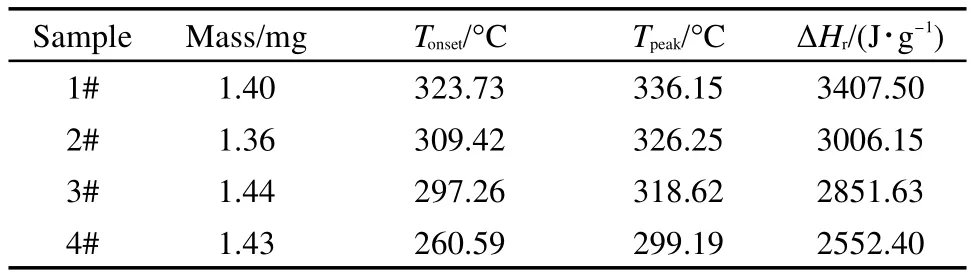
表2 2,4-DNT的4次DSC实验的测试条件及测试结果Table 2 Conditions and results of four DSC tests for 2,4-DNT
DCP广泛应用于塑料行业,常作为天然橡胶以及合成橡胶的硫化剂、聚合反应的引发剂等.该物质受热易分解,Somma21以及Lv22等均将其分解按照n级分解动力学进行分析,Talouba等23也通过等温实验证明其分解符合n级分解规律.
同样采用4组实验判定其分解特性,编号为DCP-1#-DCP-4#.其中DCP-1#是直接由25°C升温至240°C;DCP-2#-DCP-4#都采用中断回扫法进行测试,中断温度分别为140、150以及160°C.4次实验结果列于图5以及表3.
少数民族的服饰精致的做工,色彩浓厚的艳丽感,丰富变化的图案,在线的变化下使人物造型具有很强的艺术性,长此以来,工笔人物的造型形成了两种基本形态:一种是所要表现人物造型与外在物象的形态相对接近,在一定写实的基础上,表达自己的艺术情感。使工整严谨的造型与主观意志相结合,外在美与内在美相结合,自然地表达出精神意涵。另一种为所表现的形与物象外在形象相差较大,以表达主观意识为主,利用线进行提炼、概括、夸张、变形、舍弃了纷繁复杂的变化,是主观的意向表达的更明确,并且与造型巧妙地衔接,使以线为基础的造型更加充满魅力。
由图5和表3可以看出,与DCP-1#相比,DCP-2#-DCP-4#二段测试的起始分解温度以及峰温、峰形均无明显变化.起始分解温度都在149-154°C之间,而峰温差别更小,4次实验的峰温均在180-182°C之间,最大仅相差0.87°C,比放热量也是随着中断温度的延后而逐渐变小,这说明物质的部分分解并没有影响DCP的分解特性.
3.4CHP
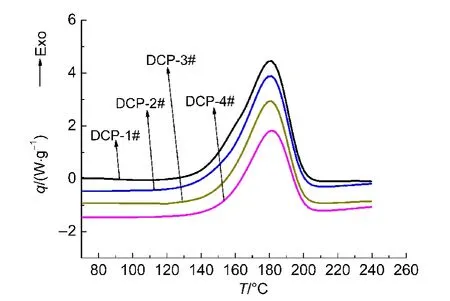
图5 DCP二段测试比放热速率曲线Fig.5 Curves of exothermic rate for second tests of DCP
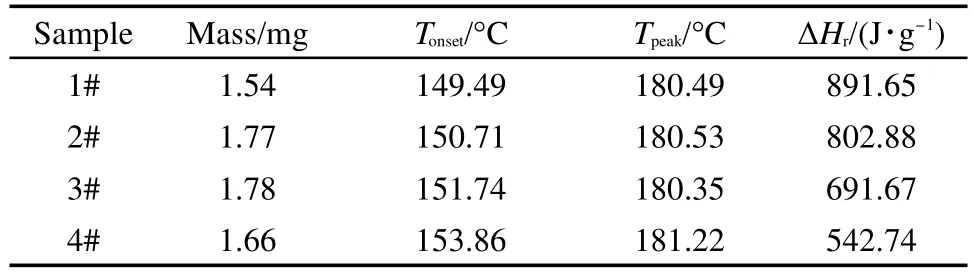
表3 DCP 4次DSC测试条件及测试结果Table 3 Conditions and results of four DSC tests for DCP
CHP是重要的化工中间体,主要用于生产苯酚和丙酮.作为一种自反应性物质,其储存和运输过程的热稳定性以及分解机理一直受到国内学者的广泛关注.3,24-28该物质在100°C以下较为稳定,但超过100°C就会缓慢分解.CHP分解具有明显的自催化特性,Li、24Miyake25以及Hou27等均用等温法对其自催化分解特性进行研究.
Duh等28的研究表明,50%、65%以及80%的CHP在DSC测试过程中放热特性有所不同:浓度越低,起始分解温度越高.但是当不同样品中CHP含量相同时,不同浓度的CHP总放热量一致.这说明溶剂的存在不会对CHP的放热机理产生较大影响,仅仅增加了样品的热惰性.因此在本文的研究角度,质量分数为70%与纯度更高的CHP相比仅仅在峰形以及起始分解温度略有不同,对本文的实验结果及结论影响不大.
与上述三种物质一致,4次实验编号为CHP-1#-CHP-4#.其中CHP-1#由25°C直接升温至240 °C;CHP-2#-CHP-4#中断温度为150、160以及170°C.4次实验的结果见图6以及表4.
根据图6可以看出,CHP-2#-CHP-4#的峰形较CHP-1#变化明显,特别是CHP-4#,在二段测试过程出现连续的双峰(CHP-3#便有出现双峰的趋势),可以判定该物质的分解并不是一步完成,很可能是多步分解.根据表4所得到的数据,4次实验的起始分解温度以及峰温差别较大,CHP-2#-CHP-4#的起始分解温度以及峰温较1#有所降低(4#取第一个峰);且随着中断温度的延后,物质分解越多,二段测试的起始分解温度以及峰温越低,其中CHP-4#的起始分解温度以及峰温较CHP-1#分别提前36.89、32.12°C.
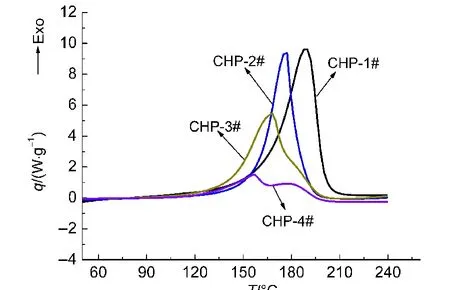
图6 CHP二段测试的比放热速率曲线Fig.6 Curves of exothermic rate for second tests of CHP
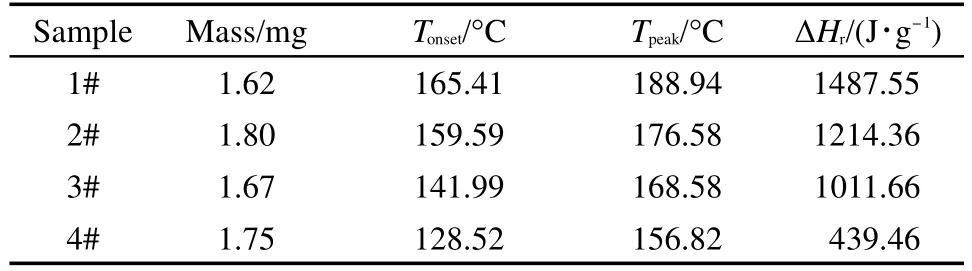
表4 CHP的4次DSC测试条件及测试结果Table 4 Conditions and results of four DSC tests for CHP
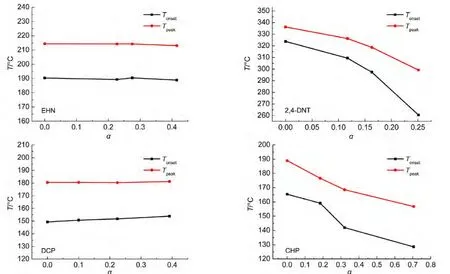
图7 4种样品的Tpeak、Tonset随一段测试转化率(α)的变化Fig.7 Changes of Tpeakand Tonsetof four samples with conversions(α)of first tests
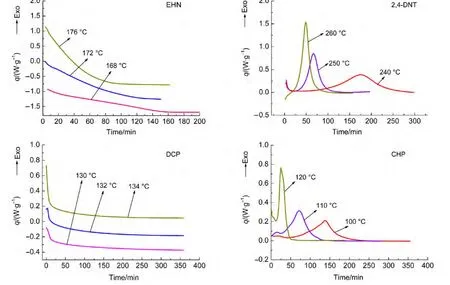
图8 4种样品的等温DSC曲线Fig.8 Curves of isothermal DSC for four samples
3.5 4种样品分解特性比较
根据所得实验结果,每种样品的4次测试结果放热量均有不同,这是由中断温度的不同,即一段测试对应的转化率(α)不同导致的.若不考虑仪器误差以及基线选取误差,可以得到每种样品的起始分解温度以及峰温随α的变化规律,如图7所示.其中1#的一段测试转化率记为0.
根据图7可以看出,对于EHN以及DCP,α的数值对Tonset以及Tpeak影响都很小,即样品分解的程度并不会影响其剩余样品的分解特性,这与2.3节中n级规律相符;对于2,4-DNT以及CHP,一段测试的转化率对二段测试的Tpeak、Tonset影响非常明显,这与自催化分解理论相吻合:α对应着B的浓度大小,α越大,cB越大,Tonset以及Tpeak都越低.因此判定:EHN以及DCP的分解符合n级动力学,2,4-DNT以及CHP的分解具有自催化特性.
4 等温实验验证
在进行动态升温实验后,对4种样品同样进行了等温实验,每种样品均在三个温度下进行等温测试.对于EHN和DCP,为了减少DSC测试初期热流波动的影响,在计算其比放热量时是从1 min以后进行积分.4种样品的等温实验条件及结果列于图8以及表5.
由图8发现,EHN和DCP的等温DSC曲线均符合图1中n级反应规律,比放热速率由高到低逐渐下降;根据表5提供的比放热量,这两种物质的等温DSC的比放热量均与动态DSC(1#)的比放热量差距不大,可以说明EHN、DCP在等温实验中的分解机理与动态实验中一致.等温实验结束后将样品重新以10°C·min-1的速率由25°C升温至300°C(DCP为240°C),结果没有发现放热峰,这进一步证明了等温实验后EHN以及DCP已完全分解.
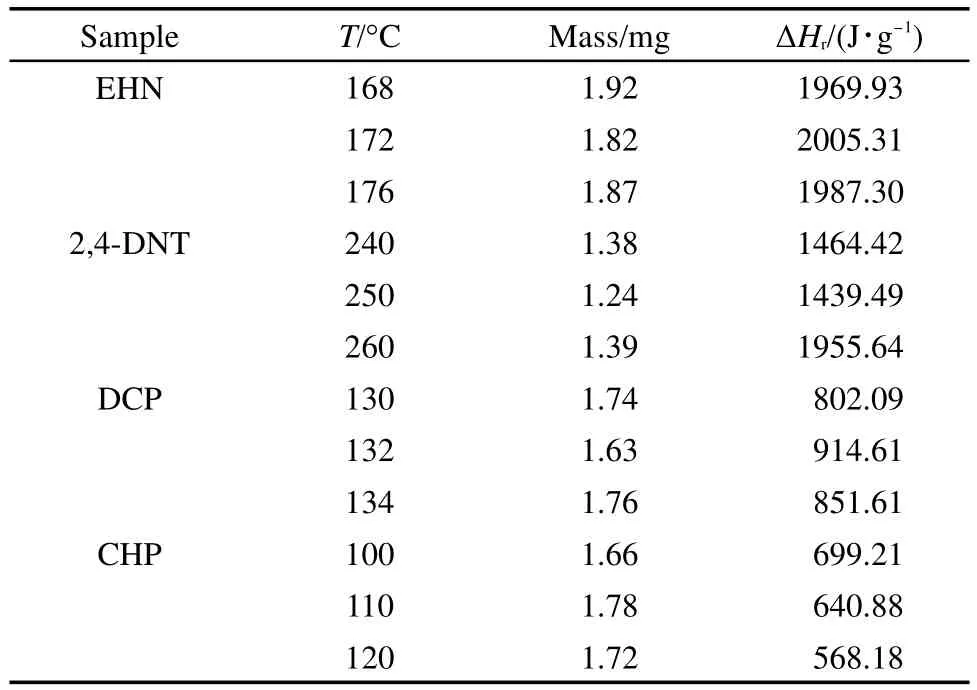
表5 4种样品等温DSC测试条件及测试结果Table 5 Conditions and results of isothermal DSC tests for four samples
而对于2,4-DNT及CHP,其等温实验均出现明显的峰形,符合自催化分解反应规律.对等温实验结束后的样品进行动态实验,发现2,4-DNT在350°C附近出现一放热峰,等温实验可能将两个连续的放热峰分开,而这里所用的测试条件无法判断第二个放热峰的反应类型;CHP等温结束后样品的动态DSC曲线没有明显峰形,说明CHP在等温条件下已完全分解.
根据等温实验的测试结果,EHN、DCP分解符合n级规律,2,4-DNT以及CHP的分解符合自催化规律,这与中断回扫法所得结论具有良好的一致性,说明该方法实用性较好.
5 结论
基于n级、自催化分解机理以及Roduit所提出的理论模拟结果,利用中断回扫法和等温法对4种样品(EHN、2,4-DNT、DCP以及CHP)的分解特性进行测试与分析,得出以下三个结论:
(1)利用中断回扫法证明EHN、DCP的分解符合n级分解动力学,2,4-DNT以及CHP的分解符合自催化分解规律,这与等温法所得结论一致;
(2)2,4-DNT与CHP的分解符合自催化规律,部分物质分解会明显影响其稳定性,特别是CHP,其分解温度较低,在储存以及运输过程要注意其自催化分解特性所带来的危害.2,4-DNT分解25%,起始分解温度会提前63°C.
(3)根据4种样品的测试结果,证明了采用中断回扫法判定物质在中断温度附近是否具有自催化特性,其结果准确,方法简单可行,相对于等温法大大减少了实验时间.
(1)Long,G.T.;Brems,B.A.;Wight,C.A.Thermochim.Acta 2002,388(1),175.
(2) Batten,J.J.Int.J.Chem.Kinet.1985,17(10),1085.doi:10.1002/kin.550171005
(3) Li,X.R.;Koseki,H.Thermochim.Acta 2005,431(1),113.
(4) Stoessel,F.Thermal Safety of Chemical Process:Risk Assessment and Process Design;Science Press:Beijing,2009;pp 56,271-287;translated by Chen,W.H.,Peng,J.H.,Chen,L.P.[Stoessel,F.化工工艺热安全:风险评估与工艺设计.陈网桦,彭金华,陈利平,译.北京:科学出版社,2009:56,271-287.]
(5) Dien,J.M.;Fierz,H.;Stoessel,F.;Killé,G.Chima 1994,48(12),542.
(6) Gao,H.S.;Chen,L.P.;Chen,W.H.;Bao,S.L.Thermochim.Acta 2013,569,134.doi:10.1016/j.tca.2013.07.017
(7) Grewer,T.Thermochim.Acta 1993,225(2),165.doi:10.1016/0040-6031(93)80185-D
(8) Chervina,S.;Bodman,G.T.Process Saf.Prog.1997,16(2),94.doi:10.1002/prs.680160211
(9) Bao,S.L.;Chen,W.H.;Chen,L.P.;Gao,H.S.;Lu,J.Y.Acta Phys.-Chim.Sin.2013,29(3),479.[鲍士龙,陈网桦,陈利平,高海素,吕家育.物理化学学报,2013,29(3),479.]doi:10.3866/PKU.WHXB201212141
(10) Bou-Diab,L.;Fierz,H.J.Hazard.Mater.2002,93(1),137.doi:10.1016/S0304-3894(02)00044-4
(11) Roduit,B.;Hartmanna,M.;Follyb,P.;Sarbach,A.Chem.Eng.Tran.2013,31.
(12) Luo,J.J.;Wu,F.G.;Yu,J.S.;Rui,W.;Yu,Z.W.J.Phys.Chem.B 2011,115(28),8901.doi:10.1021/jp200296v
(13) Chervin,S.;Bodman,G.T.Thermochim.Acta 2002,392,371.
(14) Fu,X.C.;Shen,W.X.;Yao,T.Y.;Hou,W.H.Physical Chemistry,5th ed.;Higher Education Press:Beijing,2005;pp 156-172.[傅献彩,沈文霞,姚天扬,侯文华.物理化学(第五版).北京:高等教育出版社,2005:156-172.]
(15) Suppes,G.J.;Rui,Y.;Rome,A.C.;Chen,Z.Ind.Eng.Chem.Res.1997,36(10),4397.doi:10.1021/ie9702284
(16) Oxley,J.C.;Smith,J.L.;Rogers,E.;Ye,W.Energy Fuels 2001,15(5),1194.doi:10.1021/ef010031v
(17) Bornemann,H.;Scheidt,F.;Sander,W.Int.J.Chem.Kinet.2002,34(1),34.doi:10.1002/kin.10017
(18) Zeng,X.L.;Chen,W.H.;Wang,F.W.Chin.Saf.Sci.J.2009,19(8),67.[曾秀琳,陈网桦,王凤武.中国安全科学学报,2009,19(8),67.]
(19) Liu,T.T.A Preliminary Study of Thermal Hazard of Synthesis Process for 2-Ethylhexyl Nitrate by Nitration of Iso-Octanol.Master.Dissertation,Nanjing University of Science and Technology,Nanjing,2010.[刘婷婷.异辛醇硝化制备硝酸异辛酯合成工艺热危险性的初步研究[D].南京:南京理工大学,2010.]
(20) Chen,L.P.;Liu,T.T.;Yang,Q.;Chen,W.H.J.Loss.Prev.Process.Ind.2012,25(3),631.
(21) Somma,I.D.;Marotta,R.;Andreozzi,R.;Caprio,V.J.Hazard.Mater.2011,187(1),157.
(22) Lv,J.Y.;Chen,L.P.;Chen,W.H.;Gao,H.S.;Peng,M.J.Thermochim.Acta 2013,571,60.doi:10.1016/j.tca.2013.08.029
(23) Talouba,I.B.;Balland,L.;Mouhab,N.;Abdelghani-Idrissi,M.A.J.Loss.Prev.Process Ind.2011,24(4),391.doi:10.1016/j.jlp.2011.02.001
(24) Li,X.R.;Koseki,H.J.Loss.Prev.Process Ind.2005,18(4),460.
(25)Miyake,A.;Sumino,M.;Oka,Y.;Ogawa,T.;Lizuka,Y.Thermochim.Acta 2000,352,181.
(26) Jin,M.P.;Sun,F.;Shi,N.;Xie,C.X.CIESC Journal 2012,63(12),4096.[金满平,孙 峰,石 宁,谢传欣.化工学报,2012,63(12),4096.]
(27) Hou,H.Y.;Shu,C.M.;Duh,Y.S.AIChE Journal 2001,47(8),1893.doi:10.1002/aic.690470819
(28)Duh,Y.S.;Kao,C.S.;Hwang,H.H.;Lee,W.W.L.Process Saf.Environ.Protect.1998,76(4),271.doi:10.1205/095758298529623
