无种子法纳米金棒的制备及其对肿瘤细胞光热治疗效应研究
2014-09-21王新环韩秋森李婧影刁国旺
王新环 韩秋森 李婧影 杨 蓉,* 刁国旺 王 琛,*
(1扬州大学化学化工学院,江苏扬州225002;2国家纳米科学中心,纳米生物效应与安全性重点实验室,北京100190)
1 引言
金纳米颗粒因其特殊的光电性质而被广泛应用于光电子学、生物标记、医学检测以及表面增强拉曼散射等领域.1近几年来,在金纳米材料的合成方面已取得很快的进展,人们已制备出多种形貌的金纳米颗粒.2-4相比其它金纳米材料,金纳米棒具独特且可调的表面等离子共振特性,在生物医学应用方面显示出更为优越的潜能.到目前为止,金纳米棒的合成方法主要有模板法、光化学法、电化学法、晶种生长法.5-9由于前三种方法设备要求高、操作复杂、产量低,产量高的晶种生长法是目前金纳米棒制备最常用的方法.但晶种法制备金纳米棒时需要小于3 nm的金种子,加大了制备难度且耗时较长.在晶种法合成金棒的过程中,金种的浓度和大小对金棒的形状和长度有很大的影响.10-12无种子法则是在抗坏血酸弱还原剂的还原作用下,直接加入微量的NaBH4,一步法快速制备金纳米棒,更为直接、方便.
若将纳米金棒应用于生物医学领域,还需要对其表面进行修饰.制备金纳米棒的过程需要用到高浓度的十六烷基三甲基溴化铵(CTAB)分子,这会对细胞和生物体产生很高的毒性,13而且金纳米棒表面吸附的CTAB双分子层也影响金纳米棒与生物分子的偶联,14从而限制了金棒在生物医学领域的应用,所以在纳米金棒表面进行修饰以消除CTAB的影响是至关重要的.13,15-17
随着环境质量的下降,恶性肿瘤的发病率越来越高.18,19热疗18,20-22是利用物理能量在肿瘤处组织中聚集产生热效应,使肿瘤处的组织温度上升到有效的治疗温度(40-44°C),使得肿瘤细胞的生长受阻与死亡的治疗方法.生物组织和体液在700-900 nm的近红外区域的光吸收和散射最少,光透过性的几率很大,因而在近红外区有吸收又能产热的纳米粒子被应用到肿瘤热疗实验中.越来越多的具有独特光学性质的纳米材料,8,23-25如纳米粒、26-28纳米管、29纳米球壳、30纳米笼31-32以及纳米棒33-34等被应用到肿瘤治疗的研究中.纳米金棒在近红外区有很强的吸收,且共振吸收峰位可调,在肿瘤热疗方面显示出潜在的应用前景.本文采用无种子法,以抗坏血酸(AA)和硼氢化钠(NaBH4)为还原剂,CTAB为表面活性剂,在AgNO3稳定剂下还原HAuCl4·3H2O,制备出纳米金棒,并通过调节反应物的含量研究了反应物对金棒近红外吸收峰位移的调控.我们用巯基聚乙二醇(PEG-SH)对纳米金棒表面的CTAB分子进行了置换,细胞实验验证了修饰后的纳米金棒的生物相容性明显提高.利用纳米金棒在近红外光照射下发热,研究其对肿瘤细胞的热疗效应.金棒的浓度和热疗时间都对光热治疗效果有一定的影响.
2 实验部分
2.1 纳米金棒的制备与表面修饰
实验试剂和仪器:氯金酸(HAuCl4·3H2O,99.9%、十六烷基三甲基溴化铵(98%及抗坏血酸(AA,98%),Alfa Aesar,美国;硝酸银(AgNO3,分析纯)、硼氢化钠(NaBH4,分析纯),国药集团化学试剂有限公司;巯基十一烷酸(MUDA,95%,百灵威试剂有限公司);巯基聚乙二醇(MW=5000,95%,北京键凯科技有限公司);台式高速离心机(TG20M,长沙平凡仪器仪表有限公司);恒温磁力搅拌器(RCT,IKa,德国).实验中所有化学试剂均为分析纯.
采用无种子法一步制备金纳米棒,具体操作如下:温度28-30 °C,取5 mL 0.2 mol·L-1的CTAB 加入到5 mL 1 mmol·L-1的HAuCl4·3H2O的水溶液中,搅拌中逐步加入300 μL 4 mmol·L-1AgNO3,用盐酸调控溶液的pH值,然后加入70 μL 78.8 mmol·L-1的AA,溶液逐渐变为无色,停止搅拌;加入15 μL 0.01 mol·L-1的NaBH4,将溶液静置.通过调控反应中的AgNO3、盐酸和NaBH4的量来调控纳米金棒的尺寸和在近红外处的吸收峰位置.反应完成后离心去掉游离的CTAB,用水清洗3次,分散在水中.取1 mL金棒,加入100 μL酒精溶解的20 mmol·L-1的巯基十一烷酸,超声2 h,离心去掉未反应掉的巯基十一烷酸,重新分散在水中,得到羧基化聚乙二醇修饰的金棒;若要得到聚乙二醇修饰的金棒,则在反应完成后离心去掉游离的CTAB的纳米金棒溶液中加入200 μL 1 mmol·L-1的PEG-SH,摇床中反应 24 h,离心后分散在水中.
2.2 纳米金棒的表征
样品的光学性质通过紫外-可见-近红外吸收光谱仪检测(Lambda 950,美国Perkin Elmer Instruments).用透射电子显微镜(TEM,Tecnai G2 20 STWIN,美国FEI公司)和场发射扫描显微镜(FESEM,Hitachi S-4800,日本日立公司)观察制备的金纳米棒的形貌和尺寸.用电感耦合等离子光谱仪(ICP,iCAP Qc,美国Thermo Scientific)测定金元素的浓度.
2.3 A549细胞的培养及光热治疗实验
将肺小细胞肺癌细胞(A549)置于37°C含5%CO2的饱和湿度的培养箱内,用亚甲基双丙烯酰胺(DMEM)高糖细胞培养液培养,以0.25%的胰蛋白酶-乙二胺四乙酸钠(EDTA)消化液消化细胞进行传代培养.按照细胞数将细胞配成一定浓度,在96孔培养板中每孔加100 μL溶液,使细胞数为8000/孔,置培养箱中24 h,分别加入不同浓度的CTAB-Au、MUDA-Au和聚乙二醇-金(PEG-Au),每个浓度设置3个复孔,阴性对照为加入细胞培养液,每组设3个复孔.在培养箱中培养48 h,每孔加入10 μL 5 mg·mL-1的噻唑蓝(MTT),培养4 h后,吸出培养板中的液体,加入150 μL的二甲基亚砜(DMSO),在酶标仪上测定490 nm处的光密度(OD),然后进行数据处理.
按照上述方法同样在96孔培养板中每孔加100 μL溶液,使细胞数为8000/孔,置培养箱中12 h,分别加入不同浓度的PEG-Au,每个浓度设置3个复孔,阴性对照为加入细胞培养液.近红外光(700-1100 nm)的光照时间分别为0、10、15、20 min,光照完成后继续孵育24 h,检测细胞存活率.热疗对细胞的影响则用多功能酶标仪(Tecnai infinite M200,TECAN)进行检测.在热疗结束24 h后用50 μg·mL-1的染料吖啶橙(AO)染细胞后用Leica显微镜进行细胞数量和形貌的观察.
3 结果与讨论
3.1 金纳米棒的形貌与近红外区吸收的调控
3.1.1 金纳米棒的形貌及吸收光谱
图1为无种子法制备的纳米金棒的形貌和吸收光谱.图1A为场发射扫描电镜(FESEM)图片,从大范围上看,金棒的分散性较好,且尺寸均匀.从TEM图可看出产品形状为棒状,表面光滑,形貌均一,分散性较好.图1B是纳米金棒的可见-近红外吸收光谱图.可以看到样品在530 nm处出现一个小的吸收峰,在900 nm左右产生一个强的吸收峰,处于近红外区,在近红外区有很强的吸收.
3.1.2 硝酸银、盐酸和硼氢化钠浓度对纳米金棒吸收峰的影响
通过改变实验条件,可以调控纳米金棒的红外共振吸收峰位置.图2(A,D)为AgNO3的浓度对纳米金棒的影响.因为AgNO3倾向于沉积在金棒的(110)晶面,抑制了金离子的沉积,导致金的(100)晶面生长,生成金棒.14从图2A中可以看出,随着Ag+浓度的增加,纵向等离子共振吸收峰的最大吸收波长逐渐增加,金纳米棒的长度逐渐增加,因金纳米棒的直径变化可以忽略,所以金纳米棒的长径比逐渐增加.在此同时,可以看到随着Ag+浓度的增加,溶液的颜色逐渐变浅.实验发现,如果无Ag+只能得到金纳米颗粒.这是因为Ag+的单分子层与金棒的(110)晶面有很强的结合能,使得更多的金离子沉积在(100)晶面上,导致长径比的增加.14
图2(B,E)为盐酸浓度对纳米金棒的影响.从图2B可以看出,随着盐酸的逐渐加入,纵向等离子共振吸收峰的最大吸收波长逐渐从800 nm左右蓝移至700 nm左右,表明金纳米棒的长度逐渐减少.从图2E可见,随着盐酸的加入,溶液颜色逐渐变深,与金纳米棒的长径比减小相一致.盐酸抑制了抗坏血酸的还原能力,增加了还原时间,导致还原后Au+更均匀地分布在金棒的(100)及(110)晶面上,使得长径比降低.
图2(C,F)为NaBH4浓度对纳米金棒的影响.相比种子法制备金纳米棒,无种子法制备纳米金棒的优势在于在形成金棒的溶液中直接加入微量的NaBH4,将Au+继续还原为Au0,并在其它分子的共同作用下形成纳米金棒.从图2C可以看出,随着NaBH4的逐渐加入,横向等离子共振吸收峰略微减小,但纵向等离子共振吸收峰的最大吸收波长逐渐从700 nm左右红移至850 nm左右.从图2F可看到,随着NaBH4的量加入的越多,溶液颜色越红,同样表明纳米金棒的纵向等离子共振吸收峰逐渐红移,红颜色变亮.NaBH4取代了种子法制备纳米金棒时金种子的作用将Au+直接还原成Au0,浓度越大,还原能力越强,加快了纳米金棒成核和生长的过程.
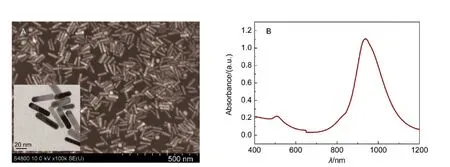
图1 (A)纳米金棒的FESEM及TEM(插图)图;(B)纳米金棒可见-近红外吸收光谱图Fig.1 (A)Field emission scanning electron microscopy(FESEM)and transmission electron microscope(TEM)(inset)images of Au nanorods;(B)visible and near infrared(Vis-NIR)absorption spectrum of Au nanorods
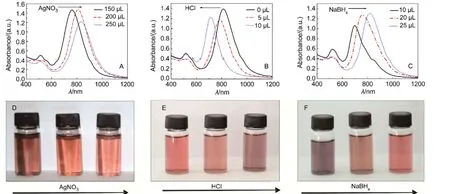
图2 AgNO3(A,D)盐酸(B,E)和硼氢化钠(C,F)的加入量对金棒的可见-红外吸收峰位置的影响及溶液颜色变化图Fig.2 (A)Vis-NIR spectra and color changes ofAu nanorods obtained at different amount ofAgNO3(A,D),HCl(B,E),and NaBH4(C,F)
3.2 纳米金棒的表面修饰
3.2.1 修饰MUDA和PEG-SH前后变化表征
图3A是不同表面修饰的纳米金棒溶液的可见-近红外吸收光谱图.从图中我们可以看到,在修饰前CTAB稳定的纳米金棒在790 nm左右,经PEGSH修饰的金棒的最强吸收波长基本在795 nm左右,峰型变窄,说明金棒的粒径趋向于统一.图3A中的TEM是刚合成的表面带CTAB的纳米金棒.图3B是纳米金棒的红外光谱.我们可以看到在修饰完MUDA后,出现―COOH在1709 cm-1的特征吸收峰,说明MUDA成功修饰在金棒表面.PEG修饰的金棒出现了C―O键的特征吸收峰(1101 cm-1),说明PEG也被成功地修饰在金棒表面.图3(C,D)分别是MUDA分子和PEG修饰的纳米金棒的TEM图.很显然,经过PEG修饰后的金棒的分散性明显提升.Li等35利用巯基聚酰胺-胺树枝状聚合物(PAMAM)通过形成Au―S键取代金棒上的CTAB,并利用PAMAM分子量和尺寸大小通过热重变化和原子力显微镜)的粒子尺寸确认CTAB被取代.在本工作中,我们利用PEG-SH通过Au―S键对纳米金棒表面的CTAB分子进行了置换.可见-近红外吸收光谱也表明PEG被成功地修饰在金棒表面.
3.2.2 不同分子修饰的纳米金棒的细胞生物相容性
本文研究了不同分子修饰的纳米金棒对肺癌(A549)细胞生长的影响.从图4可以看到,随着纳米金棒浓度的增加,不同分子修饰的金棒对细胞的生长有一定的影响.在金棒的浓度低于2.4 mg·L-1时,在三种分子修饰情况下,细胞的存活率仍在80%以上,但修饰了PEG的纳米金棒对细胞的影响最小,存活的细胞最多.当金棒浓度继续增大时,MUDA分子和PEG修饰的纳米金棒对细胞的毒性增大,而和修饰了PEG的纳米金棒共孵育的A549细胞的存活率仍很高.实验结果显示,PEG修饰的纳米金棒有很好的细胞生物相容性.
3.3 纳米金棒对肿瘤细胞A549的热疗效应
从模拟细胞实验的温度变化图上我们可以看出,溶液的温度随着金棒浓度的增加和照射时间的延长而逐渐升高.在金棒浓度为6 mg·L-1,照射时间为15 min时,温度已经升高了13°C.照射时间延长至20 min时,温度升高17°C,达到杀死肿瘤细胞所需要的温度.
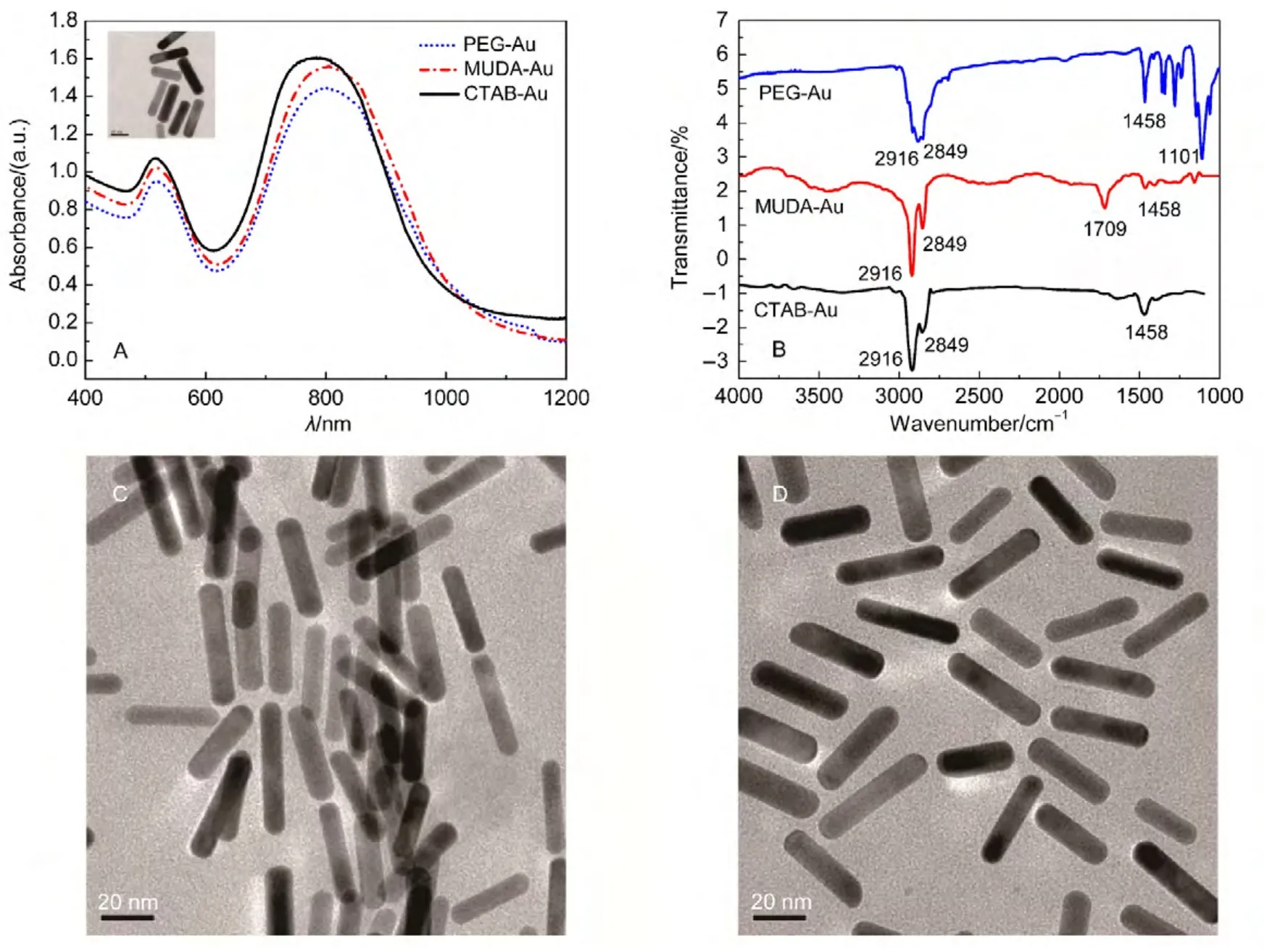
图3 表面修饰纳米金棒的(A)可见-近红外吸收光谱和(B)傅里叶红外光谱;(C,D)分别为修饰巯基十一烷酸和聚乙二醇的金棒的TEM图Fig.3 (A)Vis-NIR spectra and(B)Fourier transform infrared spectroscopy(FTIR)of surface functionalizedAu nanorods;(C,D)TEM images of MUDA-Au and PEG-Au nanorods,respectively
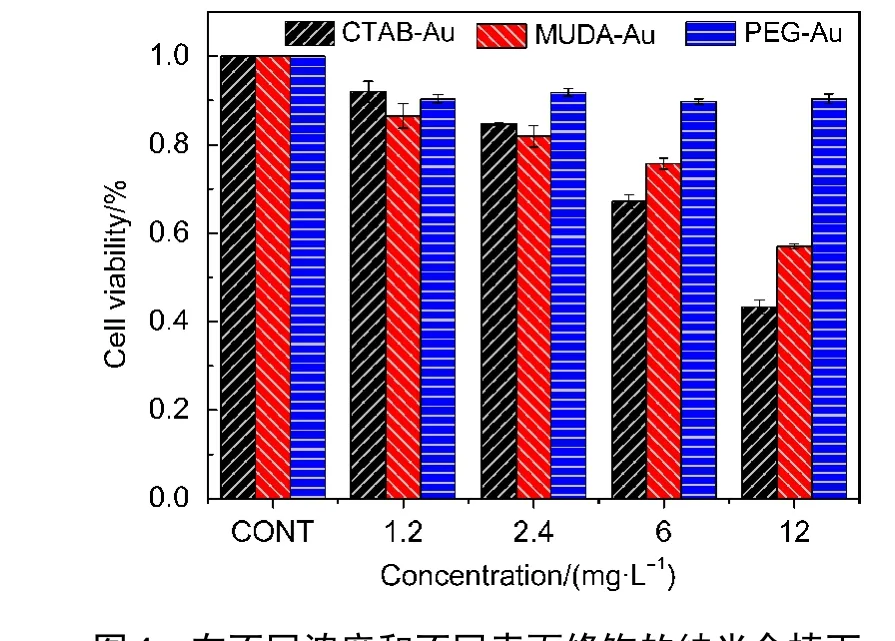
图4 在不同浓度和不同表面修饰的纳米金棒下A549细胞存活率Fig.4 A549 cell viability with different concentrations and different surface-functionalizedAu nanorods
因生物体的组织及体液对近红外区的光吸收最少,近红外区能透过皮肤进入组织内部.而纳米金棒在近红外区有很强的吸收,吸收光能的金棒能发热.如果能把金棒输送到肿瘤部位,再用近红外区的光进行激发使在肿瘤内的纳米金棒发热,就有可能使肿瘤细胞产生损伤甚至死亡,进而达到治疗目的.本文用PEG-SH修饰的纳米金棒和肿瘤细胞A549共孵育,然后用近红外光照射,观察不同照射时间及不同金棒浓度对肿瘤细胞的杀伤效果.图5A是热疗后细胞的荧光图.当金棒的浓度为2 mg·L-1时,随着热疗时间的增加,肿瘤细胞的数量有少许下降,但影响不大,没有显现出大的热疗效果.金棒浓度继续增大到4 mg·L-1,照射时间为15 min时,细胞的数量已经减少,照射20 min时细胞存活的数量已经很少,说明热疗已经起到明显的作用.6 mg·L-1的金棒在热疗20 min时肿瘤细胞的存活数量已经屈指可数,说明在所用的几个金棒浓度中,6 mg·L-1的治疗效果最明显.
图5C是对应的MTT结果.从柱状图来看,黑色表示无纳米金棒的细胞对照组.随着近红外光照射时间的增加,肿瘤细胞的存活率逐渐下降,但照射20 min时存活率依然很高,表明不加入金棒时,单纯的光照对细胞生长的影响不大.但当加入金棒后,不同的金棒浓度在光照下对细胞的存活都有一定的影响.当金棒的浓度增大到4 mg·L-1时,在15 min近红外光照射后,肿瘤细胞的存活率在70%以上,但当热疗时间为20 min时,肿瘤细胞的存活率急剧下降到20%左右,达到治疗的目的.继续增大金棒的浓度至6 mg·L-1时,光照20 min时细胞存活率急剧下降到20%以下.实验结果表明单纯的光照或金棒对肿瘤细胞的杀伤效果均不明显,但在加入金棒达到一定浓度(6 mg·L-1)时,热疗时间增大到20 min,能使肿瘤细胞几乎完全失去活性.
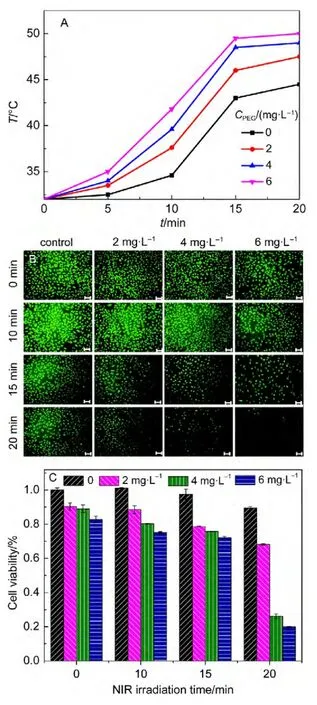
图5 A549细胞在不同红外光照时间和不同浓度PEG-SH(CPEG)修饰的纳米金棒在光照下的升温曲线(A),热疗效果的荧光图(标尺为75 μm)(B)及MTT结果(C)Fig.5 Temperature curves(A),fluorescence images(scale bar is 75 μm)of hyperthermia effect(B),and 3-(4,5-dimethyl-2-thiazoly)-2,5-diphenyl-2-H-tetrazo-lium bromide(MTT)results(C)of A549 cells at different NIR irradiation time with different concentrations(CPEG)of PEG-SH modified gold nanorods
4 结论
采用简便快捷的无种子法成功制备了形貌均一的纳米金棒.通过改变反应物的浓度,研究了各反应物对金棒近红外区的吸收峰的影响,如改变AgNO3和NaBH4在反应中加入的浓度,可以调节纳米金棒的纵向等离子共振峰的位移.通过Au―S键将巯基聚乙二醇修饰在金棒表面,大大提高了纳米金棒的细胞生物相容性.研究了在近红外光照射下金棒对肿瘤细胞(A549)的光热治疗效应,确定了最佳金棒浓度和热疗时间.实验结果表明单纯的光照或金棒对肿瘤细胞的杀伤效果均不明显,但在加入金棒达到一定浓度,热疗时间增大到一定长度时能有很好的抑制肿瘤细胞活性的效果.我们的结果显示纳米金棒用于抗肿瘤治疗有着潜在的应用前景.
(1) Dubertret,B.;Calame,M.;Libchaber,A.J.Nat.Biotechnol.2001,19,365.doi:10.1038/86762
(2) Zhu,J.;Shen,Y.;Xie,A.;Qiu,L.;Zhang,Q.;Zhang,S.J.Phys.Chem.C 2007,111,7629.doi:10.1021/jp0711850
(3) Chen,J.;Saeki,F.;Wiley,B.J.;Cang,H.;Cobb,M.J.;Li,Z.Y.;Au,L.;Zhang,H.;Kimmey,M.B.;Li;Xia,Y.Nano Lett.2005,5,473-477.doi:10.1021/nl047950t
(4) Grabar,K.C.;Allison,K.J.;Baker,B.E.;Bright,R.M.;Brown,K.R.;Freeman,R.G.;Fox,A.P.;Keating,C.D.;Musick,M.D.;Natan,M.J.Colloids Surf.A 1996,12,2353.doi:10.1021/la950561h
(5) Pérez-Juste,J.;Pastoriza-Santos,I.;Liz-Marzán,L.M.;Mulvaney,P.Coord.Chem.Rev.2005,249,1870.doi:10.1016/j.ccr.2005.01.030
(6) Sharma,V.;Park,K.;Srinivasarao,M.Mater.Sci.Eng.R 2009,65,1.doi:10.1016/j.mser.2009.02.002
(7) Daniel,M.C.;Astruc,D.Chem.Rev.2003,104,293.
(8)Ali,M.R.;Snyder,B.;El-Sayed,M.A.Langmuir 2012,28,9807.doi:10.1021/la301387p
(9) Van der Zande,B.M.I.;Böhmer,M.R.;Fokkink,L.G.J.;Schönenberger,C.Langmuir 1999,16,451.
(10) Hough,C.D.;Sherman-Baust,C.A.;Pizer,E.S.;Montz,F.J.;Im,D.D.;Rosenshein,N.B.;Cho,K.R.;Riggins,G.J.;Morin,P.J.Cancer Res.2000,60,6281.
(11) Wang,Z.;Su,Y.K.;Li,H.L.Appl.Phys.A 2002,74,563.
(12) Shao,G.N.;Zhang,X.T.;Liu,B.Modern Chemical Industry 2006,26,44.[邵桂妮,张兴堂,刘 兵.现代化工,2006,26,44.]
(13) Connor,E.E.;Mwamuka,J.;Gole,A.;Murphy,C.J.;Wyatt,M.D.Small 2005,1,325.
(14) Nikoobakht,B.;El-Sayed,M.A.J.Phys.Chem.A 2003,107,3372.
(15) Jana,N.R.;Gearheart,L.;Murphy,C.J.Chem.Mater.2001,13,2313.doi:10.1021/cm000662n
(16) Murphy,C.J.;Jana,N.R.Adv.Mater.2002,14,80.
(17) Jana,N.R.Small 2005,1,875.
(18) Thakor,A.S.;Gambhir,S.S.CA-Cancer J.Clin.2013,63,395.doi:10.3322/caac.21199
(19) Wang,M.F.;Li,X.M.The Practical Journal of Cancer 2006,4,445.[王梅芳,李小妹.实用癌症杂志,2006,4,445.]
(20) Svaasand,L.;Gomer,C.;Morinelli,E.Laser Med.Sci.1990,5,121.
(21) Lu,H.;Chen,L.B.Journal of Medical Postgraduat.2004,17,458.[鹿 红,陈龙帮.医学研究生学报,2004,17,458.]
(22) Liu,B.R.;Qian,X.P.Foreign Medical Sciences(Cancer Section)2004,31,34 [刘宝瑞,钱晓萍.国外医学(肿瘤学分册),2004,31,34.]
(23) Sharma,P.;Brown,S.;Walter,G.;Santra,S.;Moudgil,B.Adv.Colloid Interface Sci.2006,123,471.
(24) El-Sayed,M.A.Accounts Chem.Res.2001,34,257.doi:10.1021/ar960016n
(25) Katz,E.;Willner,I.Angew.Chem.Int.Edit.2004,43,6042.
(26) El-Sayed,I.H.;Huang,X.;El-Sayed,M.A.Cancer Lett.2006,239,129.doi:10.1016/j.canlet.2005.07.035
(27) Zharov,V.P.;Galitovsky,V.;Viegas,M.Appl.Phys.Lett.2003,83,4897.
(28) Pitsillides,C.M.;Joe,E.K.;Wei,X.;Anderson,R.R.;Lin,C.P.Biophys.J.2003,84,4023.doi:10.1016/S0006-3495(03)75128-5
(29)Kam,N.W.S.;O'Connell,M.;Wisdom,J.A.;Dai,H.Proc.Natl.Acad.Sci.U.S.A.2005,102,11600.doi:10.1073/pnas.0502680102
(30) O'Neal,D.P.;Hirsch,L.R.;Halas,N.J.;Payne,J.D.;West,J.L.Cancer Lett.2004,209,171.doi:10.1016/j.canlet.2004.02.004
(31) Chen,J.;Wiley,B.;Li,Z.Y.;Campbell,D.;Saeki,F.;Cang,H.;Au,L.;Lee,J.;Li,X.;Xia,Y.Adv.Mater.2005,17,2255.
(32) Hu,M.;Petrova,H.;Chen,J.;McLellan,J.M.;Siekkinen,A.R.;Marquez,M.;Li,X.;Xia,Y.;Hartland,G.V.J.Phys.Chem.B 2006,110,1520.doi:10.1021/jp0571628
(33) Huang,X.;El-Sayed,I.H.;Qian,W.;El-Sayed,M.A.J.Am.Chem.Soc.2006,128,2115.doi:10.1021/ja057254a
(34) Takahashi,H.;Niidome,T.;Nariai,A.;Niidome,Y.;Yamada,S.Chem.Lett.2006,35,500.doi:10.1246/cl.2006.500
(35) Li,Z.M.;Huang,P.;Zhang,X.J.;Lin,J.;Yang,S.;Liu,B.;Gao,F.;Xi,P.;Ren,Q.S.;Cui,D.X.Mol.Pharm.2010,7,94.
