Survivin蛋白在卵巢癌组织中的表达及临床意义
2014-09-17刘莉霞李术平何秀萍
刘莉霞,李术平,何秀萍
(牡丹江医学院红旗医院妇产科,黑龙江 牡丹江157011)
卵巢癌是妇科常见恶性肿瘤之一,目前在世界范围内其发病率及病死率逐年升高。卵巢癌的发生发展是由于多种基因出现了异常改变,并且这种改变的结果被逐渐累积起来,如原癌基因被异常激活、细胞的促凋亡基因与抗凋亡基因间功能失衡。卵巢癌发生原因的复杂性,卵巢癌术后易复发以及卵巢癌患者对化疗药物不敏感性均可能导致卵巢癌治疗失败,患者病死率高。Survivin是刚被研究发现的一种凋亡抑制蛋白,是现今为止发现的分子质量最小但抗凋亡作用却是最强的蛋白,其具有独特的结构以及调节细胞的有丝分裂和抑制细胞凋亡的功能[1]。Survivin在血管形成以及信号转导通路中起一定作用,Survivin抑制细胞凋亡的功能与恶性肿瘤的发生、发展及化疗耐药密切相关。在多步骤肿瘤发生的早期,各种因素导致的凋亡抑制不仅有利于细胞的继续增殖,还有利于异常基因的进一步积聚,促使细胞恶性转化,从而有助于肿瘤的发生发展。
卵巢癌的发生是一个繁琐的过程,因而探讨凋亡抑制基因在卵巢癌发生发展过程中的表达,及其与卵巢癌化疗耐药间的关系具有重要意义。有关Survivin蛋白在卵巢癌中的表达以及在化疗耐药中作用的研究目前鲜见报道。本实验拟采用组织芯片技术结合免疫组化法检测卵巢癌组织中Survivin蛋白的表达,分析其在卵巢癌发生、发展及化疗耐药中的作用。
1 材料与方法
1.1 实验材料
1.1.1 标本资料
于2010-02~2011-06搜集哈尔滨医科大学附属第一医院妇科手术治疗并有良好随访条件的患者。取正常卵巢20例,良性卵巢组织30例,卵巢癌27例,其中卵巢浆液性囊腺癌20例,卵巢黏液性囊腺癌5例,其它类型2例。按WHO分类标准,包括高分化6例,中低分化21例。根据2000年FIGO分期标准,其中Ⅰ期+Ⅱ期7例,Ⅲ期+Ⅳ期20例。按年龄分类,其中≤50岁的患者10例,>50岁的患者17例。搜集11例绝经前的患者,16例绝经后的患者。无腹水形成的患者18例,有腹水形成的患者9例。
1.1.2 主要试剂
兔抗人Survivin抗体,购于北京博奥森生物技术有限公司。组织芯片由陕西艾莉娜生物科技有限公司制作。
1.2 实验方法
1.2.1 免疫组化方法
(1)将切好的组织芯片置于电热恒温干燥箱中30min。
(2)组织芯片切片常规脱蜡至水,PBS液浸泡5min,蒸馏水冲洗。将切片浸入0.01M枸橼酸盐缓冲液,微波修复15min,凉至室温,3%过氧化氢溶液泡20min,PBS浸泡,滴入正常山羊血清封闭液半小时,加Survivin抗体4℃过夜,滴加标记二抗,放入湿盒,水浴30min,PBS液冲洗3次,DAB显色,镜下观察3~5min,阳性者出现棕黄色颗粒。流水冲洗后苏木复染,脱水,中性树胶封片。
1.2.2 免疫组化阳性结果判定
Survivin蛋白染色主要定位于肿瘤的细胞核,阳性表达为突出于背景的棕黄色或棕褐色颗粒且境界较清晰,随即观察10个高倍视野下的细胞数,每个视野下各计数100个细胞,根据其中阳性细胞出现的比率,可分为以下4级:阳性细胞数<5%为(-);阳性细胞数5%~25%为(±);阳性细胞数25%~50%为(+);阳性细胞数50%~75%为(++);阳性细胞数>75%为+++)。
1.2.3 化疗耐药判断
化疗耐药判断:术后一周内,患者接受正规化疗。每个疗程开始前均行常规检查。依据化疗疗效评定标准[2]:(1)化疗敏感性卵巢癌:在化疗早期就获得完全缓解,并且停药半年以上也未复发;(2)耐药性卵巢癌:早期疗效虽然达到完全缓解 ,但半年内便出现肿块、CA125逐渐升高、肠梗阻的发生、胸水腹水等;(3)持续性卵巢癌:在化疗早期虽有反应,但检查发现残余病灶体积增大25%;(4)难治性卵巢癌:化疗药物对肿瘤无效果。我们将第1项归为化疗敏感,后3项归为化疗耐药,这样实验中患者分为化疗敏感组和化疗耐药组。
1.3 统计学处理
采用统计软件SPSS 17.0软件进行数据统计分析,用卡方检验及Fisher法进行阳性率比较,以P<0.05为差别显著性标准。
2 结果
2.1 组织芯片结果
组织芯片合格的标准为非目标组织点数+组织脱点数≤5%。卵巢癌组织芯片进行切片HE染色,结果显示组织芯整齐排列无脱落。
2.2 免疫组化染色结果
2.2.1 Survivin蛋白在卵巢组织中的表达
图1为Survivin蛋白在卵巢癌组织中的染色结果,Survivin蛋白在正常卵巢组织中不表达,两两比较,差别有统计学意义(P<0.05)。见表1。

表1 Survivin蛋白在卵巢组织中的表达情况
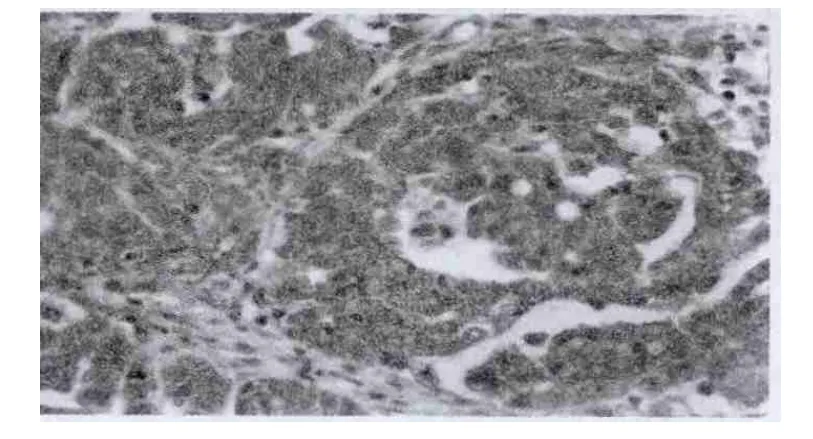
图1 Survivin在卵巢癌中的表达(×400)
2.2.2 Survivin蛋白的表达与卵巢癌临床病理特征的关系
Survivin蛋白在卵巢癌中的阳性表达率随着临床分期的进展而升高(P<0.05);而与卵巢癌的组织类型、病理分级、患者年龄、是否绝经及有无腹水形成无显著相关性(P>0.05)。见表2。

表2 Survivin蛋白表达与卵巢癌临床病理特征的关系
2.2.3 Survivin蛋白与化疗耐药的关系
27例卵巢癌有化疗随访价值的19例,其中10例化疗有效,取得临床缓解,9例耐药。化疗有效组中Survivin蛋白的表达阳性率为50%(5/10),耐药组中Survivin蛋白的表达阳性率为100% (9/9),分析显示耐药组Survivin蛋白的阳性率显著高于有效组(P<0.05)。
3 讨论
组织芯片(tissue chip)又称组织微阵列(tissue microaray,TMA),1998年由 Kononen等[3]首次提出这一概念。组织芯片技术具有以下优点[4]:①小体积,高通量;②大样本,高效率;③误差小,结果可靠;④用途广,简便经济;⑤微型化及自动化;⑥可与免疫组织化学法、原位杂交等许多分子病理检测方法相结合,进行检测DNA、RNA及蛋白质的表达。组织芯片技术可为肿瘤的早期诊断筛选分子标志物,并为肿瘤患者的疗效判断和预后提供重要的依据。
Survivin是一种凋亡抑制蛋白,是现今为止发现的分子质量最小但抗凋亡作用却是最强的蛋白。Survivin抑制细胞凋亡的机制主要是借助于天冬氨酸特异性氨酸酶(Caspase)的帮助,通过抑制Caspase一3、Caspase-7等下游的凋亡因子而发挥其抗凋亡作用。并有学者发现[5]高表达的Survivin还可借助与有丝分裂纺锤体的连接,作用于细胞周期G2/M期,并抑制多种凋亡因子对细胞周期G2/M期的凋亡诱导作用,从而加快细胞向S期转换,最后细胞出现异常增殖而发生恶性变。
本研究主要运用组织芯片技术结合免疫组化法检测Survivin蛋白在卵巢组织中的表达情况,结果发现Survivin蛋白在正常卵巢组织中不表达,在卵巢良性肿瘤中的阳性表达率为23.3%(7/30),在卵巢上皮性癌中的阳性表达率为81.5%(22/27),两两比较差异有显著意义 (P<0.05)。Survivin蛋白在卵巢组织中主要表达于细胞核。有研究发现Survivin蛋白因有Survivin-△Ex3和Survivin-2B两个不同的剪接异构体,所以Survivin蛋白可定位于细胞核也可定位于细胞浆,但表达部位的不同决定了其不同的生物学功能[6]。本实验结果发现Survivin蛋白在Ⅰ+Ⅱ期阳性表达率为42.9%(3/7),Ⅲ+Ⅳ期阳性表达率为95%(19/20),可得出随着临床分期越高Survivin蛋白的阳性表达越高(P<0.05);Survivin蛋白在中低分化组中阳性表达率高于高分化组,但两者比较无统计学意义(P>0.05)。也有学者发现在卵巢良性囊腺瘤中Survivin蛋白低表达甚至不表达,而在卵巢癌中Survivin蛋白高表达于细胞浆或细胞核,并且Survivin蛋白与卵巢癌的组织学类型、临床分期、患者远期存活情况等有重要关系[7]。这说明Survivin与卵巢癌的发生发展及浸润转移密切相关,推测凋亡抑制基因Survivin显著抑制了卵巢癌细胞的凋亡,促进恶性肿瘤的进展,可成为卵巢癌早期分子诊断及预后不良的重要指标之一。并且在肿瘤中Survivin基因扩增、突变、甲基化、启动子活性增强等许多机制可以使Survivin表达失调。其中Survivin的突变体p Ad-T34A可使Survivin失去活性,其机制为Survivin基因的34位苏氨酸被不能磷酸化的丙氨酸代替,将p Ad-T34A导入乳腺癌后,发现细胞色素C释放,并且Caspase-3被激活发挥其促进细胞凋亡的作用,抑制癌细胞的生长[8]。因此抑制Survivin蛋白的表达可显著抑制肿瘤细胞的生长,为肿瘤治疗提供新方法。
癌细胞的凋亡是多种化疗药物发挥作用的一个共同目的,能耐受化疗药物诱导细胞凋亡的癌细胞最终形成了对药物的耐药。Survivin可直接抑制Caspase-3,Caspase-7的活性而抑制细胞凋亡,并可直接与有丝分裂的微管蛋白结合使得细胞在分裂期对紫杉醇无反应,使化疗药物功能丧失,从而拮抗化疗药物消灭癌细胞的作用,还有研究表明Survivin还可通过与磷脂酰肌醇3激酶(P13K)/Akt信号传导通路的相互作用而发挥其耐药作用[9]。本实验结果显示Survivin在化疗耐药组中高表达,在化疗敏感组中低表达。Survivin蛋白促进了卵巢癌的发生发展,可能是导致癌细胞对抗癌药物产生耐药的原因之一,因此将Survivin作为靶点的分子治疗将成为卵巢癌逆转化疗耐药的新方法。
目前卵巢癌的发病率及病死率逐年增高,因此探索卵巢癌的发生发展机制及化疗耐药已成为目前国内外的研究热点,本实验得出凋亡抑制基因Survivin与卵巢上皮性癌的发生发展及化疗耐药密切相关。
[1]Mads HA,Inge MS,Juren CB,et al.The universal of the tumor—associated antigen surviving[J].Clin Cancer Res,2009,13:5991
[2]沈铿,郎景和.复发性卵巢癌恶性肿瘤的诊治规范[J].中华妇产科杂志,2003,38(11):717-720
[3]Kononen J,Bubendoff L,Kallioniemi A,et al.Tissue microarrays for high—through put molecular profiling of tumor specimens[J].Nat Med,1998,4(7):844-847
[4]Gillett C E,Springall RJ,Barnes DM,et al.Multiple tissue core arrays in histopathology research:a validation study[J].J Pathol,2010,192(4):549-553
[5]Song Z,Yao X,Wn M.Direct interaction between Survivin and Smac/DIABLO is essential for the anti-apoptotic:activity of Survivin durring taxol-induced apoptosis[J].J Biol Chem,2003,278(5):23130-23140
[6]Skagias L,Politi E,Karameris A,et al.Survivin expression as strong indicator of recurrence in urothelisl bladder cancer.Predictive value of nuclear versus cytoplasmic staining[J].Anticancer Res,2009,29(10):4163-4167
[7]Takai N,Miyazaki T,Nishida M,et al.Expression of survivin is associated with malignant potential in epithelial ovarian carcinoma[J].Int J Mol Med,2002,10:211-216
[8]Blanc-Brude OP,Mesri M ,Wall NR,et al.Therapeutic targeting of the survivin pathway in cancer:initiation of mitochondrial apoptosis and suppression of tumor-associated angiogenesis[J].Clin Cancer Res,2008,9(7):2683-2692
[9]Asselin E,Mills GB.Tsang BK XIAP regulates Akt activity and Caspase-3-dependent cleavage during cisplatin-induced apoptosis in human ovarian epithelial cancer cells[J].Cancer Res,2001,61(5):1862-1868
