慢性阻塞性肺疾病患者血清中IL-32、8-iso-PGF2α的变化及意义
2014-09-17阎红娥鲍文华孙云晖柴明思
阎红娥,张 尧,鲍文华,孙云晖,柴明思
(佳木斯大学附属第一医院呼吸科,黑龙江佳木斯154003)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是以持续气流受限为主要特征的一组呼吸系统疾病。其患病率及病死率均处于较高水平,且逐年增加,尤其在我国北方地区[1]。临床上分为稳定期及急性加重期。目前认为COPD是环境因素和(或)反复的呼吸道致病菌感染等多因子共同作用引发的,与各种炎性细胞介质关系密切。本研究通过测定COPD患者AECOPD和稳定期血清中IL-32水平变化,探讨其在COPD发病过程中的作用,为判断COPD的严重程度,评估治疗效果提供参考,并为临床寻求一种治疗COPD新的药物提供一定的理论基础。
1 对象与方法
1.1 研究对象
1)AECOPD组:从佳木斯大学附属第一医院呼吸内科2013-01~2013-05住院患者并根据中华医学会呼吸病学分会制定的最新COPD诊治指南确诊AECOPD40例,男22例,女18例,平均年龄(50±20)岁。均于近期出现咳嗽,咳痰,呼吸困难等任何一项症状明显加剧,伴发热或血白细胞升高。
2)COPD稳定期组:上诉患者经抗感染,平喘,化痰治疗两周,咳嗽,咳痰,呼吸困难及喘息症状稳定或消失,体温和血白细胞正常。
以上研究对象均己排除支气管哮喘、支气管扩张、肺间质纤维化等慢性呼吸系统疾病及严重的心、肝、肾等系统疾病;肿瘤、感染、重大外伤、手术等;糖尿病、高脂血症等代谢系统疾病;脑血管疾病和严重的免疫缺陷及结缔组织病、痛风等免疫系统疾病;精神和心理疾病从而会妨碍其他参与者完成研究者及治疗过程中出现复发或再次感染者。
3)健康对照组40例,男20例,女20例,平均年龄(49±19)岁,均无呼吸道疾病、心肺疾病及其它系统的严重疾病。
1.2 实验方法
1)标本的处理:对照组采集门诊健康体检者生化血清样本;慢阻肺急性加重期及稳定期患者分别于入院时及出院前1d采空腹肘静脉血5mL,离心分离血清,置无菌试管保存于-80℃冰箱中待测;
2)应用ELISA法测定血清IL-32及异前列腺素,美国进口试剂盒购于上海高创化学科技有限公司。
1.3 统计学处理
采用SPSS19.0统计软件进行数据处理,数据均以均数±标准差()表示,在方差齐性的基础上,使用LDS-t检验。单因素相关分析采用Spearman相关分析。α=0.05,P<0.05或 <0.01表示差异有统计学意义。
2 结果
研究中COPD患者血清中IL-32增高,与疾病活动程度呈正相关,急性期高于稳定期高于正常对照,见表1。在COPD急性加重期,患者血清IL-32与8-iso-PGF2α呈现正相关r=0.84,见表2。
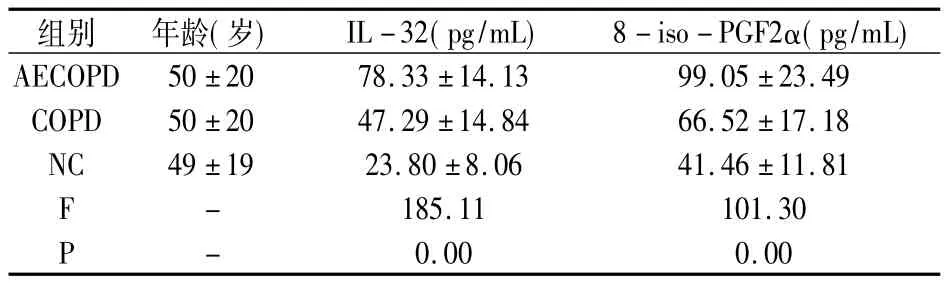
表1 三组一般资料及对比(x± s,n=40)

表2 COPD加重期组IL-32、8-iso-PGF2α与其他因素的Spearman相关分析
3 讨论
迄今为止,COPD的发病机制尚未阐明,普遍认为与遗传易感性、环境污染、免疫因素、营养及社会心理等因素有关,其主要的病理学改变表现为局部的慢性支气管炎症和小气道的结构损伤[2]。随着病情的不断进展,患者的肺功能进行性下降,严重影响其劳动能力。因此,缓解症状及延缓肺功能进行性恶化是治疗COPD的关键[3]。已有研究证实,白三烯 B4(LTB4)、白细胞介素 8(interleukin-8,IL-8)、白细胞介素5(interleukin-5,IL-5)、肿瘤坏死因子α(tumor necrosis factorα,TNF-α)等多种细胞炎症因子均与COPD的发生、进展相关联[4]。因此,白细胞介素已成为研究COPD新的切入点。
白细胞介素32(Interleukin-32,IL-32)是在应用基因芯片方法研究IL-18可诱导基因(IL-18-inducible genes)时被发现的一种分泌型蛋白质,在先天性免疫和获得性免疫应答中均发挥着重要作用,参与了慢性炎症性、感染性、以及自身免疫性等疾病的病理过程[5]。研究表明[6],IL-32参与体内的细胞凋亡,具有前炎性细胞因子的功能,能够通过活化p38 MAP和NF-K激酶进而诱导免疫细胞产生大量细胞因子,可以诱导TNF-α、IL-1β、IL-6和IL-8等介质的产生,并通过促进前列腺素的释放,激活外周血液中单核细胞花生四稀酸的代谢,发挥生物学效应。
较早的研究表明[7],在慢性阻塞性肺病患者中有吸烟史者,其IL-32-mRNA和蛋白质水平较肺功能正常的无症状吸烟者和不吸烟者均明显升高,且证实这种升高与TNFCD81细胞和p38MAP的存在密切相关,并与肺阻塞程度相关。在关于感染甲型流感病毒的人血清IL-32水平变化的研究中证实流感病毒是通过COX-2途径来刺激 IL-32的生成。流感病毒感染过后高表达的前列腺素E2(PGE2)可被IL-32所抑制。体外细胞实验研究结果显示[8,9],PBMC和A549细胞可以通过NF-B和CREB信号途径上调IL-32的表达,作用在于反馈性地抑制病毒的复制。
8-异前列腺素F2α(8-iso-PGF2α)是前列腺素的同分异构体,是自由基损害脂质细胞膜多不饱和脂肪酸等脂类后的特异性产物。它能够选择性地收缩肾脏、冠状动脉、视网膜和肺脏等脏器的血管,并且可放大炎症细胞及炎症介质的作用。Fulktmaga的研究证明8-iso-PGF2α通过血栓素/前列腺TP受体引起大鼠气道高反应性[10,11]。目前,它已成为一种评价氧化应激状态的较为稳定的生物学指标。
本研究的结果显示,COPD患者急性加重期血清中IL-32、8-iso-PGF2α水平较症状缓解期及正常对照组均明显升高;差异有统计学意义(P<0.05)。提示COPD患者体内氧化应激水平增强发生在疾病的全过程,并与病情缓急所相关,这同前期研究结果一致,在一定程度上表明IL-32在COPD的病程始终发挥着相应的作用。AECOPD入组患者均表现出较重的肺内感染,通过对其IL-32与8-iso-PGF2α进行相关性分析,两者存在着显著的正相关(r=0.839,P<0.01);这表明了在COPD急性加重期时,IL-32的水平上调可能与患者气道病原微生物侵袭所造成的黏膜损伤,进而引发的气道过度氧化应激有关;此种前提下IL-32的高水平表达可能发挥着防御性作用,但具体机制尚待明确。
[1]刘永翠,马雪梅.特布他林联合布地奈德雾化吸入治疗COPD急性加重期的临床效果与护理[J].黑龙江医药科学,2010,33(1):52 53
[2]Global strategy for the diagnosis,management,and Prevention of chronic obstruetive pulmonary disease.NHLBI/WHO workshop report.Update,2003
[3]武焱 旻 .舒利迭粉吸入剂对Ⅲ-Ⅳ级慢性阻塞性肺病患者肺功能的影响[J].黑龙江医药科学,2006,29(6):32 33
[4]Baraldo S,Turato G.Neutrophilic infiltration within theairway smooth muscle in Patientswith COPD[J].Thorax,2004,59(4):308 312
[5]Kim SH,Han SY,Azam T,et al.Interleukin-32:a cytokine and inducer of TNFalpha[J].Immunity,2005,22(1):131 142
[6]Kim SH,Han SY.Interleukin-32:a cytokine and inducer of TNF alpha[J].Immunity,2005,22(1):131 142
[7]Calabrese F,Baraldo S,Bazzan E,et al.IL-32,a novelpro-inflammatory cytokine in chronic obstructive pulmonary disease[J].Am JRespir Crit Care Med,2008,178(9):894 901
[8]Joosten Leo AB,Netea MG,Kim SH,etal.IL-32,a pro-inflammatory cytokine in rheumatoid arthritis[J].USA Proc Natl Acad Sci,2006,103(9):3298 3303
[9]Wei L,Yan L,Muhammad MM,etal.Activation of Interleukin-32 Pro-Inflammatory Pathway in Response to Influenza A Virus Infection[J].PLOSONE,2008,3(4):1 9
[10]FukunagaM,YuraT,Grygorczyk R,et al.Evidence for the distinct nature of F2-isoProstane receptors from those of thromboxane A2[J].Am JPhysiol,1997,272:477 483
[11]Held HD,Uhlig S.Mechanisms of endotoxin-induced airway and pul-monary vascular hypperreactivity in mice[J].Am J Respir Crit Care Med,2000,162:1547 1552
