培养基种类对花生毛状根株系生物量和白藜芦醇含量的影响
2014-09-14姚庆收姜吉刚武玉永梁乘榜
姚庆收 姜吉刚 武玉永 梁乘榜
白藜芦醇是一种天然的抗氧化剂,具有重要的药用价值[1,2]。近年来,Ri质粒及其发根培养系统因其在次生代谢产物生产方面的优越性而被广泛重视[3,4],并成为药用植物可持续发展的有效途径之一。花生中含有较高的白藜芦醇,花生(包括根、茎、果仁)将会成为生产白藜芦醇及与其相关医药、保健品的重要植物资源[5],因此利用花生毛状根进行白藜芦醇的生产具有现实意义。
本试验利用发根农杆菌R1601介导,对花生叶片进行诱导,获得毛状根后,经PCR鉴定,选取转染成功的生长快的毛状根株系,利用不同培养基培养,对经培养后毛状根的生物量和毛状根中白藜芦醇含量进行测定,探究不同培养基对毛状根的生物量和白藜芦醇含量的影响,旨在为进一步筛选并建立适宜的花生毛状根培养体系,用于生产白藜芦醇奠定研究基础。
1 材料与方法
1.1 材料
1.1.1 试验材料 发根农杆菌R1601,鲁花11号,毛状根株系。
1.1.2 主要试剂 主要试剂均为国产分析纯,分子生物学试剂购自上海生工生物工程有限公司,白藜芦醇标准品购自上海融禾医药科技有限公司。
1.1.3 培养基 MS、B5和N6培养基的组分参照李志勇等[6],配制的培养基pH为5.8。1/2MS培养基是在MS培养基的基础上,大量元素、微量元素、铁盐、有机成分、蔗糖用量均减半,其他同MS培养基。配制加入抗生素的MS培养基,在原有MS培养基的基础上,在培养基灭菌冷却但未凝固时加入500mg/L的羧苄西林钠,其他条件同MS培养基。其中1/2MS培养基为液体培养基,其它为固体培养基。
1.2 方法
1.2.1 花生毛状根的诱导及鉴定 主要试验过程参照文献[7],取花生鲁花11号叶片,流水冲洗30min,用4%的NaClO浸泡5-10min后,无菌水冲洗3-4次,每次5min,将叶片切成0.5cm左右,并轻轻划上伤口,置于发根农杆菌R1601培养液(A600=0.8)中5-10min,取出外植体,置于MS培养基上培养2-3d,转移到含500mg/L羧苄西林钠的MS培养基上2-3d(根据发根农杆菌生长情况,可以多次进行该步骤,直至发根农杆菌被去除),置于无激素MS培养基上,诱导毛状根。另做一份为对照,除不与发根农杆菌接触外,其余操作均相同。诱导出毛状根后,剪取毛状根,移到含500mg/L羧苄青霉素的MS培养基上除菌培养,每3-5d转接1次,直至去除发根农杆菌R1601后,继代培养用于后续试验。利用CTAB法提取花生毛状根和叶片DNA,根据Ri质粒序列,设计PCR扩增引物进行PCR鉴定。
1.2.2 毛状根的继代培养 选取一株经PCR鉴定的优良的花生毛状根继代培养,扩繁,并作为培养株系用于生物量和白藜芦醇含量的测定。每瓶加入80mL MS培养基(培养瓶为ZP16-340广口瓶,上海稼丰园艺用品有限公司生产)。具体培养条件为MS培养基、B5培养基、N6培养基和MS+500mg/mL培养基为固体,培养条件为26℃,光照条件为2000 lx,12h/d光照,培养,1/2MS培养基为液体培养基,培养条件为26℃,160r/min,暗黑条件。
1.2.3 毛状根生物量测定 将培养4周的毛状根进行生物量(生物量=收获量-接种量)的测定,将毛状根团块中所含的培养基去掉,用水洗净晾干,称鲜重,对不同培养基培养的毛状根株系的生物量进行统计分析。
1.2.4 毛状根中白藜芦醇含量的测定
1.2.4.1 白藜芦醇的提取 对不同培养基上收获的毛状根,于60℃烘干,将同一培养基收获的毛状根混合,随机分为3组,按照文献[8]中超声波提取法对不同培养基培养的毛状根进行白藜芦醇的提取,作为测试样品备用。
1.2.4.2 对照品溶液和测试样品溶液的制备 精密称取白藜芦醇对照品5mg,于25mL棕色容量瓶中,用甲醇溶解并稀释至刻度,摇匀,即得到0.20mg/mL的对照品溶液,备用。
1.2.4.3 样品中白藜芦醇含量的测定 色谱条件和标准曲线的绘制按照文献[8]进行,绘制得到回归方程。然后测定待测溶液的峰面积并将此值带入回归方程求得待测溶液中白藜芦醇的含量。
1.2.5 不同培养基毛状根中白藜芦醇总量 设定同一培养基毛状根中白藜芦醇总量=毛状根生物量(干重总量)×毛状根中白藜芦醇含量,计算不同培养基中毛状根中白藜芦醇的总量(以每种培养基接种相同瓶数为基础)。
2 结果
2.1 花生叶片毛状根的诱导及PCR鉴定
用发根农杆菌R1601侵染花生的叶片,1周左右感染发根农杆菌的花生叶片在伤口部位出现白色突起,2周左右分化为白色细根(图1),生长速度快,生根密度大。
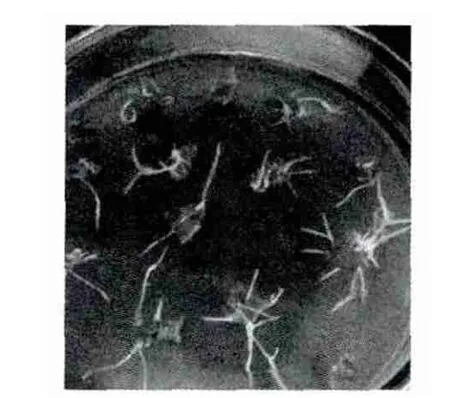
图1 花生叶片诱导的毛状根
通过设计rolB基因的特异引物,进行PCR扩增,如图2中1、2、5、6泳道所示,能够以叶片诱导的毛状根的DNA为模板扩增到预期的条带(865bp),说明所获得的毛状根为发根农杆菌诱导的遗传转化体,可以用于继代培养。
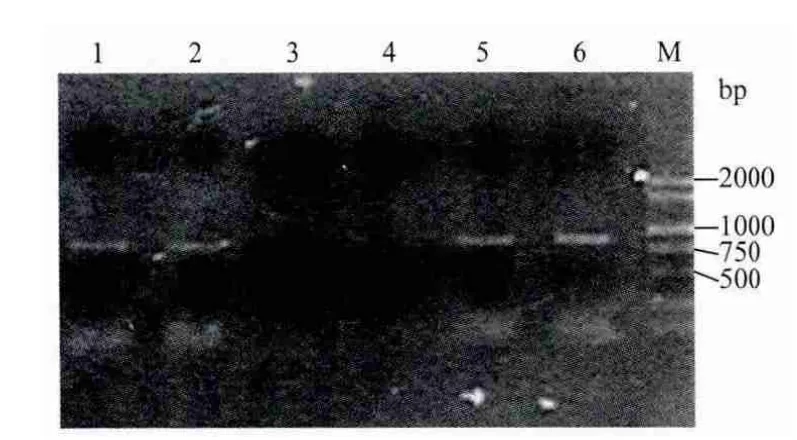
图2 毛状根PCR检测电泳图
2.2 花生毛状根继代培养
固体培养基中,在相同时间内,MS培养基中的花生毛状根克隆系生长快,生长势强,根呈乳白色,不发生褐化现象,较少出现表皮褐化(图3),大约经过4周左右即可长满培养基。加入500mg/mL的MS固体培养基中的花生毛状根生长慢,在3周后根尖开始出现老化,表皮褐化,4周左右不能长满培养基,抗生素有效抑制杂菌,很少发生污染,但对毛状根的生长有抑制作用,形态上与MS培养基中的毛状根也略有区别,主干根段变粗,颜色略黄(图4)。B5和N6培养基中的花生毛状根生长势弱,生长慢,外部形态缩短变粗现象比加抗生素的MS培养基明显,随着生长表皮褐化,4周左右也不能长满培养基(图5)。
1/2MS培养基是液体培养基,生长速度快,外部形态生长正常,无缩短变粗现象,但表皮褐化较快,只有根尖保持乳白色,4周时已经能够长满培养液(图 6)。
由于固体和液体培养基中,生长最快的经过4周左右即可长满培养基,故选取4周的毛状根进行生物量和白藜芦醇的测定。

图3 MS固体培养基培养的毛状根
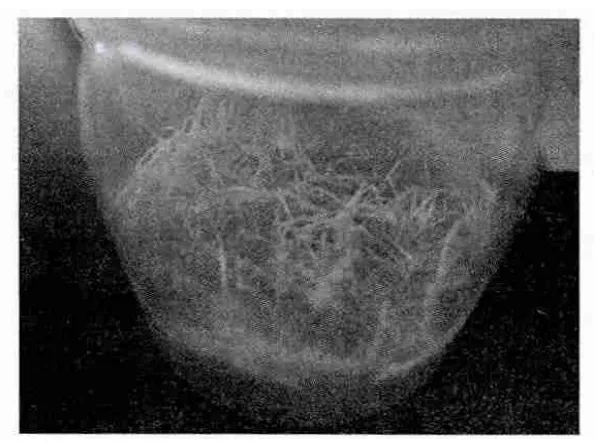
图4 MS+500mg/mL羧苄西林钠固体培养基培养的毛状根
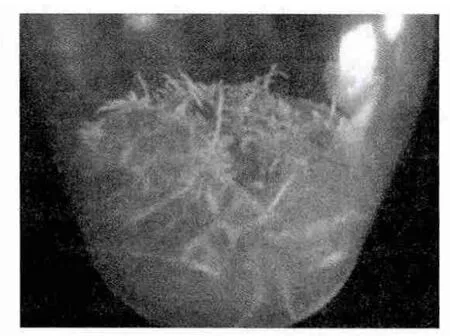
图5 N6固体培养基培养的毛状根
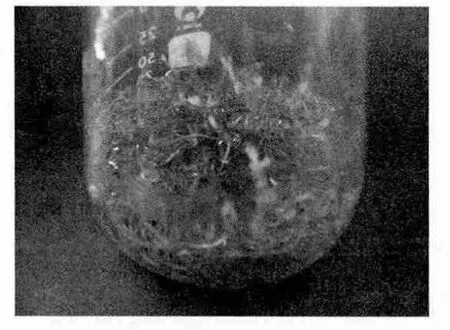
图6 1/2MS液体培养基培养的毛状根
2.3 不同培养基中毛状根生物量测定
选取4周的毛状根进行生物量测定,不同培养基之间的生物量如表1所示。
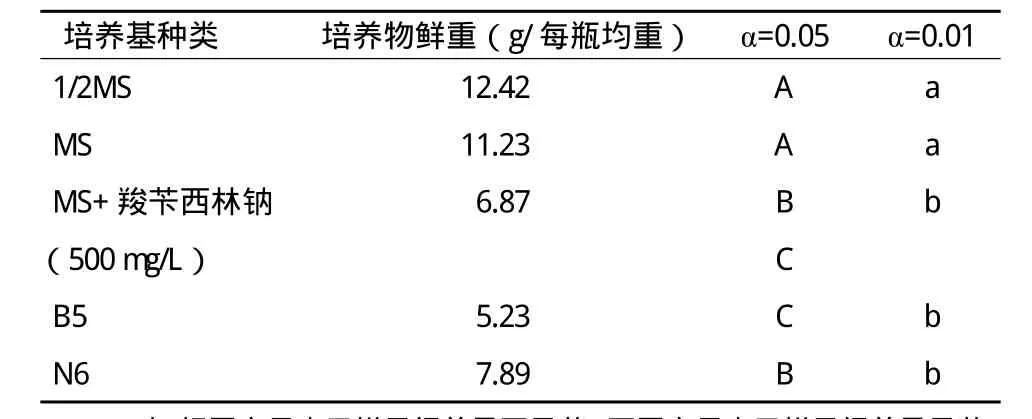
表1 不同培养基毛状根生物量测定及分析
对不同培养基之间的生物量进行统计分析,结果显示,不同培养基之间生物量的变化明显不同,4周内,1/2MS培养基和MS培养基花生毛状根的生物量积累明显要快;MS+羧苄西林钠(500mg/L)、B5和N6的培养基上花生毛状根生物量的积累慢,产量远低于1/2MS培养基和MS培养基上的毛状根,1/2MS培养基和MS培养基之间无差异,但与其他3种培养基差异极显著,但MS+羧苄西林钠(500mg/L)、B5和N6的培养基之间有差异显著但无极显著性差异。说明不同培养基对毛状根生物量的积累有明显差异,其中1/2MS培养基和MS培养基有利于毛状根生物量的积累。
2.4 不同培养基毛状根中白藜芦醇含量的测定
根据不同浓度梯度的白藜芦醇标准品得到HPLC的线性回归方程:y=7.8×107x+6390,R2=0.9931。由HPLC测定得知白藜芦醇在tR=5.070附近出峰。根据回归方程得出供试样品浓度,计算各样品白藜芦醇含量及SAS8.1软件统计分析如表2所示。
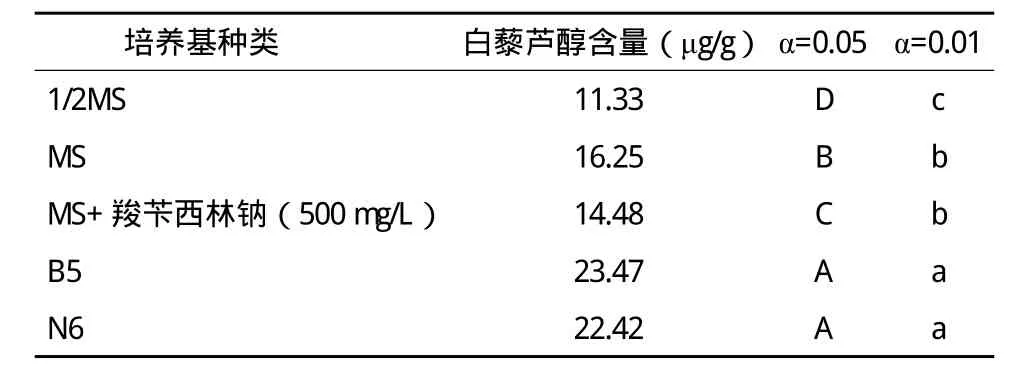
表2 不同培养基毛状根白藜芦醇含量测定分析
由表2可见,在不同培养基培养的毛状根中,B5培养基中培养的毛状根中白藜芦醇的含量最高;1/2MS 培养基中的毛状根中白藜芦醇的含量最低。MS+羧苄西林钠(500mg/L)与MS培养基中毛状根的白藜芦醇含量差异显著,但无极显著差异;B5和N6培养基中毛状根的白藜芦醇含量无显著差异。说明B5和N6培养基适合于以获得白藜芦醇为目的的毛状根培养。
2.5 不同培养基毛状根中白藜芦醇的总量
根据毛状根中白藜芦醇总量=毛状根生物量(干重总量)×毛状根中白藜芦醇含量,计算出同一培养基中毛状根中白藜芦醇的总量,结果(表3)显示,根据生物量或者白藜芦醇含量这两个因素中的任何一个因素的量高或量低,并不能就能确定最终收获的白藜芦醇的量多或量少,判定某种培养基是最适合的培养基,或者调整某种培养基,需要结合生物量和白藜芦醇的含量共同判断。
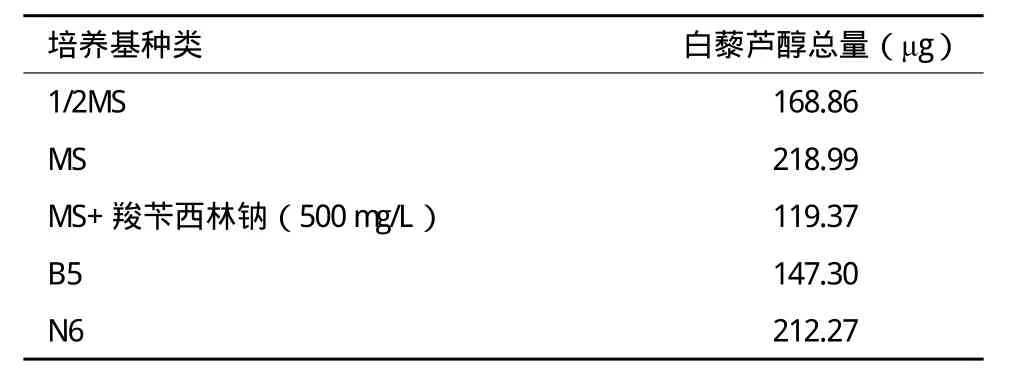
表3 不同培养基毛状根白藜芦醇总量
3 讨论
由于毛状根起源于单细胞,这些细胞在结构、大小、遗传和生理生化等特征上各不相同,其代谢状态和合成次生物质的能力也不同[9]。本试验选取了PCR技术鉴定为转染成功并生长旺盛的毛状根单克隆系作为继代培养的材料,以期为后续试验提供一个统一的基础条件,尽量减少试验影响因素。
各种培养基由于所含组分及其比例不同,对毛状根生长和次生产物的形成有不同的影响[10-16]。本试验中选取的5种培养基的成分不尽相同,MS培养基是富集元素平衡培养基[17],成分较多,营养元素丰富;1/2MS培养基是在MS培养基基础上不添加琼脂粉外对各成分减半获得,B5和N6培养基是高硝酸钾含量培养基[17]。试验显示1/2MS和MS培养基有利于生物量的积累,这可能与其营养元素全面相关,毛状根的生长是细胞不断分裂和生长的结果,涉及的生化代谢过程特别复杂,培养基成分全面就有助于这些生化过程的进行,有助于生物量的积累。而添加了抗生素后由于抗生素的作用,生物量降低,说明羧苄西林钠对毛状根的生长有抑制作用。而B5和N6培养基由于属于高硝酸钾含量培养基,营养物质种类较MS培养基少,显示出相同时间内生物量的积累要低,说明不同培养基对毛状根的生物量积累是有很大影响的,进行培养基的选择,是培养毛状根获得高生物量的前提。
培养基中铵态氮和硝态氮之间的比例也会影响毛状根生长和次生代谢产物的合成[11,18]。本试验中,B5和N6培养基最有利于白藜芦醇量的积累,显著优于MS和1/2MS培养基。而这可能是由于B5和N6是属于高硝酸钾含量培养基,硝态氮比例高,在白藜芦醇的合成过程中有助于其中的生化代谢途径,从而提高了毛状根中的白藜芦醇含量。
本试验表明根据单一的生物量或者白藜芦醇含量,并不能判定某种培养基是最适合的培养基,需要结合生物量和白藜芦醇的含量共同判断,因此生物量和白藜芦醇含量这两个因素为选择或者改进培养基提供了重要的依据,也为今后的试验研究提供了思路,今后应向寻求毛状根生长速度与白藜芦醇含量达到最佳结合的培养基种类探索,使之达到生产上的最大效益。
4 结论
探究了不同培养基对花生毛状根株系生物量积累和白藜芦醇含量的影响,表明1/2MS培养基和MS培养基有利于花生毛状根株系生物量的积累,B5培养基和N6培养基有利于花生毛状根株系中白藜芦醇的积累。
[1]李延华, 王伟君, 张兰威, 等.白藜芦醇的研究现状及应用前景[J].中国酿造, 2008, 184(7):10-12.
[2]Aggarwal BB, Bhardwaj A, Aggarwal RS, et al. Role of resveratrol in prevention and theraphy of cancer:preclinicaland clinical studies[J]. Anticancer Research, 2004, 24(5):2783-2840.
[3]辛萍, 王有志, 孙世芹.毛状根培养在植物化学成分和重组药物蛋白研究中的应用[J].时珍国医国药, 2012, 23(11):2750-2752.
[4]Sharma P, Padh H, Shrivastaval N. Hairy root cultures:A suitable biological system for studying secondary metabolic pathways in plants[J]. Engineering in Life Sciences, 2013, 13(1):62-75.
[5]黄纪念, 尚遂存, 方杰, 等.花生中白藜芦醇研究开发现状与趋势[J].中国食物与营养, 2006(2):20-23.
[6]李志勇.细胞工程[M].北京:科学出版社, 2003:83-84.
[7]姚庆收, 武玉永, 王学全.发根农杆菌介导的花生遗传转化体系的建立[J].安徽农业科学, 2008, 36(35):15367-15369.
[8]姚庆收, 姜吉刚, 甘晶晶, 等.花生毛状根及其愈伤组织中白藜芦醇提取方法的比较[J].时珍国医国药, 2012, 23(1):9-10.
[9]谢静.生物技术与药用植物次生代谢产物[J].西南军医,2007, 9(3):89-90.
[10]姜伊娜, 武天龙.毛状根的研究进展及应用[J].中国农业科技导报, 2009, 11(1):27-32.
[11]张兴, 刘晓娟, 吕巧玲.毛状根生产次生代谢产物的研究进展[J].化工进展, 2007, 26(9):1228-1232.
[12]孙际薇, 张鸿, 王凤英, 等.茉莉酸甲酯对曼陀罗毛状根中主要莨菪烷类生物碱成分积累和释放的影响[J].中国中药杂志,2013, 38(11):1712-1718.
[13]张璞, 王芳, 朱查山.真菌诱导子与吸附树脂对新疆紫草毛状根中萘醌积累的影响[J].生物工程学报, 2013, 29(2):214-223.
[14]盛东峰, 陈龙.聚乙二醇-6000胁迫对丹参毛状根中丹参酮积累的影响[J].中草药, 2013, 44(9):1181-1185.
[15]盛东峰, 张永亮.脱落酸处理对丹参毛状根中丹参酮积累的影响[J].中药材 , 2013, 36(3):354-358.
[16]王淑芳, 张仁波, 窦全丽.外界因子对粘毛黄芩毛状根生长和黄酮类化合物合成的影响[J].河南师范大学学报:自然科学版 , 2012, 40(4):124-126.
[17]杨秀平, 刘莉丽.植物组织培养常用基本培养基的数量分析[J].西北林学院学报, 2010, 25(1):97-100.
[18]Bensaddek L, Gillet F, Saucedo JE, et al. The effect of nitrate and ammonium concentrations on growth and alkaloid accumulation of Atropa belladonna hairy roots[J]. J Biotechnol, 2001, 85(1):35-40.
