天祝白牦牛IGF-2基因的cDNA克隆
2014-09-14李亚兰张全伟王雪莹马友记张勇赵兴绪
李亚兰 张全伟 王雪莹 马友记 张勇 赵兴绪
胰岛素样生长因子(Insulin-like growth factors,IGFs)是生长激素(Growth hormone,GH)发挥作用的介质,主要在肝脏中合成,具有促进有丝分裂、诱导细胞分化、调节生长等作用。IGFs包括IGF-1和IGF-2两种同源多肽,两个单链多态分子在氨基酸组成上同源性为62%,与胰岛素原(Proinsulin)同源性为 50%[1,2]。1976年,Rinderknecht和 Humbel通过将NSILA测序,发现了不同的生长因子,由于它们在结构上与胰岛素非常相似,功能上也有部分相同,所以被正式命名为胰岛素样生长因子1和胰岛素样生长因子2(Insulin like growth factor,IGF-2)[3]。其中,IGF-2也被称为生长调节素 A(Somatomedin A),刚转录出来的原始IGF-2是由156个氨基酸残基组成的多肽链,经过后续的剪切加工形成成熟的IGF-2,是由67 个氨基酸残基组成的小分子弱酸性多肽。IGF2分子中包括了胰岛素分子内所有的半胱氨酸、赖氨酸及大多数非极性氨基酸,证明它们是由同一个祖蛋白进化而来的[4]。IGF-2能促进细胞的有丝分裂和分化,参与基因组重建,与X染色体的失活有重要关系[5]。此外,IGF2与个体脂肪沉淀、生长速度等生产性能关系密切[6,7],因此可作为影响牦牛肉质性状的候选基因。已有研究表明IGF-2基因有不依赖牦牛骨骼增长而增加体重的作用[8]。目前,国内外关于IGF-2基因及其编码的蛋白在人及一些动物中已得到深入研究,但迄今尚未有牦牛IGF-2基因cDNA全序列的相关报道。
天祝白牦牛是分布于天祝县境内海拔3 000 m以上的优势牛种,也是高寒牧区人民的乳、肉等主要食品及皮毛、骨、角等生活用品的原料,在该地区具有不可替代的生态、社会和经济地位。本研究以天祝白牦牛为研究对象,应用RT-PCR技术获得cDNA片段,利用cDNA末端快速扩增(RACE)对IGF-2基因进行克隆和分析,旨在为进一步研究IGF-2基因的结构和功能提供分子生物学基础。
1 材料与方法
1.1 材料
组织样本选自甘肃省天祝县成年健康雄性牦牛,屠宰后马上取其肝脏等脏器组织后放入液氮罐中带回实验室,于-80℃超低温冰箱中保存,备用。
RNA提取试剂盒、反转录试剂盒、2×Power Taq PCR Master Mix、DNA Marker DL2000、DNA Marker DL500、胶回收试剂盒、pMD-19T载体、菌株E.coliDH5α均购自百泰克生物公司(Bio-Take),3'RACE Kit2nd Generation、5'RACE Kit2nd Generation试剂盒购自于宝生物公司(TaKaRa)。其他试剂均为国产分析纯。
1.2 方法
1.2.1 引物设计与合成 根据GenBank已发表的黄 牛(AY957981.1)、 羊(M89788.1)IGF-2基 因mRNA序列,利用Oligo 7设计天祝白牦牛IGF-2基因CDS区PCR引物。 根据RT-PCR获得的CDS序列,分别设计5' RACE 和3' RACE的特异引物。引物的相关信息见表1。

表1 RT-PCR引物序列及参数
1.2.2 IGF-2基因CDS区扩增及产物的克隆与测序 根据RNA提取试剂盒操作说明,提取天祝白牦牛肝脏的总RNA,紫外分光光度计测定总RNA的纯度和浓度,0.8%琼脂糖凝胶电泳检测RNA的完整性,-80℃保存。
取2μg总RNA根据反转录试剂盒说明合成cDNA,反应条件为 48℃,60min;70℃,10min。再以cDNA为模板进行PCR反应,反应总体系为20μL :cDNA 模板 1μL,上下游引物各 1μL(10μmol/μL),2×Power Taq PCR Master Mix 10μL,ddH2O补足20μL。反应条件为:95℃预变性4min;94℃45s,59℃ 45s,72℃ 1min,30 个循环 ;72℃延伸10min,4℃保存。制作0.8%琼脂糖检测PCR产物,对PCR产物进行切胶回收,回收产物与pMD19-T载体连接,之后转化到感受态细胞,蓝白斑筛选挑取阳性克隆,菌落PCR检测的阳性菌送上海生物工程有限公司测序。
1.2.3 IGF-2基因5'和3'端的序列扩增 以总RNA为模板,按TaKaRa 5'-Full RACE Kit以及3'-FullRACE Kit说明书步骤,扩增天祝白牦牛IGF-2基因5'和3'端的序列,将PCR产物连接载体克隆,菌落PCR检测的阳性菌送上海生物工程有限公司测序。
1.2.4 IGF-2基因生物学分析 测序结果经过人工校正后,用DNAMAN软件进行序列拼接。利用MegAlign(DNASTAR)将天祝白牦牛IGF-2基 因 与 牛(AY957981.1)、 羊(M89788.1)、 猪(HQ450757.1)、马(ECILGF22)、人(XM005252900.1)、小鼠(NM_010514.3)、大鼠(NM_031511.2)等物种IGF-2 基因氨基酸序列分别进行比对分析,用MAFFT在线软件构建系统进化树[9]。
2 结果
2.1 总RNA的提取
总RNA经紫外分光光度计检测,其紫外吸收值OD260/OD280为1.92;经琼脂糖凝胶电泳后可见28S和18S rRNA各一条带,亮度比接近2∶1,表明本试验所提取的天祝白牦牛总RNA的纯度和完整性较好,可以用于下一步RT-PCR。
2.2 天祝白牦牛IGF-2基因全长cDNA扩增及克隆测序
以天祝白牦牛肝脏组织为cDNA模板,将PTPCR产物经过1%琼脂糖凝胶电泳显示扩增得到了长度为500bp左右的片段,经测序确定为544bp。5'RACE 和3'RACE分别获得510bp和66bp的特异性条带(图1),经测序对得到的序列拼接,除去冗余序列,得到天祝白牦牛IGF-2 cDNA序列长为1060bp。
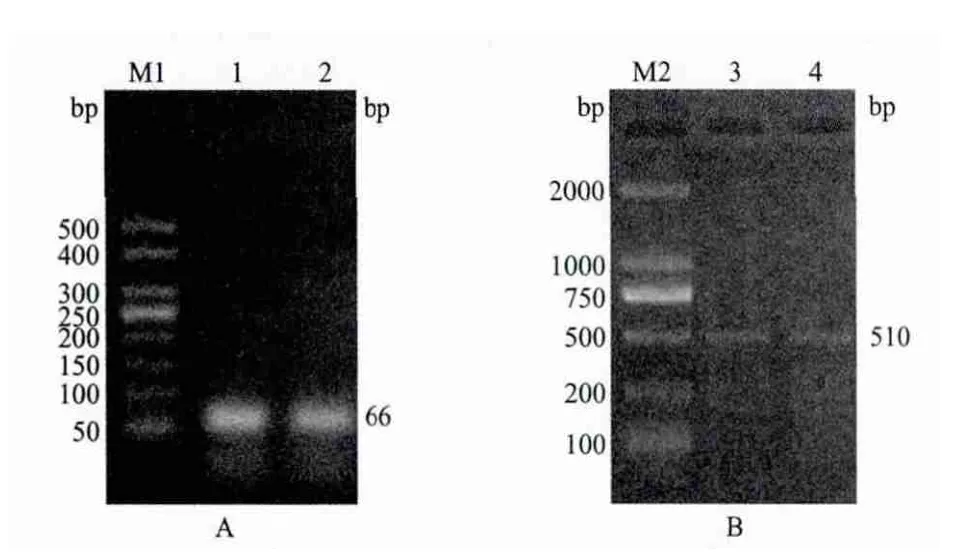
图1 3'RACE(A)和5'RACE(B)扩增产物电泳图
2.3 天祝白牦牛IGF-2基因cDNA序列分析
获得的天祝白牦牛IGF-2基因长1060bp,包括111bp的5'UTR,409bp的3'UTR,540bp的开放阅读框(ORF),起始密码子ATG位于112 nt,终止密码子TGA位于649 nt(图2),该基因已提交至GenBank,获得登录号为:KF682139。
2.4 天祝白牦牛IGF-2基因蛋白序列分析
根据获得的天祝白牦牛IGF-2基因编码区核苷酸序列,推导出编码179个氨基酸残基组成的蛋白,该蛋白氨基酸中含量最多的为Ala,占氨基酸总数的11.2%。经ProtParam程序分析天祝白牦牛IGF-2蛋白的分子量为19.7kD,理论等电点(pI)为9.11,不稳定系数为59.56,为不稳定蛋白。SMART分析(图2)表明,该蛋白第1-24位氨基酸为信号肽;第25-91位氨基酸为成熟肽,分为B、C、A、D四个区域;第112-166位氨基酸为结构域。
2.5 天祝白牦牛IGF-2基因同源性比较
用DNAMAN软件将天祝白牦牛翻译后的氨基酸序列分别与GenBank中所报道的羊、黄牛、人、大鼠、小鼠和猪的氨基酸序列进行比对,结果(图3)表明,天祝白牦牛IGF-2氨基酸序列与黄牛的同源性最高为94.4%;其次与羊的同源性为91.8%,与猪、人、大鼠和小鼠的同源性分别为85.9%、85.9%、82.3%、80.7%。进化树(图4)分析表明,天祝白牦牛IGF-2 基因座位与黄牛和羊的亲缘关系最近。

图2 天祝白牦牛IGF-2基因cDNA序列及推导的氨基酸序列

图3 天祝白牦牛与其他物种IGF-2氨基酸序列间多序列对位排列
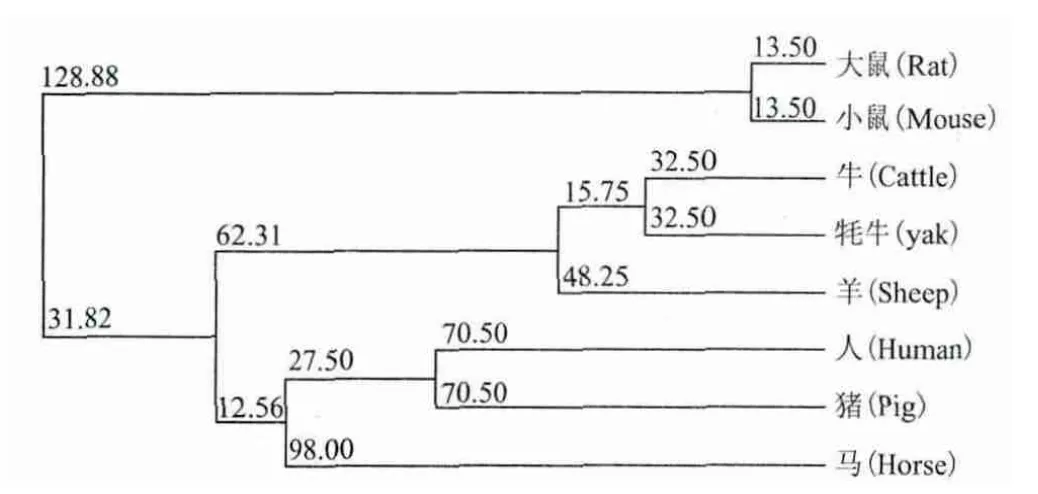
图4 IGF-2基因与其他物种系统进化树
3 讨论
本研究采用RACE技术首次成功地克隆得到了天祝白牦牛IGF-2基因编码区的全长cDNA,从该基因的核酸序列推断出IGF-2蛋白质的一级结构。试验得到的天祝白牦牛IGF-2基因 cDNA核苷酸序列和推导的氨基酸序列经NCBI Blast 序列比对,与已报道的牛、马、人及小鼠等物种的 IGF-2 基因具有高度的同源性,说明IGF- 2 基因具有高度的保守性。参照人和其他哺乳动物的IGF-2结构,推测所克隆得到的天祝白牦牛IGF-2的氨基酸序列分为信号肽、B、C、A、D和结构域 6个区域,A 和B 结构域与胰岛素原具有极高的同源性,这些结构域的结构对于受体和结合蛋白识别IGF-2很重要[10]。成熟肽B、C、A、D 4个区域,共有6个半胱氨酸残基,可形成3对二硫键(33-71,45-84,70-75),对维持IGF-2的空间结构起重要作用。从这些结果可以看出IGF-2基因在进化上的保守性。IGF-2是目前研究 较多的印迹基因之一,目前,IGF-2已在人、鼠、羊、猪和牛等物种被确定为印记基因,且正常情况下大多数组织均为母源印记[11,12],即父源等位基因表达。IGF-2基因在其他哺乳动物中是否存在基因印迹现象,是否也是父源等位基因基因,都有待于进一步的研究。
近年来,家畜经济价值的研究受到广泛关注,牦牛作为一种重要的经济物种,其肉、毛 奶等具有较高的经济价值[13]。由于牦牛生存环境受到多种因素(低氧、寒冷、放牧周期短等)的影响[14-16],其生长可能被抑制。IGF-2作为牦牛肉质研究的候选基因,其结构和功能的研究具有重要的意义。IGF-2是一种多功能细胞增殖调控因子,在细胞的分化,增殖、胚胎的生长发育以及肿瘤细胞增殖中具有重要的促进作用[17],通过促进牦牛骨骼发育和肌肉增长,从而增加其产肉量,达到提高其经济价值的效果[14]。本研究对IGF-2结构研究及其功能的预测,为进一步对IGF-2功能研究奠定基础,为牦牛经济价值开发提供参考和理论依据。
4 结论
本研究运用同源序列克隆技术结合RACE技术,获得全长1060bp天祝白牦牛IGF-2基因的cDNA,并对其氨基酸与编码氨基酸序列特性进行了研究。该基因的成功克隆为进一步研究牦牛IGF-2基因的功能奠定了基础。
[1]Le Roith D. The insulin -like growth factor system[J]. Exp Diabesity Res, 2003, 4:205-212.
[2]Werner H, Adamo M, Robert CT, et al. Molecular and cellular aspects of insulin-like growth factor action[J].Vitamins and Hormones, 1994, 48:1-58.
[3]Rinderknecht E, Humbel RE. Amino-terminal sequences of two polypeptides from human serum with nonsuppressible insulinlike and cell-growth-promoting activities:evidence for structural homology with insulin B chain[J]. Proc Natl Acad SciUSA, 1976,73(12):4379-4381.
[4]蒋思文, 彭健, 熊远著.胰岛素样生长因子2 研究进展[J].遗传,2004, 26(2):271-273.
[5]Lee MH, Jeon YJ, Lee SM, et al. Placental gene expression is related to glucose metabolism and fetal cord blood levels of insulin and insulin-like growth factors in intrauterine growth restriction[J].Early Hum Dev, 2010, 86(1):45-50.
[6]Aslan O, Hamill RM, Davey G, et al. Variation in the IGF2 gene promoter region is associated with intramuscular fatcontentin porcine skeletal muscle[J]. Mol Biol Rep, 2012, 39(4):4101-4110.
[7]Geisert RD, Chamberlain CS, Vonnahme KA, et al. Possible role of kallikrein in proteolysis ofinsulin-like growth factor binding proteins during the oestrous cycle and early pregnancy in pigs[J].Reproduction, 2001, 121:719-728.
[8]王丁科, 阎萍, 梁春年, 等. 牦牛IGF2内含子的遗传多态性及其遗传效应分析[J].华北农学报, 2009, 24(2):107-111.
[9]MAFFT, version 7.113, Computational Biology Research Center(CBRC):Tokyo, Japan, 2013.
[10]王丁科, 阎萍, 梁春年, 等. 胰岛素样生长因子2研究进展[J].动物医学进展, 2008, 29(7):67-70.
[11]Surani MA. Reprogramming of genome function through epigenetic inheritance[J].Nature, 2001, 414:122-128.
[12]Dindot SV, Kent KC, Evers B, et al. Conservation of genomic imprinting at the XIST, IGF2 and GTL2 loci in the bovine[J].Incorporating Mouse Genome Mammalian Genome Genes and Phenotypes, 2004, 15(12):966-974.
[13]Hu Q, Ma T, Wang K, et al. The Yak genome database:an integrative database for studying yak biology and high-altitude adaption[J]. BMC Genomics, 2012, 13:600.
[14]Jones JI, Clemmons DR. Insulin-like growth factors and their binding proteins:biological actions[J]. Endocrine Reviews ,1995, 16:3-34.
[15]Sandra D, O'Dell, Ian NM Day. Molecules in focus Insulin-like growth factor II(IGF-II)[J].The International Journal of Biochemistry &Cell Biology, 1998, 30:767-771.
[16]Long RJ, Apori SO, Castro FB, Ørskov ER, et al. Feed value of native forages of the Tibetan Plateau of China[J].Animal Feed Science and Technology, 1999, 80(2):101-113.
[17]Fazio S, Palmieri EA, Biondi B, et al. The role of the GH-IGF-I axis in the regulation of myocardial growth:from experimental models to human evidence[J]. European Journal of Endocrinology,2000, 142:211-216.
