金铁锁多倍体毛状根的诱导及性质
2017-03-02潘苗苗张宗申刘同祥于振艳
施 陆, 程 诺, 潘苗苗, 陈 阳, 张宗申, 刘同祥, 于振艳
(1.大连工业大学生物工程学院,辽宁大连 116034; 2.河南省海乐森药用细胞工程技术有限公司,河南郑州 450001)
金铁锁多倍体毛状根的诱导及性质
施 陆1, 程 诺1, 潘苗苗1, 陈 阳1, 张宗申1, 刘同祥2, 于振艳2
(1.大连工业大学生物工程学院,辽宁大连 116034; 2.河南省海乐森药用细胞工程技术有限公司,河南郑州 450001)
研究了秋水仙素对金铁锁毛状根多倍化、多倍化后毛状根生长和皂苷积累的变化。结果表明,秋水仙素对金铁锁毛状根的作用效果具有浓度和时间依赖性,其中,经1.25 mmol/L的秋水仙素处理24 h的金铁锁毛状根根尖存活率最高,达到60%;加倍后细胞核体积明显增加,侧根分支比普通毛状根多,根毛密度也比普通毛状根大。培养35 d后的生物量是普通毛状根的1.48倍(干重);多倍体毛状根和普通毛状根在皂苷质量分数方面差别不大,但在同等培养条件下,多倍体毛状根的皂苷总产量较高,达到普通毛状根的1.45倍。结果提示,染色体多倍化是一种提高毛状根质量和皂苷产量的潜在重要技术。
金铁锁;毛状根;多倍体
0 引 言
金铁锁(Psammosilene tunicoides)为石竹科金铁锁属多年生药用植物,主要分布于我国云南、四川等地区[1]。金铁锁以根入药,主要用于祛风除湿、散瘀止痛,对抗炎和镇痛也具有较好作用[2]。研究发现,金铁锁中主要的天然活性成分是三萜、三萜皂苷、内酰胺等[3-4]。近年来,金铁锁的药用市场需求不断扩大,其野生资源数量却急剧下降,因此采用现代生物技术解决金铁锁药材短缺问题迫在眉睫。毛状根是发根农杆菌所含Ri质粒的T-DNA片段在植物细胞基因组中插入、整合并表达,诱导植物细胞形成的不定根[5]。毛状根具有生长速度快、无向地性、激素自养、生理代谢和遗传稳定等优点,其规模化培养是替代野生或大田栽培资源的重要生物技术手段[6]。
多倍体植物含有3个以上染色体组,在自然界中普遍存在。与二倍体相比,多倍体植株具有表型巨大、抗逆性强、次级代谢产物量高等特征[7-9]。在药用植物育种领域,已经有一些关于多倍体药用植株育种研究文献报告,但在离体器官水平上多倍化的研究还很少[10-11]。本研究通过秋水仙素浸渍的方式,使毛状根的细胞于减数分裂期抑制纺锤体生成,阻止染色体分离,使得植物细胞染色体加倍,从而获得多倍体毛状根,并获得相应多倍体的有利性状,达到相同培养条件下次生代谢物产量得以增加的目的,以期为后续通过规模化培养多倍体毛状根生产天然产物提供参考。
1 材料与方法
1.1 材 料
悬浮培养的金铁锁毛状根根尖,大连工业大学药用植物细胞工程实验室提供;秋水仙素, Sigma公司;齐墩果酸标准品,上海江莱生物科技有限公司。
1.2 方 法
1.2.1 秋水仙素浓度和处理时间的确定
以金铁锁毛状根的根尖作为原材料。将金铁锁毛状根根尖切下,长度为0.5 cm,分别用不同浓度的秋水仙素溶液浸泡处理。每组浓度的秋水仙素处理设置10瓶重复,每瓶接入50段根尖,在温度(24±1)℃、转速110 r/min的条件下于摇床上暗培养,并分别统计和计算培养24、48和72 h后毛状根的存活率。
1.2.2 染色体染色与观察
取材:将毛状根转移到新鲜MS培养基中,培养7 d后,切取1~2 mm的根尖待用。毛状根根尖的处理、染色以及制片等按照刘永安等[12]的方法进行。在光学显微镜(CX31 RTSF)下观察。
1.2.3 毛状根形态学的观察
将经过不同浓度秋水仙素处理24 h的毛状根用无菌水冲洗,转接至1/2 MS液态培养基中, (24±1)℃黑暗条件下在转速为110 r/min摇床中培养。培养35 d后,将多倍体毛状根与培养35 d的普通毛状根进行形态学对比,观察其粗细、长短、分支多少等,采用Canon D60相机拍照。
1.2.4 毛状根生长量的测定
将40个100 m L三角瓶平均分为4组,分别加入约20 m L的1/2 MS液体培养基,称初始总质量,分别接入1 g的普通毛状根和1.25、2.50和5.00 mmol/L 3种浓度秋水仙素分别处理24 h的毛状根,于相同条件下培养。每7 d测定一次总质量,减去各自的初始总质量,为毛状根的生物量。每组取10瓶的平均值,记录、分析秋水仙素对毛状根生长量的影响。
1.2.5 毛状根皂苷质量分数的测定
目前,国内尚无金铁锁皂苷类成分的法定对照品,本实验选用齐墩果酸标准品为对照品,采用香草醛-高氯酸比色法测定金铁锁总皂苷质量分数。
金铁锁毛状根总皂苷提取、测定以及标准曲线绘制等按照Zhang等[13]方法进行。
1.2.6 金铁锁毛状根活力的检测
采用FDA法检测金铁锁毛状根活力的活力。在样品中滴加0.12 mol/L的FDA溶液,在25℃孵育20 min,抽滤除去孵育液,用1/2 MS液体培养基反复冲洗几次,直到冲洗液无颜色后于倒置荧光显微镜(Motic AE31)下观察。
2 结果与分析
2.1 秋水仙素处理浓度和时间对金铁锁毛状根活力的影响
由图1可知,毛状根的存活率与秋水仙素处理浓度和处理时间都有很大关系,具有明显的浓度和时间依赖性。在相同处理时间的条件下,秋水仙素浓度越低,毛状根的存活率越高;随着处理时间的延长,毛状根存活率急剧下降,到72 h时,毛状根几乎全部死亡。从图1中可以看出,经0.75 mmol/L的秋水仙素处理毛状根根尖24 h,毛状根的存活率最高,达到76%;经1.25 mmol/L的秋水仙素处理毛状根根尖24 h,毛状根的存活率较高,达到62%。
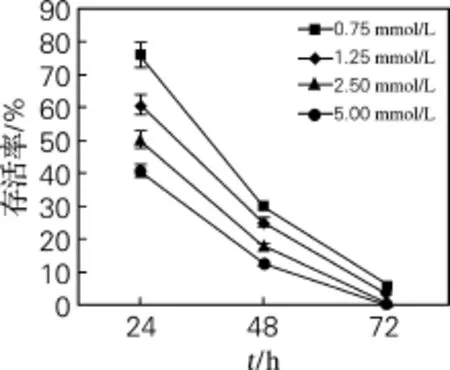
图1 秋水仙素浓度和处理时间对金铁锁毛状根存活率的影响Fig.1 Effects of colchicine concentrations and treatment time on the survival rates of hairy roots
如图2所示并结合图1结果,确定经过0.75、1.25 mmol/L的秋水仙素处理24 h的毛状根均具有较高存活率和较强的根活力。
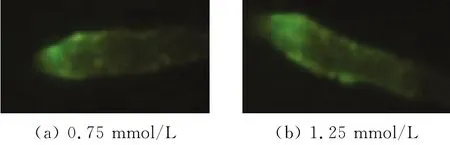
图2 毛状根的活力染色结果Fig.2 The vitality of hairy roots after dyeing
2.2 多倍体毛状根的染色体观察
分别将经过0.75和1.25 mmol/L秋水仙素处理24 h的毛状根根尖培养一段时间,观察染色体并统计染色体数量,结果如图3所示。图3表明,金铁锁毛状根普通体细胞中染色体n=14,即2n=28;经过0.75 mmol/L秋水仙素处理的毛状根细胞中染色体数与普通毛状根染色体数相同,细胞核体积与普通细胞核相差不大;而经过1.25 mmol/L秋水仙素处理的毛状根细胞中染色体数明显多于普通毛状根细胞染色体数,并且细胞核体积明显增大;这说明秋水仙素的浓度过低不利于进行多倍体诱导,因此选择1.25 mmol/L的秋水仙素处理毛状根根尖24 h进行多倍体诱导。在保证成功诱导多倍体毛状根的前提下,毛状根的存活率处于最高水平并具有较强活力。
2.3 多倍体毛状根的形态比较
2.3.1 多倍体毛状根与普通毛状根分支的比较
将毛状根用秋水仙素处理24 h后进行培养, 35 d后取样观察侧根和根毛,结果如图4所示。普通毛状根与多倍体毛状根的形态区别主要体现在侧根分枝和根毛两部分:秋水仙素处理的毛状根,侧根分支明显比普通毛状根多,可以达到三级侧根,而普通毛状根主要是二级侧根;染色体加倍毛状根的根毛分布密度大,长度更长;3种浓度秋水仙素处理结果相比,1.25 mmol/L的秋水仙素处理的效果最好。根毛密集更有利于毛状根对培养基中营养物质和水分的吸收,在一定程度上促进毛状根的生长。
2.3.2 多倍体毛状根与普通毛状根生物量的比较
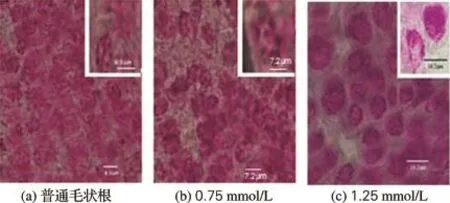
图3 不同浓度秋水仙素处理毛状根根尖细胞中的染色体Fig.3 Chromosomes of hairy roots treated by different concentrations of colchicine
经过秋水仙素处理24 h,将毛状根培养一定时间后测定生长量变化,结果如图5所示。与普通毛状根相比,相同条件下多倍体毛状根在一定程度上生物量增长更快。这可能是植物细胞经加倍处理后,细胞体积巨大化、细胞分裂周期缩短、细胞数量增加所引起的。对比发现,秋水仙素处理浓度对毛状根生长量也有很大影响,浓度为1.25 mmol/L的效果最好。原因可能有两个,一是不同秋水仙素浓度处理的毛状根其多倍体的杂合比例不同,以及多倍体的分裂周期不同,导致其生长变化的速度也相应不同;二是不同浓度秋水仙素处理的毛状根对毛状根本身造成的潜在伤害也不同,从而导致其生长速率不同,但是具体的影响需要进一步研究。
图6为秋水仙素处理的毛状根在悬浮条件下培养35 d后的生长状态,具体生物量在表1中列出。结果表明,3种浓度秋水仙素处理的毛状根,除了生物量有差异,各自的生长状态正常,如色泽乳白、分支多、沿培养基水平生长等特征;秋水仙素处理的毛状根生物量都超过普通毛状根,其中1.25 mmol/L秋水仙素处理的毛状根生物量增加最多,35 d后毛状根干重是普通毛状根的1.48倍。2.3.3 多倍体毛状根中皂苷质量分数的变化
以7 d为取样周期,分别测定毛状根中皂苷质量分数,结果见图7。结果表明,在培养的14 d内,多倍体毛状根与普通毛状根中皂苷质量分数差别甚微,并且维持不变,14 d以后才逐渐增加;多倍体毛状根中的皂苷质量分数增长时间比普通毛状根皂苷更滞后,可能是经秋水仙素处理的毛状根生长周期更长,导致次级代谢变化时间滞后,这是典型的半生长偶联型次级代谢类型[14]。
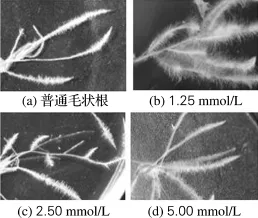
图4 不同浓度秋水仙素处理多倍体毛状根与普通毛状根的分支比较Fig.4 Comparison of branches of polyploid and common hairy roots treated by different concentrations of colchicine
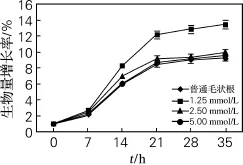
图5 不同浓度秋水仙素对毛状根生长量的影响Fig.5 The effects of different concentrations of colchicine on the growth of hairy roots

图6 多倍体毛状根经不同浓度的秋水仙素处理35 d后的生长情况Fig.6 The growth of polyploid hairy roots treated by different concentrations of colchicine for 35 d
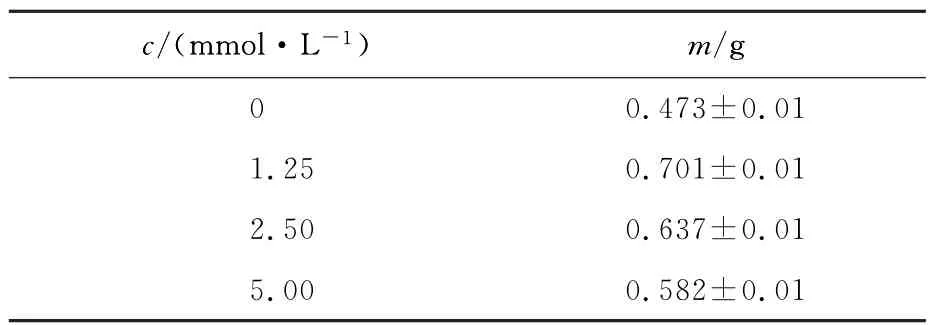
表1 不同浓度秋水仙素处理后毛状根干重的变化Tab.1 The changes of dry weight of hairy roots treated by different concentrations of colchicine

图7 不同浓度秋水仙素对毛状根中皂苷质量分数的影响Fig.7 The effects of different concentrations of colchicine on saponins contents in hairy roots
将培养35 d的毛状根烘干至恒重后,分别称取1 g样品测定皂苷质量分数,并据此计算皂苷总产量。皂苷总产量=皂苷质量分数×毛状根生物量,结果如表2所示。

表2 不同浓度秋水仙素处理后毛状根中皂苷质量分数及皂苷总产量Tab.2 The saponin contents in hairy root and total saponin yields treated by different concentrations of colchicine
结果表明,不同浓度秋水仙素诱导的多倍体毛状根其毛状根中皂苷质量分数不同,但差别不大。研究表明,药用植物细胞染色体多倍化后,细胞中次生代谢产物积累的能力提高[15]。结果提示,毛状根细胞染色体加倍后,皂苷质量分数并没有显著变化,该结果证明了植物次生代谢的复杂性,具有种质、细胞生理阶段、器官等特异性,当然也可能与毛状根本身的生长特点有关。尽管皂苷质量分数变化不大,但秋水仙素处理的毛状根生物量增加明显,所以皂苷总产量比普通毛状根增加很多,特别是经1.25 mmol/L秋水仙素处理24 h的毛状根,其皂苷总产量是普通毛状根的1.45倍。
3 结 论
本实验以不同浓度的秋水仙素对金铁锁毛状根进行多倍体诱导,同时对多倍体毛状根的生长量、皂苷产量以及生长形态进行研究。结果表明,金铁锁毛状根根尖经1.25 mmol/L的秋水仙素处理24 h,毛状根成功加倍,且存活率处于最高水平。金铁锁毛状根多倍化后侧根分枝增加,根毛密度和长度变化很大;这有利于毛状根生长过程中对营养元素和水分的吸收,使多倍体金铁锁毛状根在单位时间内生物量大幅提高,尽管皂苷质量分数变化不大,但皂苷总产量明显增加。结果提示,毛状根细胞染色体多倍化是改善毛状根生物量和提高次生代谢产物产量的一种方式。
[1]文波.中药金铁锁地上部分的化学成分与生物活性研究[D].福州:福建中医药大学,2014.
[2]王学勇,张元,许建阳,等.金铁锁总皂苷抗类风湿性关节炎作用及其作用机制研究[J].中国中药杂志, 2006,31(5):419-421.
[3]赵保胜,桂海水,朱寅荻,等.金铁锁化学成分、药理作用和临床应用研究进展[J].中国实验方剂学杂志, 2011,17(18):288-291.
[4]浦湘渝,杨崇,周俊.金铁锁的三萜化合物[J].云南植物研究,1984,6(4):463-466.
[5]ZHANG Z S,QIU N N,WANG C,et al.Induction and characterization of callus from Psammosilene tunicoides hairy roots[J].Journal of Chemical and Pharmaceutical Research,2014,6(3):1394-1399.
[6]李景滨,刘同祥,王培忠,等.金铁锁毛状根诱导及培养体系的建立[J].中国中药杂志,2011,36(5):547-551.
[7]闫海锋,黄夕洋,梁萍,等.二倍体与多倍体罗汉果生物学性状的比较研究[J].广西科学,2011,18(2): 177-184.
[8]何韩军,杨跃生,吴鸿.药用植物多倍体的诱导及生物学意义[J].中草药,2010,41(6):1000-1006.
[9]张兴翠,梁国鲁,扬光伟,等.芦荟的快速繁殖与多倍体诱导[J].中国中药杂志,2001,26(8):32-34.
[10]王跃华.川黄柏多倍体诱导研究[J].中国中药杂志, 2006,31(6):448-451.
[11]侯丽丽,施和平,余武,等.烟草毛状根多倍体诱导及其植株再生[J].生物工程学报,2014,30(4):581-594.
[12]刘永安,冯海生,陈志国,等.植物染色体核型分析常用方法概述[J].贵州农业科学,2006,34(1):98-102.
[13]ZHANG Z S,YU Z Y,JIN Z X,et al.Liquid culture of adventitious roots is a potential alternative to field cultivation for Psammosilene tunicoides,a rare and endangered endemic medicinal plant[J].Advance Journal of Food Science and Technology, 2013,5(2):127-131.
[14]张健,金朝霞,顾孟阳,等.草酸对金铁锁悬浮细胞的生理影响[J].大连工业大学学报,2014,33(5):328-332.
[15]房翠萍.丹参多倍体诱导、毛状根培养及其丹参酮产量提高的研究[D].合肥:安徽农业大学,2011.
Induction and characterization of hairy roots-derived polyploidy of Psammosilene tunicoides
SHI Lu1, CHENG Nuo1, PAN Miaomiao1, CHEN Yang1, ZHANG Zongshen1, LIU Tongxiang2, YU Zhenyan2
(1.School of Biological Engineering,Dalian Polytechnic University,Dalian 116034,China; 2.Henan Health Medicinal Cell Engineering and Technology Limited Company,Zhengzhou 450001,China)
The effects of colchicine on polyploidisation of Psammosilene tunicoides hairy roots and changes in both growth of hairy roots and saponins contents were studied.The results showed that the effects of colchicine were in a time and concentration dependent manner,and the maximum survival rate was up to 60%treated by 1.25 mmol/L colchicine for 24 h.The nuclear volume was significantly increased treated by 2.5 mmol/L colchicine,and the colchicine-treated hairy roots had more lateral roots branch and higher roots hair density compared with the normal.The biomass(dry weight)of the treated hairy roots was 1.48 times of that of ordinary hairy roots after cultured for 35 d.The saponin contents of the two types of hairy roots had little differences,but the saponins yield of the treated hairy roots was 1.45 times of that of normal hairy roots under the same culture conditions.The results suggested that polyploidisation of chromosome would be a potential method to improve the efficiency and quality of hairy roots in large scale culture in the future.
Psammosilene tunicoides;hairy roots;polyploidy
S567.2
A
1674-1404(2017)01-0014-05
2015-12-11.
河南省科技创新杰出人才项目(134200510002).
施陆(1991-),女,硕士研究生;通信作者:张宗申(1968-),男,教授.
施陆,程诺,潘苗苗,陈阳,张宗申,刘同祥,于振艳.金铁锁多倍体毛状根的诱导及性质[J].大连工业大学学报,2017,36 (1):14-18.
SHI Lu,CHENG Nuo,PAN Miaomiao,CHEN Yang,ZHANG Zongshen,LIU Tongxiang,YU Zhenyan.Induction and characterization of hairy roots-derived polyploidy of Psammosilene tunicoides[J].Journal of Dalian Polytechnic University,2017,36(1):14-18.
