早胜牛类群A-FABP基因SNPs及其与胴体品质和肉质性状的相关性分析
2014-09-14唐红杰赵生国雷赵民王欣荣王建福蔡原吴建平
唐红杰 赵生国 雷赵民 王欣荣 王建福 蔡原 吴建平
脂肪型脂肪酸结合蛋白(A-FABP)属于脂肪酸结合蛋白家族,是脂结合蛋白超家族的成员。A-FABP(Adipocyte fatty acid binding-protein)基因,也称为Ap2、ALBP或FABP4,主要在脂肪细胞中表达,在甘油三酯形成及脂解过程中参与调控脂生成或溶解的生化过程[1]。牛A-FABP基因定位于牛14号染色体[2],DNA 全长 4391bp,mRNA 全长 625bp,编码132个氨基酸。关于鸡[3]、猪[4]等畜禽的研究表明,A-FABP基因能够增加肌内脂肪含量,且只在脂肪组织中表达。多态性的研究表明,鸡[5,6]、鸭[7]、猪[8]、牛[9-11]A-FABP 基因多态性与肌内脂肪沉积相关,可作为牛肉大理石花纹和肌间脂肪(IMF)含量等肉质性状的侯选基因[1,12]。A-FABP基因的突变对“日本和牛×利木辛牛”F2杂种牛的大理石花纹、皮下脂肪厚度[10]、牛背部脂肪厚度[13]及朝鲜牛大理石花纹[14]都存在相应的影响。鉴于A-FABP基因在脂质代谢过程中的重要作用,本研究以5个甘肃早胜牛类群为研究对象,利用PCR-SSCP技术,对A-FABP基因外显子3进行多态性检测,并分析多态位点与肉质性状的相关性,旨在找出与生产性状相关的遗传标记,为选育优良肉牛提供遗传学理论依据。
1 材料与方法
1.1 材料
1.1.1 试验样品来源及基因组DNA提取 采集的牛耳组织样(表1),置于盛有75%酒精的5mL EP管中,-20℃保存。采集的牛颈静脉血样6-8mL,加入1mL ACD抗凝剂,-20℃保存。用酚/氯仿法提取耳组织和血液基因组DNA[15],TE溶解,并用琼脂糖凝胶电泳和紫外分光光度法检验DNA的纯度和浓度,然后稀释成100 ng/μL备用。
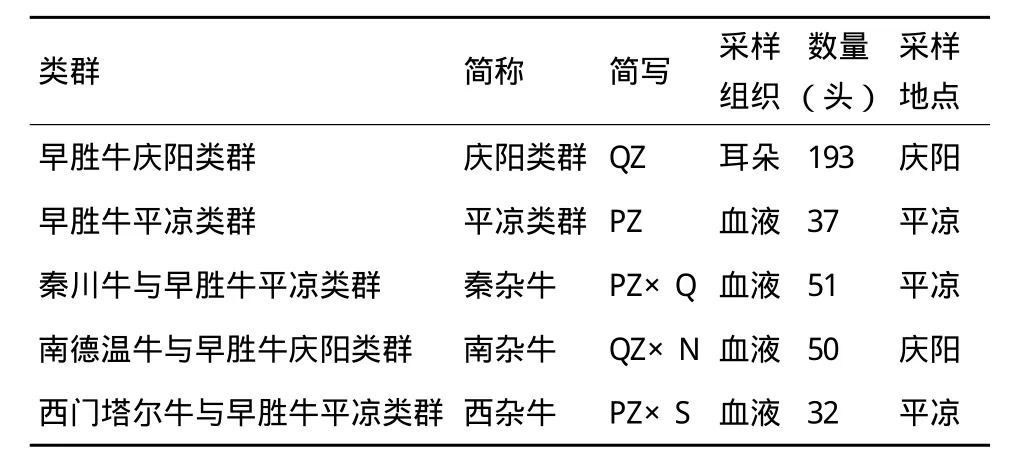
表1 样品信息
1.1.2 肉用性状指标 随机选取平凉类群37头和西杂牛32头进行胴体性状(宰前活重,胴体重,屠宰率,净肉率,胴体背膘厚,眼肌面积)和肉质性状(失水率,大理石花纹等级,肉色,剪切力,pH和蒸煮损失)测定,所检测牛为相同管理条件下无亲缘关系的22月龄健康公(阉)牛,肉用性状的测定方法参照《养牛学》[16]。
1.2 方法
1.2.1 引物设计与PCR反应体系 根据EMBL(ENSBTAT00000000079)公布牛A-FABP基因全序列,利用Primer Premier 5.0软件设计A-FABP基因外显子3引物,预期扩增片段长度219bp,引物由上海生工生物工程有限公司合成。引物序列 F:5'-ATTATCCCCACAGAGCATCG-3',R:5'-TTTTCATTCTACAAGGGCGATT-3',PCR反 应 体 系为 25μL :其 中 Premix Taq 12.5μL(1.25U),DNA模版 1μL(100ng/μL),上下游引物各 0.5μL(10 pmol/μL),ddH2O 10.5μL。反应条件 :94℃预变性 3min;94℃变性30s,59℃退火30s,72℃延伸30s,35个循环;72℃延伸10min,4℃保存。
1.2.2 PCR产物检测、变性及SSCP检测 PCR产物采用1%琼脂糖凝胶电泳进行检测。取2μL PCR扩增产物,加入8μL变性上样缓冲液(98%去离子甲酰胺、10mmol/L EDTA(pH8.0)、0.025%二甲苯氰FF、0.025%溴酚蓝),98℃变性10min,冰浴10min,采用 14% 丙烯酰胺凝胶((Acr∶Scr=29∶1)进行检测,180V电泳10h结束后银染。
1.2.3 序列测定及分析 根据SSCP分析结果,挑选不同基因型的PCR扩增产物送上海生工生物工程有限公司进行纯化并测序。用MEGA5软件将测序结果与GenBank(NM-174314.2)序列进行比对。
1.2.4 数据统计分析 运用PopGen32软件计算基因型频率、等位基因频率、纯合度(Ho)、杂合度(He)、有效等位基因数(Ne)、并进行群体内基因型分布的Hardy-Weinberg平衡检验,采用PIC软件计算多态信息含量(PIC);用卡方独立性检验分析基因型在种群间的分布,并配合下列模型进行最小二乘方差分析,比较各性状在不同基因型之间的差异,用SPSS19.0的一般线性模型(General linear model,GLM)过程完成。统计模型为:Yij=μ+GENi+GROj+(GEN×GRO)ij+eij其中,Yij为个体某性状表型值;μ为群体均值;GENi为基因型效应;GROj为类群效应;(GEN×GRO)ij为基因型与类群的互作效应;为eij为随机误差。
2 结果
2.1 A-FABP基因PCR产物扩增结果
牛A-FABP基因PCR扩增产物经2%琼脂糖凝胶电泳检测(图1),片段条带清晰,无杂带,特异性较好,可用于SSCP检测。
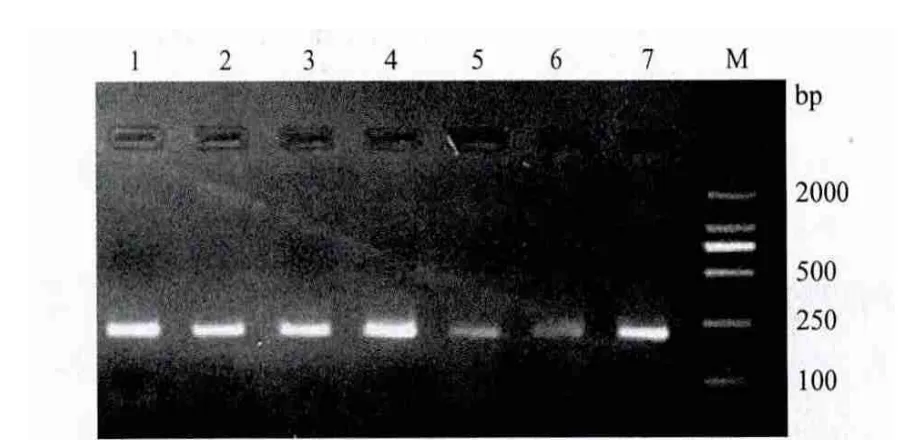
图1 A-FABP基因PCR扩增产物检测
2.2 SSCP电泳结果及测序分析
SSCP结果(图2)发现3种带型,推测为3种基因型,3种基因型的测序结果与NCBI数据库公布的原始序列(NM-174314.2)进行比对,结果在A-FABP基因第3外显子G408>C处发现一个突变位点,即G→C碱基突变(图3)。

图2 A-FABP基因SSCP检测结果
2.3 A-FABP基因遗传多态性分析
根据SSCP检测结果进行分析发现(表2),除西杂牛GC基因型频率高于GG基因型频率外,其他4个类群GC基因型频率均低于GG基因型频率,高于CC基因型频率。在5个早胜牛类群中,G等位基因频率均高于C等位基因型频率为优势等位基因。χ2适合性检验表明,庆阳类群和秦杂牛c.408G>C位点χ2值达到显著水平,表明其基因型分布处于Hardy-Weinberg非平衡状态(P<0.05),而其他3个类群的基因型分布处于Hardy-Weinberg平衡状态(P<0.05)。
χ2独立性检验结果(表3)表明,西杂牛与平凉类群基因型分布差异显著(P<0.05),与庆阳类群、秦杂牛、南杂牛差异极显著(P<0.01);其他类群间基因型分布差异不显著(P>0.05)。
A-FABP基因c.408G>C位点在5个类群中的纯合度(Ho)、杂合度(He)、有效等位基因数(Ne)和多态信息含量(PIC)见表4。庆阳类群和平凉类群PIC<0.25,处于低度多态。其他3个类群均处于中度多态(0.25<PIC<0.5)。
2.4 基因型与胴体、肉质性状的相关性分析

图3A-FABP基因不同基因型序列分析
对屠宰牛的6个胴体性状(包括宰前活重、胴体重、屠宰率、净肉率、胴体背膘厚、眼肌面积)按A-FABP基因外显子3基因型分型后进行方差分析,结果(表5)表明,GG基因型胴体重显著低于CC基因型(P<0.05);GG基因型屠宰率极显著低于GC基因型(P<0.01),显著低于CC基因型(P<0.05);GG基因型净肉率显著低于GC基因型(P<0.05);GG基因型眼肌面积显著低于GC和CC基因型(P<0.05),GC和CC基因型之间差异不显著(P>0.05)。其他性状在3个基因型间的差异不显著(P>0.05)。
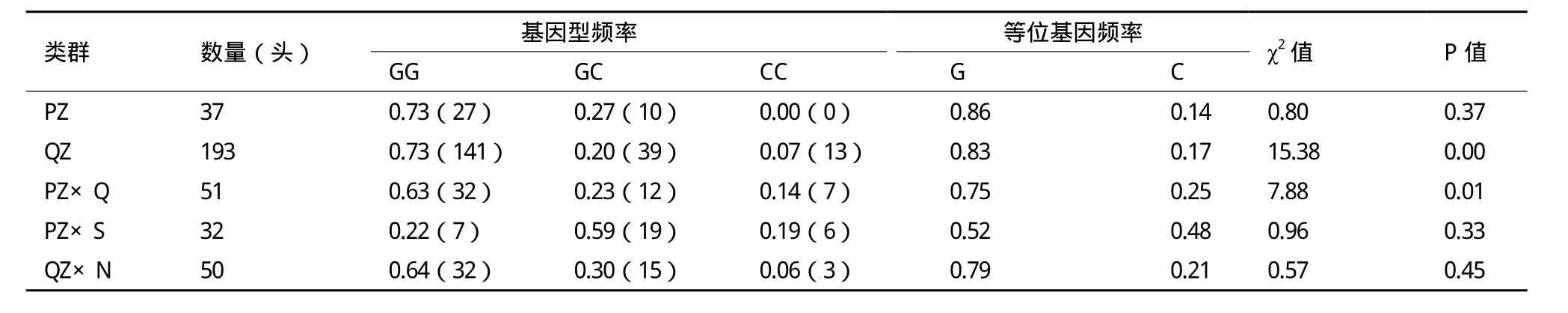
表2 A-FABP基因基因型频率和基因频率
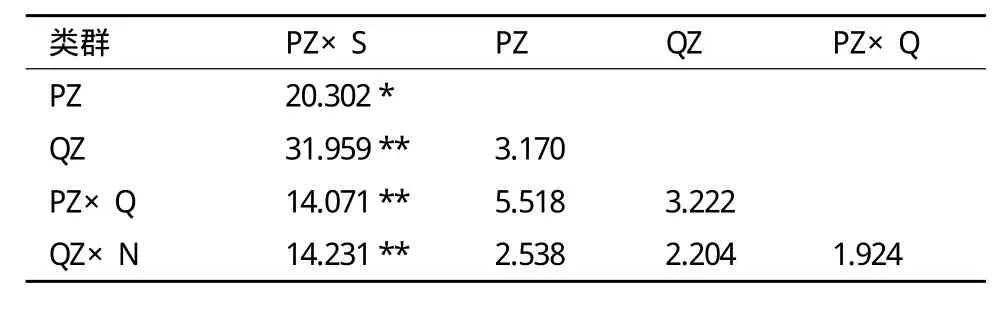
表3 5个牛类群A-FABP基因外显子3基因型分布的独立性检验
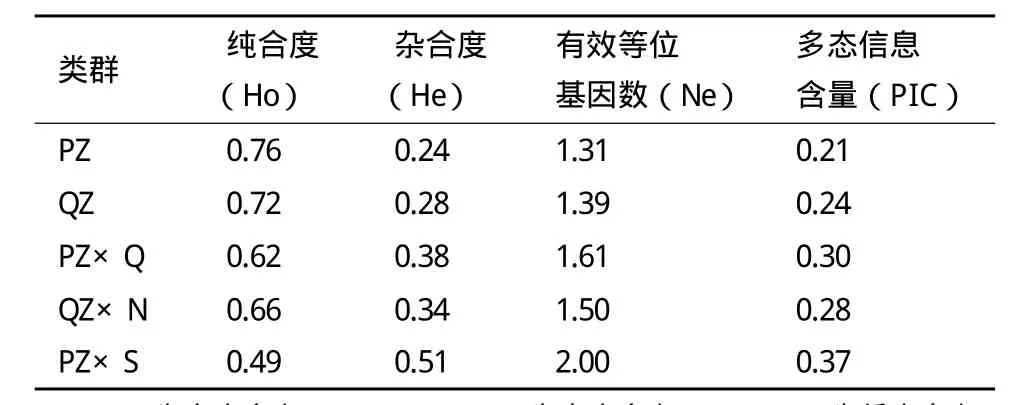
表4 5个牛类群A-FABP基因外显子3遗传多态性分析
对屠宰牛的6个肉质性状(包括失水率、大理石花纹、肉色、剪切力、蒸煮损失、pH)按A-FABP基因外显子3基因型分型后进行方差分析,结果(表6)表明,GG基因型失水率显著高于CC基因型(P<0.05);GG基因型剪切力极显著高于GC和CC基因型(P<0.01),GC和CC基因型之间差异不显著;GG基因型蒸煮损失和pH均显著高于GC基因型(P<0.05),极显著高于CC基因型(P<0.01)。大理石花纹和肉色在3个基因型间的差异不显著(P>0.05)。
3 讨论
3.1 A-FABP基因外显子3多态性及群体遗传分析
牛A-FABP基因多态性研究发现秦川牛A-FABP基因第1内含子和第4外显子上存在突变,而第3外显子相对保守[9],也有研究认为秦川牛、南阳牛、鲁西牛、夏南牛和郏县红牛A-FABP基因5'侧翼区、第2和3外显子及3'侧翼区都有变异[17],在朝鲜牛的2、3、4外显子也存在突变位点[18]。本研究对5个早胜牛类群A-FABP基因第3外显子(c.408G>C)多态性检测发现,除平凉类群不含CC型外,其他类群3种基因型(GG、GC和CC)都存在,即在AFABP基因编码区检测到G/C,与朝鲜牛A-FABP基因第3外显子上检测到的突变相同[18]。该研究结果在平凉类群没有检测到CC基因型,这种基因型分布的差异可能是由于平凉类群不同于其他4个类群的遗传特性,CC基因型非优势基因型,在长期的自然选择或人工选择中被淘汰。
经卡方检验,西杂牛与平凉类群基因型分布差异显著(P<0.05),与庆阳类群、秦杂牛、南杂牛差异极显著(P<0.01),这进一步证实了不同群体间遗传特性的差异,由于群体间遗传背景本身存在较大的差异,在选育过程中不同等位基因的间接选择压力不同,遗传变异程度不同。多态信息含量(PIC)、有效等位基因数(Ne)和杂合度(He)都是衡量群体内遗传变异大小的指标,这些数值在大小上均有一致性,多态信息含量大,有效等位基因数和杂合度就相对较大[19]。这3个参数较大时说明群体在该位点的变异性高,有较大的选择潜力,可以尝试利用该位点进行标记辅助选择。遗传多态性分析结果表明,平凉类群和庆阳类群的PIC分别为0.21、0.24,属于低度多态(PIC<0.25)。南杂牛、秦杂牛和西杂牛 PIC分别为 0.37、0.28、0.30、0.37,均处于0.25-0.5之间,属于中度多态,说明A-FABP基因编码区G408C位点可以进行标记辅助选择。χ2适合性检验表明,庆阳类群和秦杂牛处于Hardy-Weinberg非平衡状态,说明该类群自然选择或者人工选择对该基因分布的影响较大,造成其分布的不平衡,这可能与育种的个体选择有关。其他3个类群均处于Hardy-Weinberg平衡状态状态,说明这3个类群的牛已经形成了适应各自生存环境的遗传特性,该突变位点在所在群体内能够稳定遗传。
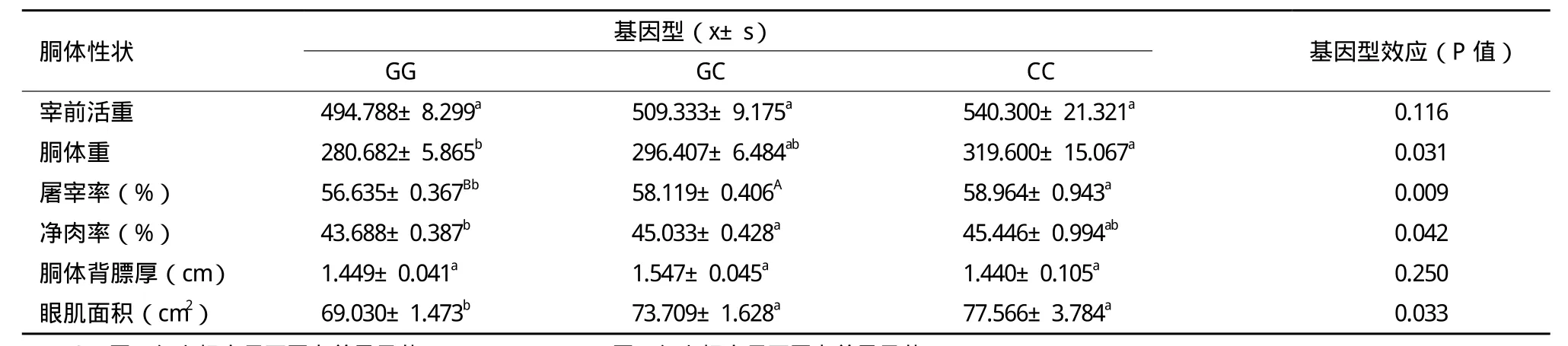
表5 A-FABP基因c.408G>C位点多态性与胴体性状的关联分析
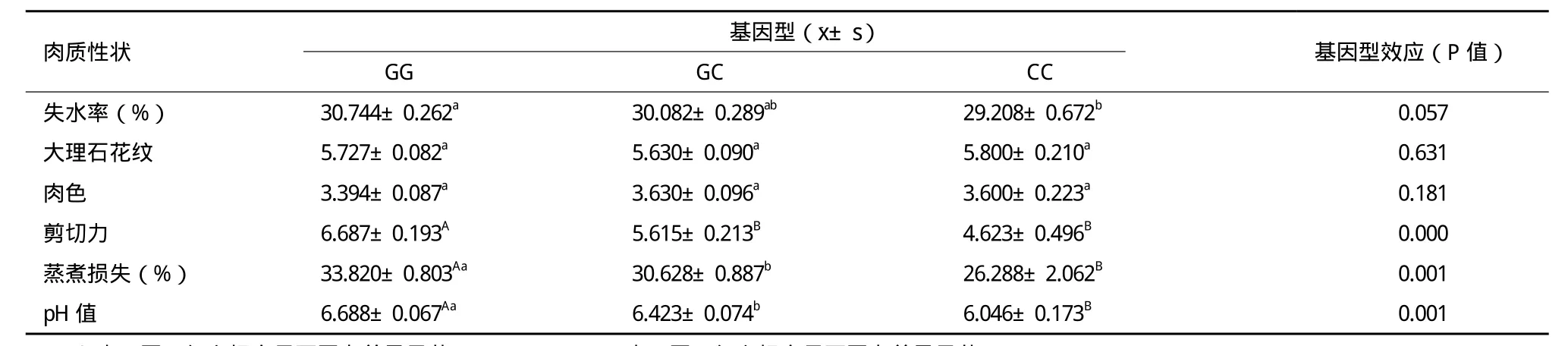
表6 A-FABP基因c.408G>C位点多态性与肉质性状的关系
3.2 基因多态性与肉质性状的关系
A-FABP基因被认为是影响动物肌内脂肪含量的重要候选基因[10]。沉积在肌肉内的脂肪,即肌内脂肪(Intramuscular fat,IMF)含量与肉的嫩度和风味有直接关系[20]。鉴于A-FABP基因对肉质性状的重要作用,目前国内外展开了该基因在各种牛群体上的研究。王卓[9]对秦川牛A-FABP基因第1内含子和第4外显子上发现的多态位点进行了分型及其与肉质性状关联性分析,发现第1内含子的突变位点与背膘厚、嫩度、大理石花纹等指标存在相关,第4外显子的GG基因型个体的背膘厚、大理石花纹、嫩度都显著高于CC基因型。刘艳妍[17]认为5'侧翼区的突变对肉牛的产肉性状影响较大,外显子2的SNPs与屠宰率、嫩度、胴体长和眼肌面积等相关,外显子3的SNPs与眼肌面积相关,3'侧翼区SNPs与牛胴体深相关。Cho等[13]发现A-FABP基因外显子2的SNPs与牛背部脂肪厚度相关。Lee等[14]发现,朝鲜牛A-FABP基因外显子3的一个同义突变位点对牛肉大理石花纹有显著影响。Barendse等[21]发现,FABP4基因的第3外显子和第3内含子之间存在一个剪接位点突变,该SNP与澳大利亚牛肌间脂肪沉积显著相关。
在本研究中,A-FABP基因第3外显子G408C位点与 Lee等[14]和 Barendse等[21]研究的突变位点一致,但该同义突变位点对大理石花纹的影响未达到显著水平,这与报道的结果并不一致,可从其他位点研究A-FABP基因SNPs与大理石花纹等级的相关性。本研究的位点突变为同义突变,没有引起相应氨基酸序列的变化,但由于碱基序列发生了变化,从而影响mRNA本身的翻译速度,改变蛋白质的表达质量,甚至会导致蛋白质的空间结构发生变化,进而影响其功能的发挥[22]。本研究A-FABP基因SNPs在5个不同早胜牛类群的分布上存在一定差异,并与胴体重、净肉重、屠宰率、净肉率、眼肌面积、剪切力、失水率、蒸煮损失和pH等指标有关。本研究A-FABP基因第3外显子区域SNPs与胴体重、屠宰率、净肉率、眼肌面积、剪切力、失水率、蒸煮损失和pH等指标的关联性分析在已查阅的文献中也未见报道,结果可为后续试验提供相应的数据参考。对A-FABP基因的遗传突变位点与试验牛群体胴体品质和肉质性状等主要经济性状进行关联分析,所得试验结果表明A-FABP基因位点SNPs可作为选育和加强胴体和肉质性状遗传效应的分子标记。
4 结论
在A-FABP基因外显子3检测到一个突变位点,不同基因型间牛的胴体和肉质性状存在较大差异,可作为对牛胴体品质和肉质性状选育的遗传标记。
[1]Hertzel AV, Bennaars-Eiden A, Bernlohr DA. Increased lipolysis in transgenic animals over expressing the epithelial fatty acid binding protein in adipose cells[J]. Lipid Res, 2002, 43:2105-2111.
[2]Wulf DM, Tatum JD, Green RD, et a1. Genetic influences on beef longissimus palatability in charolais-sired and limousin-sired steers and heifers[J]. Anim Sci, 1996, 74:2394-2405.
[3]罗桂芬, 陈继兰, 文杰, 等. 鸡A-FABP基因多态性分析及其与脂肪性状的相关研究[J]. 遗传, 2006, 28(1):39-42.
[4]李桢, 储明星, 曹红鹤, 等. 中外11个猪种A-FABP基因微卫星遗传变异的研究[J]. 遗传, 2004, 26(4):473-477.
[5]叶满红, 文杰, 曹红鹤, 等. 脂肪型脂肪酸结合蛋白基因多态性与鸡肉品质性状的关系研究[J]. 畜牧兽医学报, 2007, 38(6):526-532.
[6]叶满红. 鸡脂肪酸结合蛋白基因的克隆及其与肌内脂肪的关系[D]. 北京:中国农业科学院, 2003.
[7]赵旭庭, 段修军, 董飚, 等. 鸭A-FABP基因单核苷酸多态性分析及其与体脂性状相关的研究[J]. 扬州大学学报:农业与生命科学版, 2009, 30(1):38-41.
[8]王存芳. 猪H-FABP和A-FABP基因的多态性及其与肌内脂肪性状关系的研究[D]. 泰安:山东农业大学, 2002.
[9]王卓 . 秦川牛 H-FABP、A-FABP和 E-FABP基因SNPs及其与部分肉用性状关联分析[D]. 杨凌:西北农林科技大学,2005:35-36.
[10]Michal JJ, Zhang ZW, Gaskins CT, et al. The bovine fatty acid binding protein 4gene is significantly associated with marbling and subcutaneous fat depth in Wagyux limousin F2crosses[J]. Anim Genet, 2006, 37:400-402.
[11]王金浩, 文生萍, 饶华, 等. 影响牛肉品质的主效基因[J].
云南农业大学学报, 2008, 23(5):693-696.
[12]Armstrong MK, Bernlohr DA, Strorch J, et al. The purification and characterization of a fatty acid binding protein specific to pig adipose tissue[J]. Biochem, 1990, 267(2):373-378.
[13]Cho S, Park TS, Yoon DH, et al. Identification of genetic polymorphisms in FABP3and FABP4 and putative association with back fat thickness in Korean native cattle[J]. BMB Reports,2008, 41(1):29-34.
[14]Lee SH, Vander Werf JHJ, Lee SH, et al. Genetic polymorphisms of the bovine Fatty acid binding protein 4 gene are significantly associated with marbling and carcass weight in Hanwoo(Korean Cattle)[J]. Animal Genetics, 2010, 41:1365-2052.
[15]Sambrook J, Fritsch EF, Maniatis T. Molecular cloning:A laboratory manual[M]. 2nd. Beijing:Science Press, 1994:464-467.
[16]王根林. 养牛学[M]. 北京:中国农业出版社, 2000.
[17]刘艳妍. 牛A-FABP基因的多态性及其与秦川牛肉用性状的关联分析[D]. 杨凌:西北农林科技大学, 2010.
[18]Oh DY, Lee YS, La BM, et al. Identification of the SNP(single nucleotide polymorphism)for fatty acid composition associated with beef flavor-related FABP4(fatty acid binding protein 4)in Korean cattle[J]. Anim Sci, 2012, 25:913-920.
[19]Chakraborty R, Zhong Y, de Andrade M. Linkage disequilibria among(CA)polymorphism in the human dystrophin gene and their implications in carrier detection and prenatal diagnosis in duchenne and becker muscular dystrophies[J]. Genomics, 1994,21:567-570.
[20]Wood JD. 34thInternational Congress of Meat Science and Technology. Brisbane, Australia, 1988:562-564.
[21]Barendse W, Bunch RJ, Thomas MB, et al. A splice site single nucleotide polymorphism of the fatty acid binding protein 4gene appears to be associated with intramuscular fat deposition in longissimus muscle in Australian cattle[J]. Anim Genet, 2009,40:1365-2052.
[22]Kimchi-Sarfaty C, Oh JM, Kim IW, et al. A“Silent”polymorphism in the MDR1 gene changes substrate specificity[J]. Animal Science, 2007, 315(5811):525-528.
