玉米ZmCI-1B启动子及其7个5'端缺失体在转基因拟南芥中的活性分析
2014-09-14李业柳小庆李素贞周晓今杨文竹陈茹梅
李业 柳小庆 李素贞 周晓今 杨文竹 陈茹梅
启动子在基因的功能研究及基因工程领域中扮演着重要的角色。目前转基因研究中使用的启动子大多是组成型的强启动子,如花椰菜花叶病毒CaMV35S启动子和玉米 pUbi启动子等[1,2]。但是,组成型启动子在应用中也渐渐显现出了一些问题。因为组成型启动子使目的基因在植物中全方位表达,这势必会对宿主植物的正常生长发育甚至环境造成不良影响[3,4]。组织特异性的启动子将目的基因的表达限定在特定的组织或器官中,在一定程度上避免了组成型启动子的弊端,因此受到了越来越多的关注。目前,大量的组织特异性启动子已经被分离并报道,主要包括根特异性启动子[5-7],茎特异性启动子[8,9],叶片特异性启动子[10],花粉、花药特异性启动子[11-14],果实、种子特异性启动子[15-18],胚特异性启动子等[19,20]。但是,能像CaMV35S启动子一样在植物基因工程中得到广泛应用的组织特异性启动子却仍未见报道。
在研究玉米组织特异性启动子的过程中,本实验室筛选到一个特殊的启动子——枯草杆菌蛋白酶-糜蛋白酶抑制剂(Subtilisin-chymotrypsin inhibitor,CI-1B)基因,即ZmCI-1B基因的启动子。将全长2 kb的ZmCI-1B启动子从玉米自交系B73中分离出来并转化玉米,转基因玉米植株的GUS染色结果表明,全长启动子在玉米的根和胚中有较高的表达活性。为了进一步分析启动子的调控特性,构建了一系列的5'端缺失的启动子片段,以期利用5'端缺失法来研究启动子的功能。
由于拟南芥具有基因组简单,遗传转化效率高等特点,而被广泛用于植物的基因功能的研究中。因此,本研究将先前构建好的ZmCI-1B基因的全长启动子及其7个5'端缺失体转化到拟南芥中,通过GUS组织化学染色的方法来分析ZmCI-1B启动子在拟南芥中驱动GUS基因的表达情况,以此来探究ZmCI-1B 启动子的功能;同时也为下一步比较ZmCI-1B 启动子在单子叶和双子叶植物中功能活性的差异奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 拟南芥生态型为哥伦比亚野生型,由本实验室保存。
1.1.2 菌株和质粒 根癌农杆菌GV3101由中国农业科学院生物技术研究所提供。P2000-GUS,P1430-GUS,P1040-GUS,P800-GUS,P537-GUS,P348-GUS,P249-GUS,P220-GUS是将 pCAMBIA3301的 35S启动子分别用ZmCI-1B全长启动子(P2000)以及7个5'端缺失的启动子序列(P1430,P1040,P800,P537,P348,P249,P220)替换而得到的重组表达载体。各个启动子构建的简图见图1。载体上携带β-葡萄糖苷酸酶基因(GUS)及bar基因。以上质粒均由本实验室保存。

图1 启动子缺失表达载体的示意图
1.1.3 试剂 卡那霉素、庆大霉素及利福平均为Sigma公司产品;Taq DNA聚合酶、dNTP 为上海博彩生物科技有限公司产品;MS 粉末、植物凝胶购于北京西美杰科技有限公司;蔗糖及其它试剂为国产分析纯。
1.2 方法
1.2.1 质粒转化 用热击法将P2000-GUS,P1430-GUS,P1040-GUS,P800-GUS,P537-GUS,P348-GUS,P249-GUS和P220-GUS 8个质粒分别转化到根癌农杆菌GV3101感受态细胞中。以pCAMBIA3301序列上特异引物3301F/3301R,进行菌落PCR鉴定。引物序列见表1。PCR阳性的单菌落,继代培养,保菌于-80℃冰箱。各包含有表达载体的农杆菌菌株分别命名为GV2000,GV1430,GV1040,GV800,GV537,GV348,GV249,GV220。
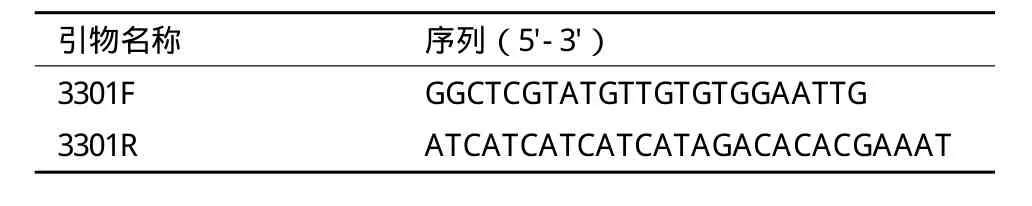
表1 菌落PCR鉴定阳性克隆所用引物
1.2.2 农杆菌介导的拟南芥转化
1.2.2.1 拟南芥种子的播种及植株培养 将20μL拟南芥种子用加有0.05%吐温-20的75%乙醇消毒10min;再吸弃乙醇,加入无水乙醇,与种子混合后,倒在滤纸上。晾干后的种子,用镊子蘸取平铺在MS培养基上,用封口膜封口,放入4℃冰箱内春化2-3d。而后在22℃,16h昼/ 8h夜的光周期条件下培养7-14d。当幼苗长出四片真叶时,移栽到配制的营养土中(蛭石∶营养土=1∶3),继续在22℃,16h昼/8h夜的光周期条件下培养,待拟南芥长到开花期时进行侵染。
1.2.2.2 农杆菌的培养 从-80℃冰箱取出GV2000,GV1430,GV1040,GV800,GV537,GV348,GV249和 GV220农杆菌菌种,以1/100的体积比,接菌到200mL包含卡那霉素和利福平的YEB培养基中,28℃,200r/min培养36h。当测得0D600=0.8-1.6时,5000r/min,5min离心收集菌体。然后吸弃上清,用5%的蔗糖(含有0.02% Silwet L-77)重悬菌体,稀释至OD600=0.6-0.8即可用作拟南芥侵染。
1.2.2.3 拟南芥转化 拟南芥转化采用花序侵染法。将拟南芥的主花序的顶端剪掉,以诱导侧花序的生成,并使侧花序同时开花,以便于转化。侵染步骤为:先将拟南芥的花序浸没在侵染液中,约20s;然后将拟南芥平放到盘子里;并用薄膜覆盖保湿,暗培养1d。第2天放于长日照培养室培养。5-7d以后,按上述操作再侵染1次,一般侵染3-4次。待侵染后的拟南芥成熟后,收获种子,充分干燥后储存。
1.2.2.4 种子的筛选 分别收获转化后的T0代种子。种子灭菌后,平铺在含10mg/L草铵膦的1/2MS固体培养基上。在4℃条件下,春化2-3d,然后在温室中正常见光培养。生长1周后的绿色植株可能是T1代阳性植株(阴性植株叶片变黄),将绿色植株进行土培。正常开花结实后的植株,分单株收获种子,得到T2代。
1.2.2.5 PCR验证 取转基因拟南芥T0代及野生型植株的叶片组织,用CTAB法提取基因组DNA进行PCR验证。PCR扩增的引物由博迈德公司合成,引物序列见表2。以拟南芥叶片基因组DNA为模板,用F/R为引物,用普通Taq酶进行PCR扩增反应。PCR反应条件为:94℃预变性5min;94℃变性30s,65℃退火30s,72℃延伸15s,共32个循环;72℃延伸10min。扩增产物为220bp,反应产物用1.2%的琼脂糖凝胶电泳检测。
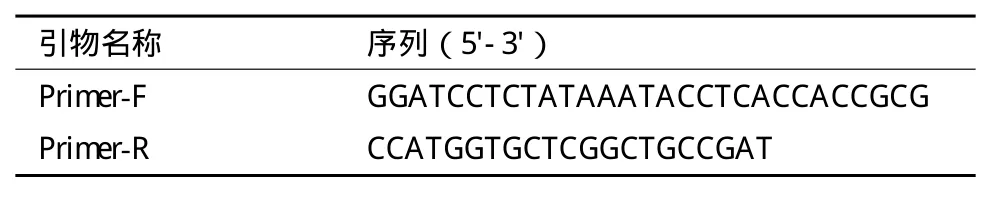
表2 转基因拟南芥PCR检测所用引物
1.2.3 GUS组织化学染色 将拟南芥组织浸泡在GUS染色液中[1mmol/L X-Gluc,100mmol/L 磷酸氢二钠,10mmol/L EDTA,1mmol/L 铁氰化钾,0.1%(V/V)的Triton X-100,2% DMSO,pH7.0],在 37℃下孵育3-8h。然后用100%乙醇进行脱色。每个样本重复染色3次,最后用体视显微镜观察,并拍照。
2 结果
2.1 质粒DNA转化农杆菌的PCR检测
采用热击法将8种质粒分别转化农杆菌GV3101感受态细胞,然后将恢复培养后的转化体系菌液涂布在含有Kan、Gen、Rif的YEB固体培养基平板上。待有单个菌落长出后,每个转化体挑取4个单菌落进行菌落PCR来鉴定阳性克隆。从图2(部分检测结果)可以看出,挑取的单克隆均扩增出特异目的条带,说明各个质粒均已转化到农杆菌中,这些重组菌体均可用作拟南芥的遗传转化。
2.2 转基因拟南芥植株的获得
为了在拟南芥中研究ZmCI-1B启动子以及其各种缺失的片段的功能,通过浸花法将8种质粒转化到拟南芥中。获得的T1代种子灭菌后,平铺在含10mg/L草铵膦的1/2MS固体培养基上进行筛选。4℃冰箱内春化2d,然后在温室中正常见光培养。生长1周后,能长出绿色叶片,并且有1-2cm长的白色主根的植株是抗性植株;阴性植株叶片萎蔫变黄。将绿色植株进行土培,能正常健壮生长的初步认定为阳性植株。最终获得P2000转基因拟南芥幼苗11株;P1430转基因拟南芥幼苗7株;P1040转基因拟南芥幼苗10株;P800转基因拟南芥幼苗6株;P537转基因拟南芥幼苗15株;P348转基因拟南芥幼苗12株;P249转基因拟南芥幼苗12株;P220转基因拟南芥幼苗22株。
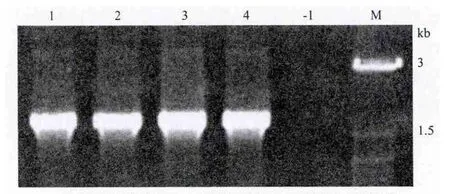
图2 质粒DNA转化农杆菌的PCR检测
2.3 转基因植株的PCR检测
提取T1代各株系的叶片基因组DNA进行PCR检测。从图3可以看出,选取的各株系(部分株系)均有一条特异的扩增条带,而且条带的大小与质粒阳性对照获得的条带相同;同时,野生型拟南芥作为阴性对照的泳道没有扩增条带,这说明从筛选培养基上筛选出的阳性株系的确为转基因株系。
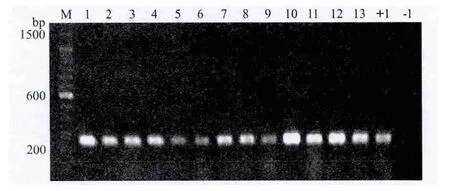
图3 转基因拟南芥植株的部分PCR检测结果
2.4 转基因拟南芥植株的GUS组织化学染色分析
为了分析ZmCI-1B全长启动子及其7个5'端缺失的启动子在转基因拟南芥中启动子活性与组织特异性,分别检测幼苗期,开花期及角果成熟期3个时期的T2代转基因拟南芥植株中的报告基因GUS的表达情况。同时取野生型拟南芥植株做同样的处理,作为对照。每个包含启动子片段的表达载体均选取4个T1代转基因拟南芥株系。各个株系分别收获种子,并播种;正常生长之后,取T2代植株的幼苗、花器官及角果进行GUS染色。GUS染色结果表明,每个表达载体各个株系的GUS染色模式均一致。
从图4-A可以看出,全长启动子P2000驱动的GUS基因只在转基因拟南芥幼苗的叶片和上胚轴中有表达。从图4-B、E、G可以看出,P1430、P537、P249驱动的GUS基因在转基因幼苗叶和根中均有表达,但在上胚轴却没有表达。但是1040bp的缺失片段在幼苗期拟南芥中完全丧失了启动子活性(图4-C)。而800bp和348bp的缺失片段可驱动GUS基因分别特异的在幼苗期拟南芥根和上胚轴中表达(图4-D,F)。当ZmCI-1B截短到220bp时,此缺失片段驱动的GUS基因可在幼苗期的各个组织中表达(图4-H)。
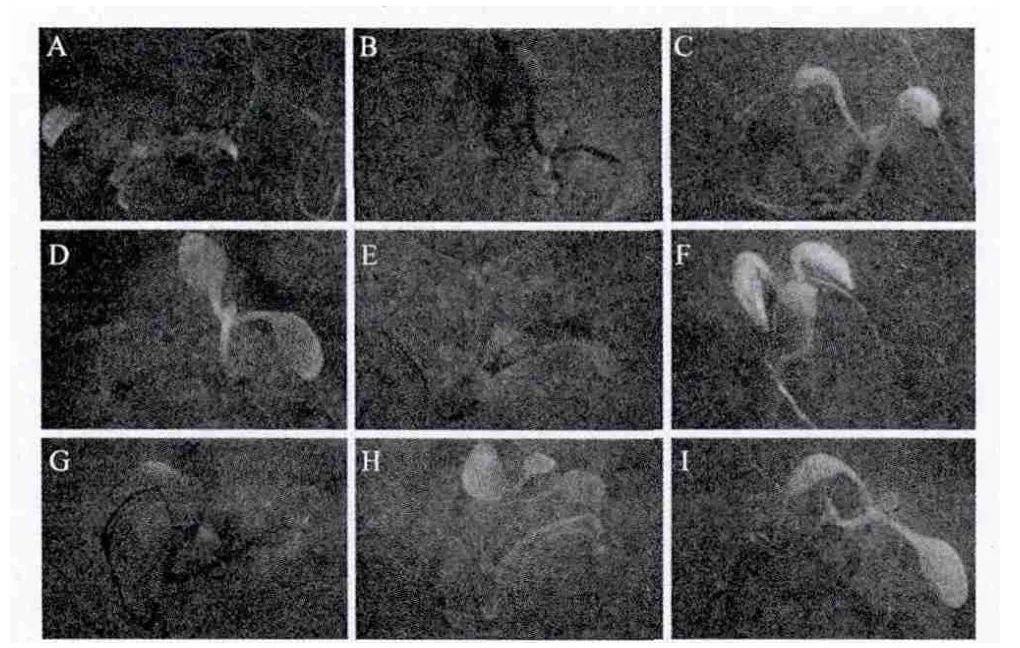
图4 转基因拟南芥T2代生长10d的幼苗的GUS染色
从图5可以看出,除1430bp、1040bp、537bp的缺失片段外,其他缺失片段以及全长的ZmCI-1B启动子在花器官中均无活性(图5-A,D,F-H)。1430bp缺失片段在柱头和花瓣中有活性(图5-B),1040bp缺失片段在柱头、花药和花瓣中有启动子活性,537bp缺失片段只在柱头具有启动子活性(图5-C)。
从图6可以看出,全长启动子ZmCI-1B与其800bp的缺失片段在转基因拟南芥角果中均无启动子活性(图6-A,E),而P1430在转基因拟南芥在角果的果瓣中有较强的启动子活性(图6-B);而P1040驱动的GUS只在角果的端部有表达(图6-C);其余缺失片段P537、P348、P249、P220在果瓣中也有启动子活性,但是其活性比P1430弱。
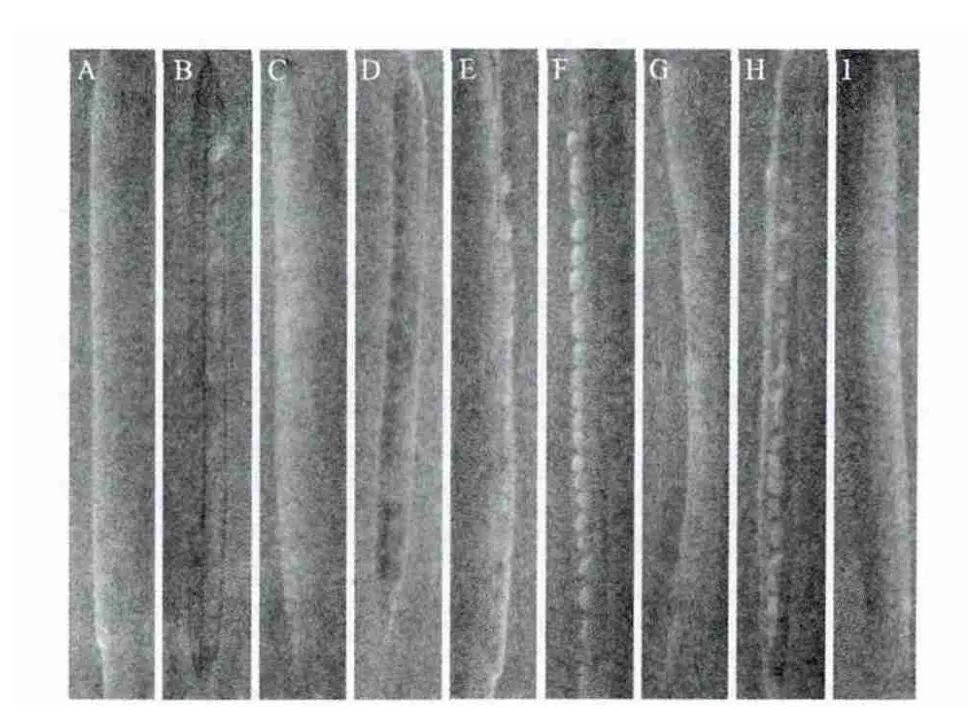
图6 转基因拟南芥T2代角果的GUS染色
3 讨论
组织特异性启动子能将目的基因的表达限定在特定的组织或器官中,不仅增加了基因在特定区域的表达量,同时也避免了植物营养的不必要的浪费。因此,组织特异性启动子在植物的基因工程领域中具有重要的应用价值[21]。其它研究工作表明(尚未发表),ZmCI-1B基因的启动子在玉米的根和胚具有较高的调控活性,有望成为玉米中有组织特异性的候选启动子。
通过PLANTCARE数据库分析表明,在2kb的ZmCI-1B启动子序列上存在着多种顺式作用元件,包括与基因时空表达相关的元件,如与根、叶片、种子、花药等组织特异性相关的元件ROOTMOTIFTAPOX1,DPBFCOREDCDC3,POLLEN1LELAT52,CACTFTPPCA1等;与植物生理代谢或外界环境响应有关的元件,如MYBCORE、ABRERATCAL等;与激素应答有关的元件,如ABRELATERD1和SBOXATRBCS等;与转录激活、增强或抑制有关的元件,如CTRMCAMV35S等。5'端缺失法是目前常用的研究启动子功能的方法。我们根据全长启动子(P2000)上预测的顺式作用元件的分布和位置,设计了7个5'端缺失的启动子片段,即P1430、P1040、P800、P537、P348、P249和 P220。由于目前玉米的遗传转化效率较低,而拟南芥是研究基因功能的模式植物。因此,本试验通过拟南芥转化的方式对ZmCI-1B启动子及7个5'端缺失的启动子片段的功能活性进行分析。
从转基因拟南芥植株不同组织的GUS染色结果来看,全长启动子及7个5'端缺失的启动子片段在启动GUS报告基因的表达部位存在着明显的差异(表3);不同长度的ZmCI-1B启动子缺失片段具有不同类型的组织特异性。全长启动子ZmCI-1B只在拟南芥的叶片和上胚轴中有启动子活性,而在其它组织中均没有活性。而其最短的5'缺失片段P220,在拟南芥的叶、上胚轴、根及果瓣中均表现出启动子活性,说明这220bp的缺失片段仍然包含有启动子的核心启动子元件。通过PLANTCARE数据库预测,在220bp的序列内也的确包含有核心启动子必需的元件TATABOX1,TATABOX2,CAATBOX1以及与根特异性表达相关的元件ROOTMOTIFTAPOX1,与叶肉表达相关的元件ANAERO2CONSENSUS。另外也说明,截去的1780bp序列中包含有一些组织特异性负调控元件。
比P220的长29bp的P249缺失片段与P220相比,其驱动GUS的表达部位与P220类似,即都在根、叶及果瓣中表达,但是其驱动的GUS在上述组织的表达水平要比P220高,说明在220bp到249bp之间的29bp可能存在某些增强基因转录的基序;另外,其在上胚轴中的启动子活性失去了,也说明那29bp的序列中可能存在抑制上胚轴中表达的负调控元件。而比P249长约100bp的P348缺失片段,只保留了在果瓣中的启动子活性,同时也恢复了在上胚轴中的活性,但是却丧失了在根和叶中的启动子活性。这说明在那100bp序列中存在上胚轴特异表达的正调控元件和抑制在根和叶表达的负调控元件。有趣的是,在比P3485'端长189bp的P537,恢复其在叶和根中启动子活性时,却失去了在上胚轴中的活性,这说明调控根和叶特异表达的元件与调控上胚轴特异表达的元件之间存在拮抗作用。而且这种拮抗作用也体现在调控花特异表达的元件与调控果瓣特异表达的元件之间。例如,在果瓣中有启动子活性的片段在花器官中却没有活性,但在花器官中有活性的片段却在果瓣中没有活性。
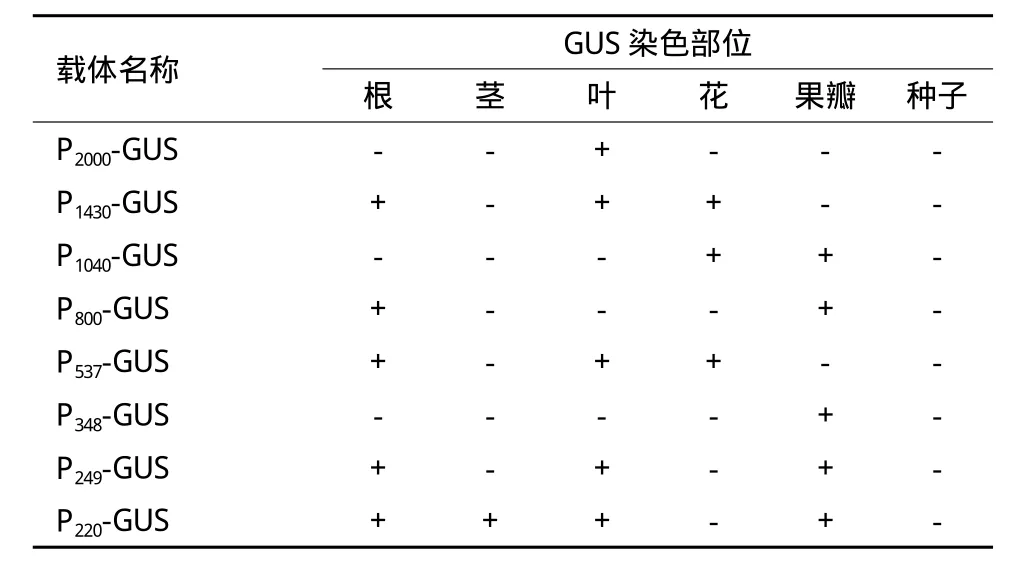
表3 转基因拟南芥植株的GUS染色结果
值得关注的是P800和P1040两个启动子缺失片段。P800只启动GUS在拟南芥的根和果瓣中表达,而在其他组织中均没有活性,表现出了根特异的启动子活性。比P800长240bp的P1040启动子在拟南芥的所有营养器官中均没有启动子活性,只在拟南芥的角果顶端有活性,却在花中有较高的活性,GUS染色主要集中于雌花的柱头、雄蕊及花瓣,因此P1040缺失片段表现出了花优先表达的启动子活性。在-1040bp到-1bp的序列内,预测有POLLEN1LELAT52元件存在,其是一个与花药特异性相关的顺式作用元件[22];POLLEN1LELAT52的存在可能与拟南芥在花药中具有较高的GUS表达有关。另外,这1040bp的序列内还应该存在着与花瓣特异表达相关的元件,然而数据库中并没有相关的注释信息,因此要确定这段序列内特异的顺式作用元件还需要进一步的试验探究。
另外,全长2kb的ZmCI-1B启动子能驱动GUS在转基因玉米的胚中高表达(数据未发表),而所有的启动子包括全长的及5'端缺失启动子的构建,在拟南芥的种子中均没有活性。其在转基因拟南芥植株中只在叶片和上胚轴中表达,但其1430bp的缺失片段却在除种子和上胚轴外的其它部位均有启动子活性,且活性有明显增强。说明截去的570bp序列中存在多种组织特异表达的负调控元件以及与启动子活性相关的抑制子。
有不少研究指出,将启动子转化到异源植物中,其组织特异性会发生变化[23,24]。全长2kb的ZmCI-1B启动子在拟南芥中具有叶特异性,这与在内源植物——玉米中的ZmCI-1B启动子活性不同(在玉米中则在根和胚中有较高的活性)。这说明单子叶植物的启动子在双子叶植物中其功能发生了变化,这可能是单双子叶植物的内源环境的不同造成的。因此,要最终确定ZmCI-1B启动子的功能活性还需要将各个缺失启动子转化玉米,在玉米中研究其功能。
4 结论
本研究以拟南芥为受体材料,将ZmCI-1B全长启动子以及7个5'端缺失的启动子片段利用花序侵染法转化拟南芥,并进行了GUS组织化学染色分析。结果表明,不同缺失的ZmCI-1B启动子在拟南芥的不同组织中具有不同调控功能,这与启动子上的顺式作用元件密切相关。ZmCI-1B启动子在拟南芥中的活性与内源植物——玉米中有差异。
[1]Anuar MR, Ismail I, Zainal Z. Expression analysis of the 35S CaMV promoter and its derivatives in transgenic hairy root cultures of cucumber(Cucumis sativus)generated by Agrobacterium rhizogenes infection[J]. African Journal of Biotechnology, 2013,10(42):8236-8244.
[2]Matsushita A, Inoue H, Goto S, et al. Nuclear ubiquitin proteasome degradation affects WRKY45 function in the rice defense program[J]. The Plant Journal, 2013, 73(2):302-313.
[3]Sade N, Gallé A, Flexas J, et al. Differential tissue-specific expression of NtAQP1 in Arabidopsis thaliana reveals a role for this protein in stomatal and mesophyll conductance of CO2under standard and salt-stress conditions[J]. Planta, 2014, 239(2):357-366.
[4]Pino MT, Skinner JS, Park EJ, et al.Use of a stress inducible promoter to drive ectopic AtCBF expression improves potato freezing tolerance whileminimizing negative effects on tuber yield[J].Plant Biotechnol J, 2007, 5(5):591-604.
[5]Li Y, Liu S, Yu Z, et al. Isolation and characterization of two novel root-specific promoters in rice(Oryza sativa L.)[J]. Plant Sci,2013, 207:37-44.
[6]Koehorst-van Putten HJJ, Wolters AMA, Pereira-Bertram IM, et al.Cloning and characterization of a tuberous root-specific promoter from cassava(Manihot esculenta Crantz)[J]. Planta, 2012, 236(6):1955-1965.
[7]Jeong JS, Kim YS, Baek KH, et al. Root-specific expression of OsNAC10 improves drought tolerance and grain yield in rice under field drought conditions[J]. Plant Physiology, 2010, 153(1):185-197.
[8]宋扬, 周军会, 张永强. 植物组织特异性启动子研究. 生物技术通报 , 2007(6):21-24.
[9]Noh SA, Lee HS, Huh GH, et al. A sweetpotato SRD1 promoter confers strong root-, taproot-, and tuber-specific expression in Arabidopsis, carrot, and potato[J]. Transgenic Research, 2012, 21(2):265-278.
[10]Su X, Xu WZ, Liu X, et al. The isolation and identification of a light-induced protein in alfalfa sprouts and the cloning of its specific promoter[J]. Gene, 2013, 520(2):139-147.
[11]Takayama S, Shiba H, Iwano M, et al. The pollen determinant of self-incompatibility in Brassica campestris[J]. Proc Natl Acad SciUSA, 2000, 97:1920-1925.
[12]Khurana R, Kathuria H, Mukhopadhyay A, et al. A 286bpupstream regulatory region of a rice anther-specific gene, OSIPP3, confers pollen-specific expression in Arabidopsis[J]. Biotechnology Letters, 2013, 35(3):455-462.
[13]Chen L, Miao Y, Wang C, et al. Characterization of a novel pollenspecific promoter from wheat(Triticum Aestivum L.)[J]. Plant Molecular Biology Reporter, 2012, 30(6):1426-1432.
[14]Oo MM, Bae HK, Nguyen TD, et al. Evaluation of rice promoters conferring pollen-specific expression in a heterologous system,Arabidopsis[J]. Plant Reproduction, 2014, 27(1):47-58.
[15]Prabhakar M, Das DK. Isolation &Characterization of a fruit specific promoter sequence of a thaumatin gene coding for fruit ripening protein differentially expressed in storage fruit[J].International Journal of Biotechnology and Allied Fields, 2013, 1(5):305-318.
[16]Song XL, Wu ZH, Zhang X, et al. Construction of expression vector with fruit-specific promoter and genetic transformation of strawberry[J]. Advanced Materials Research, 2013, 690:1314-1317.
[17]Kesanakurti D, Kolattukudy PE, Kirti PB. Fruit-specific overexpression of wound-induced tap1 under E8 promoter in tomato confers resistance to fungal pathogens at ripening stage[J].Physiologia Plantarum, 2012, 146(2):136-148.
[18]Li WX, Zhao HJ, Pang WQ, et al. Seed-specific silencing of OsMRP5 reduces seed phytic acid and weight in rice[J].Transgenic Research, 2014:1-15.
[19]Liu WX, Liu HL, Qu LQ. Embryo-specific expression of soybean oleosin altered oil body morphogenesis and increased lipid content in transgenic rice seeds[J]. Theoretical and Applied Genetics,2013, 126(9):2289-2297.
[20]Chong-Pérez B, Reyes M, Rojas L, et al. Excision of a selectable marker gene in transgenic banana using a Cre/lox system controlled by an embryo specific promoter[J]. Plant Molecular Biology,2013, 83(1-2):143-152.
[21]Ong CT, Corces VG. Enhancer function:new insights into the regulation of tissue-specific gene expression[J]. Nature Reviews Genetics, 2011, 12(4):283-293.
[22]Filichkin SA, Leonard JM, Monteros A, et al. A novel endo-beta-mannanase gene in tomato LeMAN5 is associated with anther and pollen development[J]. Plant Physiol, 2004, 134(3):1080-1087.
[23]Kuriakose B, Arun V, Gnanamanickam SS, et al. Tissue-specific expression in transgenic rice and Arabidopsis thaliana plants of GUS gene driven by the 5’regulatory sequences of an anther specific rice gene YY2[J]. Plant Science, 2009, 177(5):390-397.
[24]Urriola J, Rathore KS. Temporal and spatial activities of a rice glutelin promoter in transgenic sorghum[J]. Plant Cell, Tissue and Organ Culture(PCTOC), 2014, 116(2):227-234.
