针刺对糖尿病大鼠下丘脑弓状核IRS1/PI3K途径的影响
2014-09-13袁爱红鲍陶陶倪英群
袁爱红 鲍陶陶 倪英群 刘 剑
(安徽中医药大学第一附属医院内分泌科,安徽 合肥 210032)
近年研究显示,胰岛素不仅通过外周机制调节营养物质的储存和循环底物的释放,在大脑中也调节各种关键生理功能〔1~4〕。胰岛素的中枢作用是肝糖代谢的生理性决定因素,下丘脑胰岛素信号转导是肝糖合成所必需的。糖尿病对中枢胰岛素信号转导的影响尚在研究之中,文献研究认为,胰岛素受体底物1-磷脂酰肌醇3激酶-葡萄糖转运蛋白4(IRS1-PI3K-GLUT4)仍然是最可能的中枢胰岛素信号转导途径〔5〕。Komori等〔6〕研究发现胰岛素受体(INSR)和GLUT4高表达于下丘脑弓状核,认为下丘脑神经核团存在胰岛素诱导的葡萄糖转运系统。针灸治疗2型糖尿病(T2DM)有良好疗效〔7,8〕。既往的研究显示,针刺对链脲佐菌素(STZ)诱导的糖尿病大鼠下丘脑弓状核INSR有着良性调整作用〔9〕。在此基础之上,本研究将对糖尿病状态下的下丘脑弓状核胰岛素IRS1/PI3K信号通路进行探讨,同时探讨针刺对该通路的影响。
1 材料与方法
1.1动物 50只220~250 g SD雄性大鼠由安徽医科大学动物实验中心提供,饲养于安徽中医药大学SPF级实验中心。饲养环境:12 h光照~12 h黑夜,室温25℃~27℃,湿度50%。所有大鼠造模期间均自由摄食、饮水,饲料和水每日更换1 次。
1.2造模与分组 根据体重将大鼠随机分为普通饲料组(10只,简称为对照组)和高糖高脂饲料组(40只),喂养4 w后,将高糖高脂组大鼠腹腔注射STZ(sigma公司产品),将STZ溶于0.1 mol/L柠檬酸-柠檬酸钠缓冲液(pH 4.4),配成1%的溶液,以25 mg/kg剂量连续注射2 d,1 w后检测空腹血糖(FPG),FPG≥7.8 mmol/L即为T2DM大鼠(共20只)〔10〕。将造模成功的T2DM 大鼠随机分为针刺组和模型组各10只。
针刺组:将大鼠放入自制大鼠固定器中,75%酒精消毒后三里(相当于足三里)、内庭和胰俞,用36号华佗牌美容针分别刺入上穴,后三里和胰俞用平补平泻的捻转手法运针1 min,内庭穴用捻转泻法运针0.5 min,然后将G6805 Ⅱ型电针仪分别接于后三里和内庭穴,采用频率10 Hz、强度为1 mA 的连续波,每次选择一侧肢体的穴位,15 min/次,1次/d,两侧肢体交替选择。治疗6 d休息1 d,连续治疗4 w。
模型组和对照组与针刺组同样固定,但不针刺。在此期间所有大鼠均以SPF级全价鼠饲料喂养,自由摄食、饮水。
1.3标本采集 实验结束后,空腹过夜,于次日上午8时,以10%水合氯醛3 ml/kg腹腔注射麻醉。剪开胸腹腔,暴露心脏,左心室取血5 ml,室温静置1 h后,3 000 r/min离心5 min,分离血清置-20℃冰箱保存待测。断头处死,置冰碟上,快速分离下丘脑弓状核,置液氮中保存。强生血糖仪检测FPG,放免法检测血清胰岛素(FINs)。
1.4实时荧光PCR检测下丘脑弓状核INSR、IRS1、PI3K和GLUT4基因 ①RNA的提取:称取组织50~100 mg,剪碎,加入1 ml Trizol,使用组织匀浆器在冰上进行匀浆。4℃,10 000 r/min离心10 min,以去除未完全裂解的组织以及脂肪等。加入0.2 ml氯仿,剧烈振荡15 s,室温放置3 min。4℃ 10 000 r/min离心15 min,取上清(约500 μl)加入到另一EP管中。加入0.5 ml异丙醇,温和混匀,室温放置10 min。 4℃ 12 000 r/min离心10 min,弃去上清。加入1 ml 75%乙醇(DEPC水配制)。4℃ 7 500 r/min离心5 min,弃上清。室温放置30 min干燥RNA沉淀。加入20 μl DEPC水,55℃促溶10 min,-80℃保存备用。 ②RT反应:在0.2 ml EP管中,加入总RNA 8 μl、10 μmol/L Oligo(dT)1 μl、DEPC水3 μl,轻轻混匀、点动离心。PCR仪上65℃加热5 min,立即冰浴3 min。在上述EP管中加入5×反应缓冲液4.0 μl、10 mmol/L dNTP Mix 2 μl、Ribolock TM Rnase inhibitor 1 μl、RevertAidTM M-MuLV 逆转录酶1 μl。42℃ 60 min,70℃ 5 min。取出上述反应液,即为cDNA,-80℃ 保存备用。③荧光定量PCR反应:取出上述反应液2 μl作为模板,反应体系:2×Goldstar Taqman mixture 10 μl,正反义引物各10 μmol/L 0.4 μl,探针10 μmol/L 0.4 μl,Template DNA 2 μl,Rnase Free水6.8 μl,反应总体积为20 μl;反应条件:M-MLV 灭火95℃ 10 min,变性95℃ 15 s,退火60℃ 1 min,40个循环观察CT 值的变化,计算基因表达相对含量,结果以2-△△CT表示。
根据GenBank 提供的序列设计引物,设计软件为Primer5,引物及探针由Invitrogen公司合成,实时定量PCR 仪为美国ABI公司的ABI7500,逆转录试剂盒(RevertAidTM first Strand cDNA Synthesis Kit)为Fermentas公司产品(货号:00064525),荧光定量试剂及实验耗材由TaKaRa公司提供。引物序列:β-actin正义引物5′-ACCAGTTCGCCATGGATGAC-3′,反义引物5′-TGCCGGAGCCGTTGTC-3′,探针5′-ATATCGCTGCGCTCGT-3′ ;INSR正义引物5′-CAGCGTGGCTGCCTACGT-3′,反义引物5′-CAGGGCCAACGATGTCATC-3′,探针5′-CCGGACCATGCCTGA-3′;IRS1正义引物5′-CAGGCAGAATGAAAGACCTAAATG-3′,反义引物5′-AGACGTGAGGTCCTGGTTGTG-3′,探针5′-AATCCTCCTTTTTAACTCATG-3′;PI3K正义引物5′-GTCGGCTGGCGATGCTCAGA-3′,反义引物5′-TACGCACAGGGCCGGGTTCA-3′,探针5′-CATAAGTTTGCCCAGTACT-3′;GLUT4正义引物5′-CTGGGGTGGAACAGCCAGCC-3′,反义引物5′-CCGTCGCCCAGCT CGCTCTA-3′,探针5′-TCAACCAGCATCTTTGAGTT-3′。
1.5Western印迹检测下丘脑弓状核INSR、IRS1、PI3K、GLUT4蛋白 ①组织蛋白提取:剪取组织50 mg,加入RIPA细胞裂解液100 μl(含1 μmol/L PMSF)进行裂解,冰上进行组织匀浆。12 000 r/min离心5 min。收集上清液,即含有组织总蛋白。吸取蛋白溶液(约80 μl),加入5倍蛋白质上样缓冲液20 μl,沸水浴中加热5 min。②上样与电泳:配制SDS-PAGE凝胶:浓缩胶2 ml(双蒸水1.4 ml,30%丙烯酰胺混合液330 μl,1.0 mol Tris(pH6.8)250 μl,10%SDS 20 μl,10%AP 20 μl,TEMED 2 μl),10%分离胶5 ml(双蒸水1.9 ml,30%丙烯酰胺混合液1.7 ml,1.5 mol Tris(pH8.8)1.3 ml,10%SDS 50 μl,10%AP 50 μl,TEMED 2 μl),12%分离胶5 ml(双蒸水1.6 ml,30%丙烯酰胺混合液2.0 ml,1.5 mol Tris(pH8.8)1.3 ml,10%SDS 50 μl,10%AP 50 μl,TEMED 2 μl。待胶凝固后,拔去梳子,每孔加15 μl蛋白样品进行电泳,其中浓缩胶电压为70 V,时间40 min;分离胶电压为120 V,时间约1.5 h。③转膜:将预先裁好与胶条同样大小的滤纸和PVDF膜(其中PVDF膜预先在甲醇中浸泡3 min),浸入转膜缓冲液中5 min。转膜装置从下至上依次按阳极板、3层滤纸、PVDF膜、凝胶、3层滤纸、阴极板的顺序放好,滤纸、凝胶、PVDF膜精确对齐,接通电源,恒流转膜。转膜条件:β-actin、PI3K和GLUT4均为120 mA 2 h,INSR 180 mA 2 h,IRS1 200 mA 2.5 h。④封闭:转膜完毕后,立即把蛋白膜放置到预先准备好的TBS洗涤液中,漂洗5 min,以洗去膜上的转膜液。加入Western封闭液(5%脱脂奶粉),在摇床上缓慢摇动,室温封闭2 h。⑤孵育:按照合适的比例用一抗稀释液进行稀释,4℃ 缓慢摇动孵育过夜(或者常温2~2.5 h),加入洗涤液(TBST)20 ml,洗涤10 min,共洗涤3次。按照1∶5 000用二抗稀释液稀释辣根过氧化物酶(HRP)标记的二抗(β-actin为山羊抗小鼠,其余均为山羊抗兔),室温封闭2 h,加入洗涤液(TBST),每次洗涤10 min,共洗涤3次。⑥蛋白检测:使用ECL发光试剂盒(美国Pierce公司)检测蛋白。采用Quantity one 灰度分析软件,实验结果以目的蛋白灰度值/内参蛋白灰度值的相对值表示。
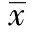
2 结 果
2.1造模及治疗后FPG和FINS比较 造模后,模型组和针刺组按FPG水平无统计学差异(t=0.073,P=0.943),说明两组来自同一样本,具有可比性。治疗后模型组FPG水平明显高于对照组(P=0.013)和针刺组(P=0.016),与治疗前比较无显著差异(P=0.200);针刺组FPG与治疗前比较显著降低(P=0.001),与对照组比较无显著差异(P=0.457)。治疗后FINS水平,模型组明显高于对照组(P=0.008),针刺组与模型组比较显著降低(P=0.038),仍高于对照组(P=0.036)。见表1。
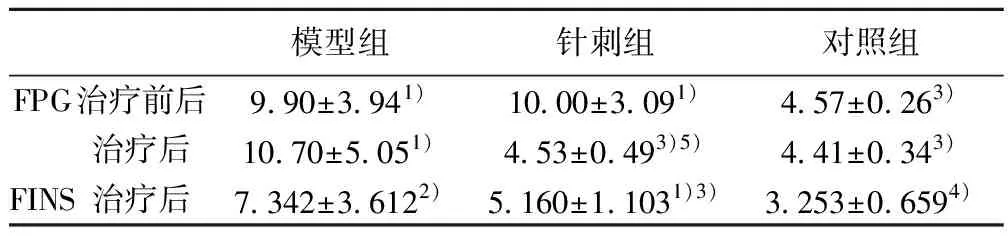
表1 造模后和治疗后FPG水平(mmol/L,n=9)
2.2治疗后各组INSR、IRS1、PI3K 和GLUT4蛋白含量 图1,表2可见,对照组INSR蛋白表达显著高于模型组和针刺组(P分别为0.000和0.012),针刺组INSR蛋白表达显著高于模型组(P=0.006);对照组IRS1蛋白表达显著高于模型组和针刺组(P=0.000),针刺组IRS1蛋白表达显著高于模型组(P=0.029);对照组PI3K蛋白表达显著高于模型组及针刺组(P=0.000),针刺组PI3K蛋白表达显著高于模型组(P=0.020);对照组GLUT4蛋白表达显著高于模型组及针刺组(P=0.000),针刺组GLUT4蛋白表达显著高于模型组(P=0.041)。
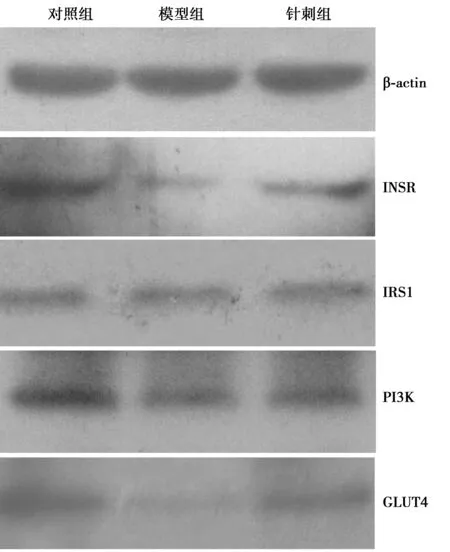
图1 Western印迹检测各组INSR、IRS1、PI3K、GLUT4蛋白表达
2.3治疗后各组INSR、IRS1、PI3K和GLUT4 基因表达情况 对照组各基因表达设为1。治疗后,模型组INSR mRNA表达是对照组的0.05倍,针刺组INSR mRNA比模型组增加,但仍低于对照组,是对照组的0.43 倍。模型组IRS1 mRNA表达是对照组的0.65倍,针刺组IRS1 mRNA比模型组增加,但仍低于对照组,是对照组的0.89倍。模型组PI3K mRNA表达是对照组的0.74倍,针刺组PI3K mRNA比模型组增加,但仍低于对照组,是对照组的0.88倍。模型组GLUT4 mRNA表达是对照组的0.72倍,针刺组GLUT4 mRNA比模型组增加,但仍低于对照组,是对照组的0.93倍。
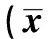
表2 治疗后各组INSR、IRS1、PI3K和GLUT4蛋白含量±s,n=9)
3 讨 论
胰岛素是中枢神经系统的一种主要调节物质〔11〕,对于能量代谢平衡、神经突触重塑、学习、记忆、肝糖代谢有着重要作用。脑内胰岛素通过与INSR的结合发挥各种生理作用,INSR 和GLUT4丰富地表达于嗅球、大脑皮质、下丘脑、海马、小脑等部位。IRS1不仅在外周组织的胰岛素信号转导中发挥重要作用,在大脑许多部位也有广泛表达,有学者推测IRS1/PI3K是脑内胰岛素作用的最可能信号途径〔5〕;该信号通路的紊乱会导致中枢胰岛素抵抗,从而引起糖尿病、痴呆、神经变性紊乱等多种疾病的发生。胰岛素对神经功能调节的最直接机制可能是通过对糖代谢的调节实现的,胰岛素信号异常导致糖代谢调节紊乱直接影响神经系统的功能。一些研究显示,向海马注射胰岛素能够引起局部糖酵解的迅速增加并维持在高位,但这种作用在2型糖尿病动物则完全削弱,其机制可能与PI3K信号通路的紊乱有关。有报道显示,肥胖的Zucker大鼠胰岛素诱导的INSR/IRS1的磷酸化降低〔12〕。
本研究提示,STZ诱导的糖尿病模型大鼠存在高胰岛素血症,下丘脑弓状核的INSR、IRS1、PI3K、GLUT4基因表达及蛋白含量降低,提示存在中枢胰岛素抵抗。针刺组大鼠高胰岛素血症有所改善,下丘脑弓状核的INSR、IRS1、PI3K、GLUT4基因表达及蛋白含量均比模型组增加,提示针刺能够改善STZ诱导的糖尿病大鼠的胰岛素抵抗状态。这与我们既往的研究结果相符合〔9〕。本研究显示,糖尿病状态下INSR/IRS1/PI3K/GLUT4通路的每个环节在基因和蛋白水平上均明显下降,而针刺后该通路各个环节的基因和蛋白水平均增加,笔者以为这个结果可以作为INSR/IRS1/PI3K/GLUT4是大脑胰岛素信号转导的重要途径的一个佐证。尽管胰岛素的中枢作用和外周作用对糖代谢的调节是相反的,但针刺对糖尿病大鼠中枢胰岛素抵抗的改善必然对肝糖代谢及能量平衡产生良性影响,这可能是针刺降糖的机制之一。
研究显示,糖尿病患者会出现记忆力下降、认知减退,中枢胰岛素抵抗在其中发挥了重要影响〔5〕。本研究显示了针刺改善中枢胰岛素抵抗的良好作用,那么针刺是否对糖尿病患者的记忆力下降、认知减退以及阿尔茨海默病有所裨益,有待今后进一步研究。
4 参考文献
1Plum L,Schubert M,Bruning JC.The role of insulin receptor signalling in the brain〔J〕.Trends Endocrinol Metab,2005;16 (2):59-65.
2Porte D,Baskin DG,Schwartz MW.Insulin signaling in the central nervous system:a critical role in metabolic homeostasis and disease from C elegans to humans〔J〕.Diabetes,2005;54 (5):1264-76.
3Bondareva VM,Chistyakova OV.Insulin and insulin-receptor signaling in the brain〔J〕.Neurochem,2007;1 (3):176-87.
4Reagan LP.Insulin signaling effects on memory and mood〔J〕.Pharmacol,2007;7 (6):633-7.
5McNay EC,Recknagel AK.Reprint of:′Brain insulin signaling:a key component of cognitive processes and a potential basis for cognitive impairment in type 2 diabetes′〔J〕.Neurobiol Learning Memory,2011;96 (3):432-42.
6Komori T,Morikawa Y,Tamura S,etal.Subcellular localization of glucose transporter 4 in the hypothalamic arcuate nucleus of ob/ob mice under basal conditions〔J〕.Brain Res,2005;1049 (1):34-42.
7王 媛,刘志诚,徐 斌.电针治疗胃热炽盛型2型糖尿病患者35例临床观察〔J〕.中医杂志,2013;54(10):852-7.
8董勤,曹雯萍,鲁 佳,等.电针与穴位注射对糖尿病周围神经病变大鼠神经保护作用的比较研究〔J〕.时珍国医国药,2013;24(4):1001-3.
9袁爱红,刘志诚,魏群利,等.针刺对2型糖尿病大鼠弓状核INSR基因表达的影响〔J〕.天津中医药杂志,2009;26(4):293-5.
10郭啸华,刘志红,李 恒,等.实验性2型糖尿病大鼠模型的建立〔J〕.肾脏病与透析肾移植杂志,2000;9(4):351-5.
11Banks WA,Owen JB,Erickson MA.Insulin in the brain:There and back again〔J〕.Pharmacol Therap,2012;136 (1):82-93.
12Carvalheira JBC,Ribeiro EB,Araujo EP,etal.Selective impairment of insulin signalling in the hypothalamus of obese Zucker rats〔J〕.Diabetologia,2003;46 (12):1629-40.
