实时超声造影技术在肝癌射频消融治疗中的临床应用
2014-09-12赵恒军王楠娅袁长吉
张 明 赵恒军 王楠娅 袁长吉
(吉林大学白求恩第一医院,吉林 长春 130021)
射频消融(RFA)治疗作为原发性肝癌重要的治疗手段之一,其中在超声引导下的经皮RFA治疗应用尤为普遍。常规超声有其快捷、方便等优点,但获得的血流动力学信息有限,不能更好、准确、有效地进行实时治疗范围的界定与疗效监测。近年来超声造影的进步,提高了超声检测肝脏肿瘤内微血流信号的准确性〔1〕,可弥补常规超声的局限,为RFA术提供更有价值的信息〔2〕,对发现肿瘤、确定性质,对肿瘤治疗灭活程度的诊断及RFA的评价具有高度敏感性和特异性〔3〕。本文通过临床历史性对照研究,分析RFA术前后行超声造影术的临床价值。
1 资料与方法
1.1研究对象 纳入2012年9月至2013年6月吉林大学第一医院肿瘤中心70例经增强CT或(和)MRI及病理证实为原发性肝癌的患者,符合以下:①肿瘤最大直径<7 cm;②肿瘤数目≤3个;③肝功能Child-Pugh分级为A级或B级;④血小板计数>6×107/L,并经过肝癌多学科会诊适合进行肝癌RFA治疗。同时选取2011年5月至2013年8月同样符合上述条件且采用普通超声引导的RFA治疗的74例原发性肝癌患者作为历史对照。超声造影组男57例,女13例;年龄39~83〔平均(59.1±9.0)〕岁;肿瘤直径0.7~5.5 cm,平均(2.51±0.94)cm;肿瘤数量单发55例,多发15例;术前高AFP 46例;Chlid分级A级55例;B级15例。74例常规超声组(回顾性对照组)于常规超声下行RFA,其中男57例,女17例,年龄37~86〔平均(60.1±10.2)〕岁,肿瘤直径0.7~5.6 cm,平均(2.60±1.09)cm;肿瘤数量单发57例,多发17例;术前AFP47例,;Child分级A级55例,B级19例。两组病例临床特点无明显统计学差异(P>0.05)。
1.2仪器与方法
1.2.1方法 两组患者均于术前行肝脏病灶常规超声定位,选定病灶视野切面,并记录。之后常规超声组行RFA术。研究组行实时超声造影,注入造影剂后观察3 min,观察造影剂分配方式、强度,再次确定病灶位置、大小后RFA术。术后5 min左右再次按照上述方式行超声造影检查,观察肿瘤有无增强信号,若灭活程度不彻底,可再次行RFA术。RFA治疗后行术后临床观察。
1.2.2仪器 超声仪器采用LOGIQ E9彩超诊断仪是来自GE(美国通用电气)的超声诊断设备, 应用编码造影剂谐波成像技术(Coded Contrast Imaging)。超声造影剂采用Sono Vue(意大利Bracco),造影微泡为磷脂微囊的六氟化硫,微泡直径平均为2.5 μm。使用5 ml生理盐水溶解冻干粉,震荡摇匀后经肘静脉2~3 s内快速注射1.2~2.4 ml,再用5 ml等渗盐水冲洗注射针。继之实时监测动脉相(8~30 s)、门脉相(30~120 s)、及延迟相(121~360 s),以实质肝脏为对照,观察病灶内的灌注情况。
射频仪采用LDRF-120S多极RFA。可以选用多针手术电极一次性毁损5 cm的大肿瘤;选用单针手术电极对特殊病灶部位或多针难以展开的部位进行消融,温度自动控制在90℃,治疗时间约为20 min。
1.3统计学方法 应用SPSS17.0软件。Kappa检验分析一致性,Kappa>0.75一致性较好。计数资料应用χ2检验,计量资料采用t检验。根据首次RFA术后无疾病进展生存时间制作生存曲线,应用Log-rank检验比较无病进展生存期差异。
2 结 果
2.1超声造影在对肿瘤边界的定义 超声组患者表现为动脉期高增强56例(80.0%),门脉期及延迟期多呈等或低增强60例(85.7%)。增强CT/MRI表现动脉期增强53例(75.7%),门脉期及延迟期呈等或低增强56例(80.0%),二者相比无统计学差异(P<0.05)。其中超声造影同增强CT或MRI中有49例(70.0%),两者一致性较好(Kappa=0.84)。
造影前普通超声测量病灶直径大小为(2.53±0.94)cm。造影后对病灶进行评估,其中43例患者共62个(62.0%)病灶较前增大,得到肿瘤直径大小为(2.72±0.93)cm。超声造影测量肿瘤边界大于普通超声测量直径,超声造影对肿瘤边界范围的界定大于普通超声(P=0.042)。
2.2超声造影指导下的RFA对疗效及无进展生存意义 两组患者均行RFA术。其中超声造影组共100个病灶,行肝癌RFA术,术后1个月行增强CT或MRI行相关影像学检查,发现病灶稳定/完全灭活者为57例(81.4%),病灶原位复发者为6例(8.6%)。普通超声组(历史性对照组)74例患者,共105个病灶,行肝癌RFA术,术后1个月行增强CT或MRI行相关影像学检查,发现病灶稳定/完全灭活者为48例(64.9%),肿瘤原位复发者为18例(24.3%)。超声造影组射频效果优于普通超声组(P<0.05)。每3个月行增强CT或(和)MRI对患者进行4~16个月规律随访,无疾病进展患者超声造影组为52例(74.2%),普通超声组37例(50%)。其中6个月造影组无进展生存率为64.3%,普通超声组为46.1%;1年超声造影组无进展生存期为75.7%,普通超声组为54.1%。对比中位生存期,普通超声造影组为11.7个月。超声造影组未达到中位生存期。超声造影组无病生存期要长于对照组(P<0.05),见图1。
2.3超声造影引导RFA术后对相关并发症发生的影响 术后1 w内临床观察,超声造影组发生并发症患者为34例(48.6%),发生疼痛14例(20.0%)、发热16例(22.9%),其他4(5.6%)。超声对照组并发症患者为43例(58.1%),发生疼痛26例(35.1%)、发热18例(24.3%)、出血2例(2.7%),其他12例(16.6%)。两组病例中治疗中均无相关患者死亡。
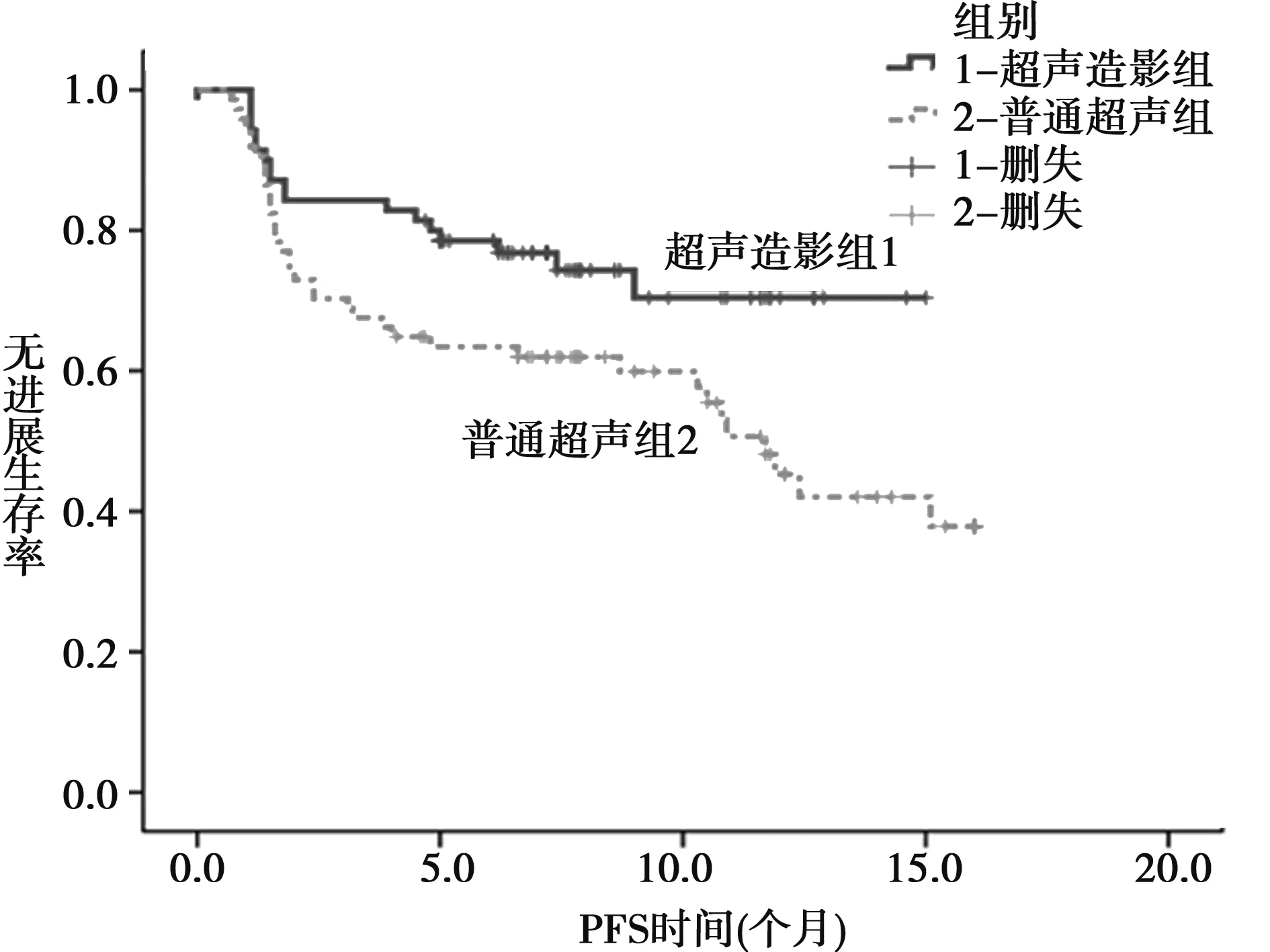
图1 超声造影组同非超声造影组射频后远期无进展生存比较
3 讨 论
RFA为一种微创治疗技术,其简单操作易行,疗效肯定,可重复性强,已经为临床广泛应用,成为治疗肝癌的主要手段之一〔4〕。其中RFA的灼烧边缘范围被认为是影响肝内远处复发的独立影响因素之一〔5〕。Mulier等〔6〕认为射频的范围应覆盖肿瘤边缘5~10 mm的区域,才能有效减少肿瘤残余灶,减少复发风险。临床中,扩大消融范围术后3~6个月随访,仍有部分病例存在肿瘤残留或复发。目前常规超声在确定肿瘤边界范围及肿瘤活性方面具有明显的局限性。而研究证明超声造影在明确肿瘤范围及确定肿瘤病灶大小、性质方面具有明显的优势〔7〕。超声造影在切面上对肿瘤的测量值比普通超声大,说明超声造影增加了肿瘤与周围肝脏组织间的对比度,从而能更准确地反映肿瘤病灶的实际情况,确定RFA的范围〔8〕。
超声造影可为制定射频方案确定布针消融灶数提供参考依据〔9〕。本研究中超声造影同增强CT或MRI病灶增强模式具有一致性,符合原发性肝癌的影像学表现。超声造影可准确显示肝癌病灶的血供,为消融提供较好的视野和精确的定位〔10〕,提高RFA的效率。表明应用超声造影指导下的RFA术,能有效预防肿瘤的存活、复发,延长患者的无病生存期。
肝癌RFA术的不良反应少〔11〕,且多轻微,常见轻微并发症主要为疼痛、发热、全身不适、白细胞增高等。发热主要由于消融导致细胞凋亡,引起炎性介质释放引起〔12〕。疼痛考虑为术后肿瘤组织凝固坏死,局部充血水肿引起肝脏包膜紧张程度增高所致,肿瘤靠近膈下或肝包膜时疼痛尤为明显〔13〕,均于对症治疗后好转。考虑超声造影组对病灶范围控制较好,可在邻近包膜部位的肿瘤周围获得一个安全的边界〔14〕。除上述症状外,文献报道〔15〕RFA术也可引起较严重的并发症如内出血、胆汁瘘、胃肠穿孔等(发生率为2.2%),导致严重的临床后果,危及生命。本实验仅中普通超声组发生术后出血2例(2.7%)。其中1例为手术部位出血,经输血、止血对症治疗后好转,考虑为患者存在肝病基础内凝血欠佳,RFA后肝组织坏死创面浅,受呼吸运动或咳嗽等因素刺激发生出血;1例为腹腔出血,经介入治疗后好转,考虑不除外为肝内外导管损伤及影响重要供血血管所致。超声造影对肿瘤边界显示更为清晰,可明确肿瘤同周围血管、肝胆管、膈肌及周围空腔脏器等的关系〔16〕。对RFA的进针方位等具有指导作用。从而有助于治疗的有效进行,减少对周围脏器热损伤,因此减少射频相关并发症的发生。临床研究〔17〕认为,针对高龄患者应用这种创伤小的手术,其相关手术风险更小。
综上,超声造影技术可实时观察肝脏肿瘤实质内微血管血流灌注的全过程,空间分辨率高,可取得同增强CT/MRI相似的血流信息。且其操作简便,没有放射性辐射,经济安全,可于术后即时进行,病人容易接受,对RFA治疗有较高的临床价值,有较好的应用前景。但因超声造影仅能对局部或邻近病灶较好的显像,容易对位置较深的病灶、多个病灶或其他部位转移瘤产生误诊和漏诊,因此在长期随访评价中,仍需要进一步深入研究。
4 参考文献
1Meloni MF,Andreaon A,Franza E,etal. Contrast enhanced ultrasound:should it play a role in immediate evaluation of liver tumors following thermal ablation〔J〕?Eur J Radiol,2012;81(8):e897-902.
2Meloni MF,Livraghi T,Filice C,etal. Radiofrequency ablation of liver tumors:the role of microbubble ultrasound contrast agents〔J〕. Ultrasound Q,2006;22(1):41-7.
3陈敏华,杨 薇.超声造影对射频消融治疗肝癌的应用价值〔J/CD〕.中华医学超声杂志:电子版,2010;7(12):2004-7.
4Rhim H.Complications of radiofrequency ablation in hepatocellular carcinoma〔J〕.Abadom Imaging,2005;30(4):409-18.
5骆惊涛,魏 玺,周洪渊,等.肝癌射频消融术后肝内远处复发的相关因素分析〔J〕.中华外科杂志,2009;47(20);1529-31.
6Mulier S,Ni Y,Jamart J,etal.Local recurrence after hepatic radiofrequency coagulation:multivariate meta-analysis and review of contributing factors〔J〕. Ann Surg,2005;242(2):158-71.
7Yeong-Kim A,Woo-Lee M,Rhin H,etal.Pretreatment evaluation with contrast-enhanced ultrasonography for percutaneous radiofrequency ablation of Hepatocellular carcinomas with poor conspicuity on conventional ultrasonography〔J〕. Korean J Radiol,2013;14(5):754-63.
8陈敏华,杨 薇,严 昆,等.超声造影对确定肝癌消融射频范围及治疗策略的应用价值〔J〕.中华超声影像学杂志,2006;15(3):193-7.
9廖锦堂,潘瑞喆,刘 艳,等.超声造影评价肝癌射频消融治疗近期疗效〔J〕.中国普外基础与临床杂志,2009;16(4);265-8.
10Maruyama H,Yoshikawa M,Yokosuka O.Current role of ultrasound for the management of hepatocellular carcinoma〔J〕.World J Gastroenterol,2008;14(11):1710-9.
11张 军,刘会春,周 磊,等.原发性肝癌的射频治疗效果分析〔J〕.肝胆外科学杂志,2011;19(2):30-3.
12Shah DR,Green S,Elliont A,etal.Current oncologic applications of radiofrequency ablation therapies〔J〕.World J Gastrointest Oncol,2013;5(4):71-80.
13叶永强,马宽生,李 锐,等.超声造影检测原发性肝癌射频消融术的疗效〔J〕.中华普通外科杂志,2006;21(9):650-3.
14李丹丹,黄 进,李文伦,等.超声引导单极冷循环经皮射频消融治疗毗邻胆囊肝癌安全性及疗效评估〔J/CD〕.中华临床医师杂志(电子版),2011;5(5):1446-9.
15Numata K,Isozaki T,Ozawa Y,etal.Percutaneous ablation therapy guided by contrast-enhanced sonography for patients with hepatocellular carcinoma〔J〕.Am J Roentgenol,2003;180(1):143-9.
16Wu J,Yang W,Yin S,etal.Role of contrast-enhanced ultrasonography in percutaneous radiofrequency ablation of liver metastases and efficacy evaluation〔J〕.Chin J Cancer Res,2013;25(2):143-54.
17于波洋,于 雷,周洁宏,等.超声造影在肝癌射频消融术中的应用价值〔J〕.中国老年学杂志,2013;33(5):1196-7.
