Survivin基因沉默对膀胱癌T24细胞增殖及对塞来昔布敏感性的影响
2014-09-12滕立新
滕立新
(沈阳医学院奉天医院泌尿外科,辽宁 沈阳 110024)
膀胱癌可发生于膀胱的各层组织,发病率居泌尿系统恶性肿瘤的首位〔1,2〕。研究发现膀胱癌的侵袭和转移与多基因调控导致其表达产物改变有关〔3〕。本研究观察siRNA对T24细胞凋亡的影响和对Survivin基因沉默的效率及Survivin基因被沉默后对肿瘤细胞周期及其对塞来昔布的敏感性的影响。
1 材料和方法
1.1主要材料 膀胱癌T24细胞株购于中国科学院上海细胞究所。MI 1640培养液、胰蛋白酶和胎牛血清(美国Gibco公司)。Lipofectamine TM 2000脂质体转染试剂和TRIzol(美国Invitrogen公司);RT-PCR两步法试剂盒(北京赛百盛基因技术有限公司),cDNA合成试剂盒(日本TOYOBO公司);AMV逆转录试剂盒(杭州博日); siRNA基因片段由上海生工生物工程公司合成;G418(美国Klontech公司);Survivin鼠抗人单克隆抗体(美国Santa Cruz公司);5%四甲基偶氮唑蓝、HRP标记的羊抗鼠二抗(北京中杉公司);塞来昔布、流式细胞仪(COULTER XL;Coulter);550酶标仪(美国Biorad公司),生物倒置显微镜(Olympus CKX4)。ECL试剂盒(美国Thermo公司);RIPA蛋白裂解液(江苏碧云天公司)。
1.2siRNA设计、合成及转染 根据Genebank中 Survivin cDNA(Acc.No.U75285)的序列,通过相应计算机软件设计靶向Survivin mRNA 45~65序列,由21个碱基组成的核苷酸链,其序列为:5'-GG ACCACCGCAUCUCUACADTDT-3',同时合成互补链,经退火形成双链(dsRNA),即特异性 的siRNA分子,经BLAST查询,确定为Survivin特性序列,排除与其他基因的同源性。阴性对照 siRNA的序列为:5'-CGUACGCGGAAUACUUCG ADTDT-3',此序列不与人类任何基因序列同源。以上核苷酸分子均由上海生工生物工程公司合成。膀胱癌细胞株T24培养在含10%胎牛血清的RPMI 1640培养液中,置饱和湿度5% CO2,37℃恒温培养箱中培养。每2天传代1次,实验时取对数生长期的细胞。按1× 105个/孔将膀胱癌T24细胞接种于24孔板中,至融合率达70%时以脂质体法进行转染。按基因转染试剂盒说明书进行转染,转染时分为三组:转染pGenesil-1-Survivin-siRNA载体者为T24/Survivin-siRNA组(实验组),转染随机对照载体者为T24/control组(对照组),未转染的膀胱癌T24细胞为T24组(空白组)。于转染后48 h行 RNA 干扰效应的检测。
1.3RT-PCR检测 细胞弃培养液后磷酸盐缓冲液(PBS)冲洗3次,通过TRIzol法提取总RNA,用cDNA合成试剂盒反转录合成cDNA。分别扩增Survivin和内参GAPDH。Survivin引物序列:正义:5'-CACCGCATCTCTACATTCAA-3',反义:5'-CACTTTCTTCGCAGTTTCCT-3',扩增产物为345 bp。GAPDH 正义:5'-GAGTCAACGGATTTGGTCGT-3',反义:5'-GACAAGCTTCCCGTTCTCAG-3',扩增产物为185 bp。PCR反应条件:95℃预变性10 min,95℃变性30 s,55℃退火30 s,72℃延伸30 s,共35个循环。PCR产物采用2%的琼脂糖凝胶电泳鉴定,使用凝胶图像分析系统进行吸光度扫描并用Survivin吸光度/GAPDH吸光度值作为mRNA表达的相对强度。
1.4Western印迹检测 细胞弃培养液后PBS冲洗3次,加入预冷的RIPA裂解液150 μl,RIPA裂解液预先加PMSF 1.5 μl使其终浓度为1 mmol/L。操作在冰上进行,4℃下,10 000 r/min离心5 min后取上清液,通过BCA法测蛋白浓度后,99℃ 变性10 min。取50 μg蛋白行10%SDSPAGE电泳,通过电转移印迹到(PVDF)膜上,封闭液中孵育1 h,加入1∶1 000稀释的Survivin一抗,4℃过夜,TBST洗膜5 min,共3次,加入1∶5 000 HRP标记的二抗和GAPDH,于37℃孵育2 h。PBS洗涤,采用ECL法检测。
1.5流式细胞仪检测细胞周期 收集三组细胞,调整细胞浓度为1×106/L,冷PBS液洗涤2次,加入70%的冷乙醇(4℃)固定24 h后,洗涤细胞,与含10 μg/ml RNA 酶的Tris-HCl缓冲液(pH 7.4)共同孵育30 min。50 μg/ml碘化丙啶(PI)进行细胞的DNA染色,1 h内通过流式细胞仪分析细胞的DNA含量分布,并计算出各个周期细胞所占的百分率。
1.6MTT检测干扰Survivin后T24细胞对塞来昔布的敏感性 细胞转染干扰质粒48 h后,收集转染和未转染的T24细胞细胞,接种于96孔板 ,每个样本做3个复孔,当细胞贴壁后,加入不同浓度的塞来昔布(2.5、5、10 、20 μmol/L)培养48 h;每孔加MTT 20 μl(浓度为5 mg/ml),放置孵箱内4 h后弃上清加入10%的十二烷基磺酸钠(SDS)200 μl,过夜。震荡15 min,用全自动酶标仪(检测490 nm处的吸光度值(A值)。抑制率(%)=(A对照-A实验)/(A对照-A空白)×100%。
1.7平板克隆检测干扰Survivin后T24对塞来昔布的敏感性 细胞转染干扰质粒48 h后,收集转染和未转染的T24细胞,接种于6孔板 ,每个样本做3个复孔,细胞贴壁后,加入不 同浓度的塞来昔布(2.5、5、10 、20 μmol/L)培养中培养7 d,去除培养液,PBS洗2次,95%乙醇固定10 min,吉姆萨染液染色10 min,自来水冲洗后,晾干,通过Quantity One软件计算克隆数。克隆形成抑制率(%)=1-(实验组克隆数/对照组克隆数)×100%。
2 结 果
2.1siRNA抑制Survivin mRNA的表达 Survivin mRNA表达的RT-PCR检测与对照组和空白组比较,实验组条带明显变窄(P<0.05)。见图1。
2.2siRNA抑制Survivin蛋白的表达 Survivin蛋白表达的Western印迹检测与对照组和空白组比较,T24/Survivin-siRNA组(实验组)条带明显变窄(P<0.05)。见图2。
2.3流式细胞仪检测细胞周期 在G0/G1期实验组较对照组和空白组略有增加,S期略有减少(P<0.05),G2/M期细胞无明显变化(P>0.05),说明有明显的S期阻滞。见表1。

Marker 空白组 对照组 实验组
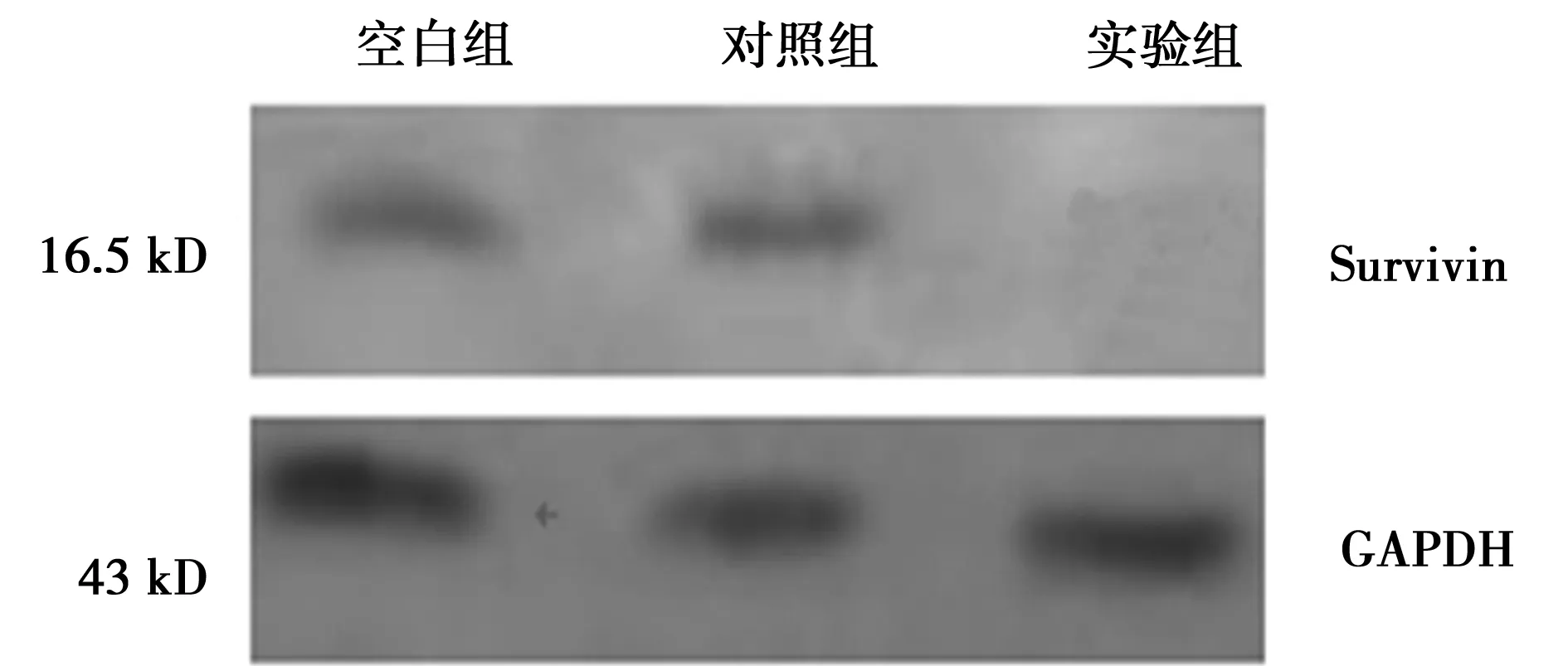
图2 Western印迹检测T24细胞中Survivin蛋白的表达

表1 siRNA抑制Survivin表达对T24细胞周期的影响
与空白组及对照组比较:1)P<0.05
2.4细胞转染后塞来昔布对T24细胞填殖抑制率 MTT法检测结果显示,在转染pgsiRNA-Survivin后,T24细胞对不同浓度的塞来昔布敏感性均提高 。随着药物浓度的增加,塞来昔布对细胞的抑制率也增加,呈现出剂量依赖性,实验组细胞对不同浓度的塞来昔布敏感性显著高对照组和空白组(P均<0.05)。见表2。
2.5细胞转染后对T24细胞集落形成的影响 平板克隆检测显示,转染 pgsiRNA-Survivin后,T24细胞对不同浓度的塞来昔布敏感性均提高,细胞克隆形成数明显减少,克隆形成抑制率明显增高(P<0.05 )。随着药物浓度的增加,塞来昔布对细胞的克隆形成抑制率也增加,呈现出剂量依赖性,实验组细胞对不同浓度的塞来昔布克隆形成抑制率显著高于对照组和空白组(P均<0.05 )。见表3。
表2 MTT法检测细胞转染后塞来昔布对T24细胞增殖的抑制率
表3 平板克隆检测细胞转染后塞来昔布对T24细胞克隆形成抑制率
3 讨 论
膀胱癌高发年龄为50~69岁,男女比例为3∶4。膀胱癌病理与肿瘤的组织类型、细胞分化程度、生长方式和浸润程度有关,其中以细胞分化和浸润程度最为重要。膀胱癌的组织病理类型有90%以上为移行性细胞癌,其生物学行为复杂多变,易复发、浸润和转移〔4,5〕。膀胱癌细胞的远处转移要经历一个多因素、多步骤、多阶段的复杂过程,其中细胞转移及侵袭是关键步骤。目前通过肿瘤特异性启动子增强细胞中治疗基因的转录选择性是有效治疗肿瘤的方法之一〔6,7〕。Survivin基因具有肿瘤组织表达特异性.在多数肿瘤组织中高表达,在癌旁组织及正常组织中无或低表达,是肿瘤基因治疗理想的靶点。已有研究表明Survivin的表达与组织病理分级、临床分期密切相关〔8〕。Survivin过表达会导致细胞加快向s期转换,抑制G1期静止,从而促进细胞增殖。研究〔9〕显示Survivin主要通过作用于各个凋亡途径的交合点直接或间接抑制凋亡终末效应器半胱氨酸蛋白酶Caspase-3及Caspase-7的活性来阻断细胞的凋亡过程,使Caspase-3不能降解微管结构蛋白,维持了纺锤体的完整性,可以确保胚胎细胞有丝分裂的顺利进行,而在肿瘤组织中Survivin过度表达,使肿瘤细胞不断分裂,恶性增殖永生化,使肿瘤持续生长。因此针对Survivin干预肿瘤生长有着很大的潜力。有研究证实Survivin在膀胱移行细胞癌组织中有高表达〔10〕。
塞来昔布是一种选择性COX-2抑制剂,能抑制多种实体肿瘤细胞增殖,并诱导细胞凋亡〔11~13〕。塞来昔布不仅对多种类型的肿瘤细胞均有抑制生长并诱导凋亡的作用,而且能够增强化疗药物的抗肿瘤活性。塞来昔布使细胞的生存率降低,同时可激活Caspase级联反应,增加DNA的裂解,抑制Caspase-8的表达,从而诱导不同肿瘤细胞株的凋亡。
有资料〔14〕显示,通过siRNA干扰诱导切除修复交叉互补基因(ERCC1)使Survivin表达下调可以增加膀胱癌等肿瘤细胞对化疗药物的敏感性。本实验结果说明Survivin即可以直接有效降低细胞分裂增殖,也可以增加膀胱癌细胞对化疗药物的敏感性,是重要的细胞凋亡因子,可以作为肿瘤基因治疗的靶点。本实验结果提示小分子Survivin干扰RNA沉默Survivin基因能够增加膀胱癌细胞对化疗药物的敏感性,可以为治疗或辅助治疗膀胱癌提供一个新的手段。
4 参考文献
1周 斌,沈海波,曾彦恺.吡柔比星联合塞来昔布对膀胱癌5637细胞株的作用〔J〕.肿瘤杂志,2010;30(6):467-71.
2Brausi M,Collette L,Kuah K,etal.Variability in the recurrence rate at first follow-up cystoscopy after TUR in stage transitional cell carcinoma of the bladder:a combined analysis of seven EORTC studies〔J〕.Eur Urol,2002;41(5):523-31.
3Capalbo G,Rodel C,Stauber RH,etal.The role of survivin for radiation empty.Prognostic and predictive factor and therapeutic target〔J〕.Strahlenther Onkol,2007;183(11):593.
4Bohle A.Compliance with guidelines for patients with bladder cancer:Variation in the Delivery of Care〔J〕.Int Braz J Urol,2011;37(5):673.
5Ramachandran K,Gordian E,Singal R.5-azacytidine reverses drug resistance in bladder cancer cells〔J〕.Anticancer Res,2011;31(11):3757-66.
6Lu C,Contreras X,Peterlin BM.P bodies inhibit retrotransposition of endogenous intracisternal a particles〔J〕.J Virol,2011;85(13):6244-51.
7Itoh Y,Ishikawa M,Kitaguchi R,etal.Development of target protein-selective degradation inducer for protein knockdown〔J〕.Bioorg Med Chem,2011;19(10):3229-41.
8Fortugno GS,Fan QY,Zhou Y,etal.Establishing and characterizing a human osteosarcoma cell line(OS-9901)Ⅱ〔J〕.Fourth Mil Med Univ,1999;20(12):1048-50.
9Shfin S,Sung BJ,Cho YS,etal.An antiapoptotic protein human survivin is a direct inhibitor of Caspase 3 and 7 〔J〕.Biochemistry,2001;40(4):1117-23.
10曹正国,诸禹平,阁四维.siRNA介导的survivin 基因沉默诱导人膀胱癌BIU-87细胞凋亡的研究〔J〕.中国肿瘤,2006;15(8):554-7.
11Kim YM,Shin YK,Jun HJ,etal.Systematic analyses of genes associated with radiosensitizing effect by celecoxib,a specific cyclooxygenase-2 inhibitor〔J〕.J Radiat Res(Tokyo),2011;52(6):752-65.
12Sabichi AL,Lee JJ,Grossman HB.A randomized controlled trial of celecoxib to prevent recurrence of nonmuscle-invasive bladder cancer〔J〕.Cancer Prev Res(Phila),2011;4(10):1580-9.
13Squires H,Tappenden P,Cooper K,etal.Cost-effectiveness of aspirin,celecoxib,and calcium chemoprevention for colorectal cancer〔J〕.Clin Ther,2011;33(9):1289-305.
14Manegold C.Gemcitabine(Gemzar)in non-small cell lung cancer〔J〕.Expert Rev Anticancer Ther,2004;4(3):345-60.
