骨肉瘤细胞来源的exosomes制备和鉴定
2014-09-12董革辉刘福慧韩建华夏本杰黄俊琼
董革辉 刘福慧 韩建华 夏本杰 黄俊琼
(遵义医学院第三附属医院骨科,贵州 遵义 363000)
Exosome是细胞分泌的膜性微囊结构,具有来源细胞的某些功能蛋白,其功能根据来源细胞的不同而不同〔1,2〕。肿瘤细胞来源的exosome(Texo)富含组织相容性复合体Ⅰ(MHC)-Ⅰ类分子及肿瘤相关抗原,可诱导机体产生抗肿瘤免疫应答〔3〕。Exosome为亚细胞结构,理化性质稳定,无致瘤性,是近年来肿瘤疫苗研究的热点,但骨肉瘤来源的exosome研究尚未见报道。本实验采用超滤离心联合蔗糖密度梯度超速离心的方法从骨肉瘤细胞分离exosome,透射电子显微镜观察eoxsome的形态特征,Western印迹鉴定其表面标志物,为进一步研究Texo肿瘤疫苗奠定基础。
1 材料和方法
1.1实验材料 小鼠骨肉瘤细胞(K7M2)购自汉恒生物科技有限公司。细胞培养液RPMI1640购自Hyclone公司,胎牛血清购自Gibco公司,兔抗鼠MHC-Ⅰ、CD81抗体分别购自Senta Cruz 和Abcam公司,辣根过氧化物酶HRP标记羊抗兔IgG为Sigma 公司产品,增强化学发光法(ECL)试剂盒、蛋白预染Marker购自碧云天生物技术研究所,细胞培养瓶购自Corning公司,100 Kda Amicon Ultra-15离心超滤管超滤管购自美国Millipore公司,超速离心管及低温超高速离心机为Beckman公司产品。
1.2细胞培养 骨肉瘤细胞用含10%胎牛血清的RPMI1640细胞培养液于37℃、5%CO2条件下培养,隔天换液,待单层细胞生长达到80%融合时,用胰蛋白酶消化细胞进行传代。选取对数生长期细胞,收集培养液。
1.3Exosomes的分离与纯化 收集骨肉瘤细胞培养上清200~500 ml,4℃ 300 r/min离心10 min;取上清液4℃ 800 r/min离心30 min;取上清液4℃ 10 000 r/min离心30 min;再取上清液加入100 Kda Amicon Ultra-15离心超滤管,4℃ 1 500 r/min离心30 min,至浓缩液体积<8 ml;将浓缩液、30 g/L蔗糖/重水垫和磷酸盐缓冲液(PBS)(0.01 mol/L)按3∶3∶4的比例依次加入Beckman专用离心管中,4℃ 100 000 r/min超速离心60 min,取出承载exosomes的蔗糖/重水垫,用50倍体积的PBS稀释,再经100 000 r/min超速离心60 min,得到的沉淀即为exosomes。取适量PBS重悬,0.22 μm滤膜过滤除菌,-80℃保存,备用。
1.4电子显微镜观察exosomes形态及大小 取10 μl exosomes悬液滴于载样铜网上,室温静置1 min,用滤纸从侧面吸干液体,滴加20 g/L磷钨酸溶液(pH 6.8)30 μl于铜网上,室温负染1 min,吸干负染液,在白炽灯下烤干,电子显微镜观察。
1.5Western印迹分析CD81及MHC-Ⅰ类分子表达 以骨肉瘤细胞作为对照,调整细胞浓度为1×1011/L,-20℃快速冻融4次后,1 000 r/min离心30 min,取上清液,即为细胞裂解物。Exosomes经超声波冲击破膜后,加入终浓度为2%的十二烷基硫酸钠(SDS)以去除脂蛋白的影响。取exosomes 40 μg及骨肉瘤细胞裂解物40 μg(对照),分别加入适量电泳上样缓冲液,沸水中加热10 min,在12%聚丙烯酰胺凝胶上进行电泳分离,然后用半干转移仪转膜1.5 h至醋酸纤维膜上;醋酸纤维膜用5%的脱脂奶粉包被2 h后,加入抗CD81抗体或抗MHC-Ⅰ类分子抗体,4℃过夜,PBS洗涤3次,10 min/次;然后加入HRP标记的二抗(1∶5 000),37℃孵育30 min,PBST洗涤3次,15 min/次;最后加入ECL发光剂,暗室中曝光、显影与定影。
2 结 果
2.1骨肉瘤细胞的形态学 骨肉瘤细胞培养48 h后,倒置显微镜下观察细胞形态,可见细胞贴壁生长,呈梭形,见图1。
2.2Exosomes的形态特征 对分离纯化的exosomes悬浮液进行负染,电镜下见骨肉瘤细胞来源的exosomes呈圆形或类圆形,大小相对均一,直径约60~100 nm,散在分布或聚集成团,见图2。
2.3Western印迹分析结果 分别用抗CD81或MHC-Ⅰ类分子的一抗孵育后,Western印迹分析结果显示(图3),exosomes和细胞裂解物均表达CD81、MHC-Ⅰ类分子,骨肉瘤细胞来源exosomes两类分子的灰度值均较肿瘤细胞裂解物高。
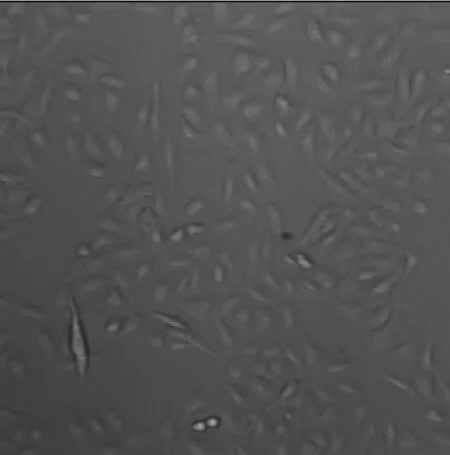
图1 K7M2细胞形态(×100)
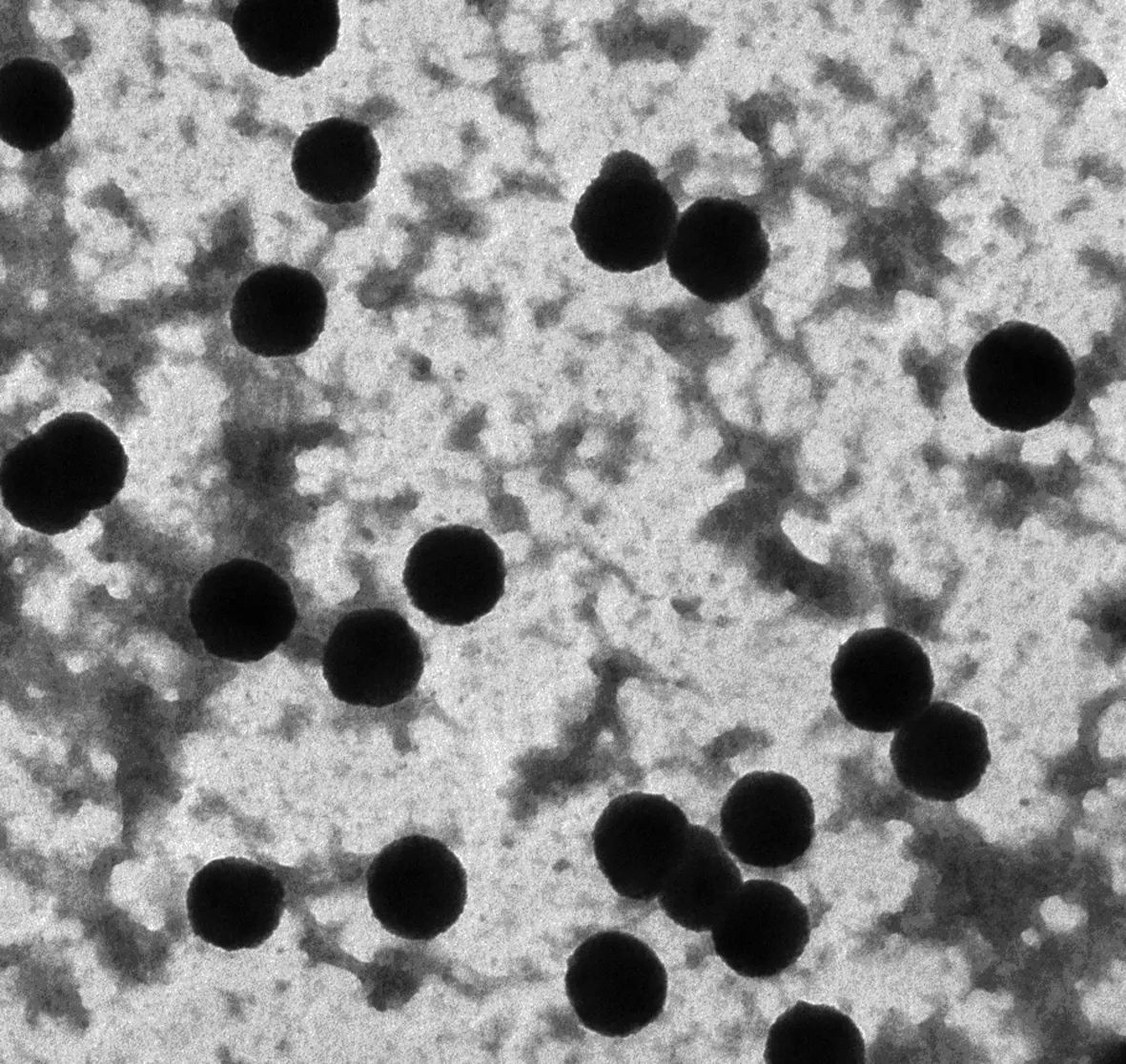
图2 骨肉瘤细胞分泌的exosomes的电镜照片
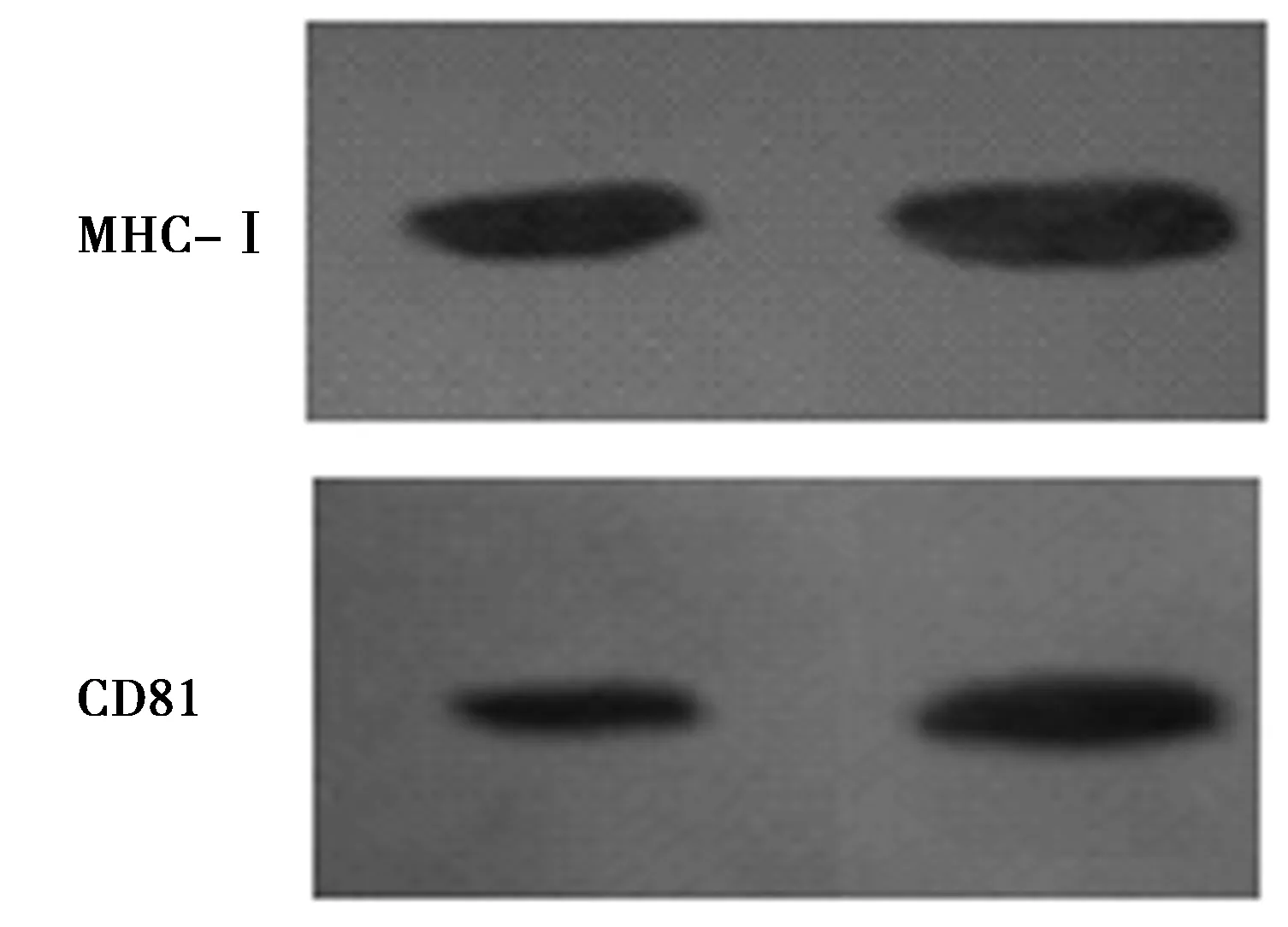
图3 Exosomes的Western印迹分析结果
3 讨 论
Exosomes由活细胞分泌,细胞在内吞过程中形成多泡体(MVB),MVB的膜向内出芽、脱落后形成MVB内小囊泡,当MVB的质膜与细胞膜融合,小囊泡以胞吐的形式被分泌到细胞外,即为exosomes〔4〕。Exosomes呈圆形或类圆形,直径30~100 nm,密度1.13~1.21 g/ml。本研究采用梯度离心联合密度屏障离心的方法从骨肉瘤细胞培养上清液中分离提取exosomes,经300 r/min离心去除上清液中的死细胞,800、10 000 r/min离心去除细胞碎片。为了缩短exosomes提取时间,将上清液放置于超滤离心管中过滤,使上清液中<100 ku的分子过滤掉,>100 ku的主要是exosomes(分子量为300~400 ku)则遗留在离心管内,浓缩液经30 g/L蔗糖/重水垫超速离心后exosomes则悬浮于蔗糖/重水垫中。通过透射电镜观察,见Texo成圆形或类圆形的,直径约60~100 nm。
Exosome的蛋白组成目前还不十分清楚,通过Western印迹、流式细胞分析法、免疫荧光技术和质谱分析等方法己明确了不同细胞来源的exosome含有一些共同的组成蛋白,主要有:①细胞溶质蛋白,如微管蛋白、肌动蛋白、肌动蛋白结合蛋白等;②参与细胞内信号转导的蛋白;③各种代谢酶;④热休克蛋白(Hsp),如Hsp70和Hsp90;⑤四跨膜蛋白,CD9、CD63、CD81、CD82〔5〕。这些普遍存在的蛋白与抗原呈递相关,可结合抗原多肽并携带至MHC分子。目前认为exosome的标志分子主要是MHC-Ⅰ类或Ⅱ类分子(对抗原呈递细胞、肿瘤细胞而言)、HSD和CD,这3类蛋白家族的成员也是目前最常用于鉴定exosome的分子标志。MHC-Ⅰ类分子是重要的免疫分子,与肿瘤抗原结合后可激活T淋巴细胞,诱导抗肿瘤细胞毒性T淋巴细胞(CTL)应答,抑制肿瘤细胞的生长。CD81为4次跨膜蛋白,在exosome中的作用目前还不清楚。CD81是普遍存在于细胞表面的信号转导分子,常与其他免疫分子结合,可能参与了免疫细胞的活化。
肿瘤细胞来源的exosomes含有肿瘤相关抗原(如Mat1、gp 100、TRP和Her2/neu等)和免疫相关分子(MHC-Ⅰ类分子、CD81等),被树突细胞(DC)摄取后,可激活T淋巴细胞,发挥抗肿瘤免疫效应〔6〕。Altieri等〔7〕用小鼠乳腺癌细胞系TS/A和肥大细胞瘤细胞系P815提取exosomes,负载到骨髓细胞源的DC上,免疫荷瘤小鼠,见肿瘤生长缓慢。Bu等〔8〕从胶质瘤患者腹水中提取的exosomes,负载到患者外周血来源的DC上,可刺激胶质瘤患者产生特异性CD8+CTL应答,抑制恶性胶质瘤的生长。Texo实际是一种抗原传递系统,能将肿瘤抗原转移至抗原呈递细胞(APC),从而激活CTL,Texo可作为肿瘤抗原的重要来源,启动免疫效应细胞介导的保护性抗肿瘤反应。Texo作为肿瘤疫苗已成为目前肿瘤免疫治疗研究的热点,但其在抗骨肉瘤免疫应答中的研究尚未见报道。本研究从骨肉瘤细胞成功分离了exosome,为进一步进行免疫治疗研究奠定了基础。
4 参考文献
1Wahlgren J, Karlson Tde L, Glader P,etal. Activated human T cells secrete exosomes that participate in IL-2 mediated immune response signaling 〔J〕. PLoS One, 2012;7(11):e49723.
2King HW, Michael MZ, Gleadle JM. Hypoxic enhancement of exosome release by breast cancer cells〔J〕. BMC Cancer, 2012;12:421.
3Tauro BJ, Greening DW, Mathias RA,etal. Two distinct populations of exosomes are released from LIM1863 colon carcinoma cell-derived organoids〔J〕. Mol Cell Proteomics, 2013;12(3): 587-98.
4金 铮,于金录,杨 皊,等.胶质瘤来源exosomes的鉴定及其蛋白质组成研究〔J〕.中国实验诊断学, 2010;14(9): 1386-9.
5Marleau AM, Chen CS, Joyce JA,etal. Exosome removal as a therapeutic adjuvant in cancer〔J〕. J Transl Med, 2012;10:134.
6Marton A, Vizler C, Kusz E,etal. Melanoma cell-derived exosomes alter macrophage and dendritic cell functions in vitro〔J〕. Immunol Lett, 2012;148(1): 34-8.
7Altieri SL, Khan AN, Tomasi TB. Exosomes from plasmacytoma cells as a tumor vaccine〔J〕. J Immunother, 2004;27(4): 282-8.
8Bu N, Wu H, Sun B,etal. Exosome-loaded dendritic cells elicit tumor-specific CD8+cytotoxic T cells in patients with glioma〔J〕. J Neurooncol, 2011;104(3):659-67.
