微生物多糖提取、分离和纯化方法的技术策略
2014-09-12张红兵胡云霞赵士豪狄柯坪
张红兵 胡云霞 赵士豪 狄柯坪 韩 梅
(河北经贸大学生物科学与工程学院,河北 石家庄 050061)
多糖广泛分布于高等植物、地衣、海藻、动物和微生物中,具有提高免疫力、降血糖、抗肿瘤、抗病毒等多种生物活性,针对一些常见的老年性急慢性疾病具有预防和治疗作用。由于微生物具有繁殖能力强、周期短、成本低、易控制的特点,所以普遍采用微生物发酵法生产多糖,其产量及质量稳步提高,性价比也优于动植物来源的多糖。目前,在食品工业中,微生物多糖已作为胶凝剂、成膜剂、保鲜剂、乳化剂等添加剂,广泛应用于老年保健食品,还有一些微生物胞外多糖及其衍生物具有重要的药用价值,在生物医药领域中受到青睐。
典型的多糖生产工艺流程有如下四个方面〔1〕:①预处理:包括取样、样本储存、样本的清洗和样本的均质(其中均质很重要,因为微生物在生长过程中呈膜状或絮状,不利于后续工艺,均质可以使样本细胞充分分散);②从预处理后的样品中提取多糖;③多糖的纯化;④多糖的分析鉴定。在上述流程中,微生物多糖的提取和纯化是多糖研究的基础和关键,也是工艺的核心内容,一般根据样本特性制订相应的提取方法。本文将对有关提取及纯化新技术成果进行简要介绍。
1 多糖提取方法的选择
能够产生多糖的微生物包括某些细菌、真菌(包括大型食用真菌)和蓝藻类,这些多糖主要以三种形式存在:一是黏附在细胞表面;二是分泌于胞外基质;三是构成细胞成分。因此,提取多糖的方法需根据不同存在形式进行选择。对于可溶性的多糖,尤其是胞外多糖,常采用离心法;而对于结合性多糖,则可以综合多种不同的提取方法。
理想的多糖提取方法首先应该是效率高,尽量避免造成样本细胞的裂解(提取胞内多糖除外),尽可能不破坏多糖结构〔2〕。在实际工作中,常综合表1中列举的数种方法,从多糖提取率和杂质含量的高低两方面进行评判和选择。
提取率的大小测定比较简单,而多糖质量的判定多年在学术界存在一些困惑。早年的一些学者〔3〕根据多糖中蛋白和核酸的含量来评价多糖提取时细胞的裂解状况。然而,近年来的研究认为这种方法并不科学,因为部分多糖分子本身就与蛋白连接,所以蛋白含量仅可参考,而多糖结构中几乎不含核酸成分,如果提取的多糖中含有大量核酸,则表明提取过程中发生了严重的细胞裂解。另外,胞内物质三磷酸腺苷和酶类(如葡萄糖-6-磷酸脱氢酶),也常作为细胞裂解标志物〔2〕,通过紫外可见光谱法测量这些物质含量,可推断所提取多糖的质量。
化学提取法利用添加的化学物质破坏多糖和细胞间的结合力,可加速多糖溶出。比较不同化学方法(CER,HCHO / NaOH,EDTA,戊二醛和碱)提取多糖效率结果显示〔4〕:CER法总粗糖提取率(158±3) mg/g和HCHO/NaOH法的提取率(150±3)mg/g接近。而碱液提取法总粗糖(其中含有大量的水溶性蛋白质等杂质)提取率比CER法高3倍左右〔5〕,但会造成多糖链的断裂破坏,还会因细胞裂解导致产物的污染。研究发现,当pH>9时,NaOH造成多糖链断裂,随着pH增加,糖蛋白中的二硫键会断裂,糖醛酸会水解等。上述变化可以用凝胶渗透色谱法或高效液相排阻色谱法进行检测和评估〔2〕。EDTA法尽管有较高的提取量,细胞裂解程度也低,但残余的EDTA会污染多糖提取物〔6〕(虽然目前可以用透析法部分去除EDTA)。至于HCHO/NaOH方法,HCHO会导致多糖变性,影响碳水化合物结果的判定〔7,8〕。使用水解酶的方法提取多糖是种温和而有效的方法,但目前提取效率还不太高〔9〕,加之成本高,限制其使用。目前,CER法具有高效率和细胞低裂解率,后续工艺中树脂也容易去除,还避免了化学试剂的引入造成多糖污染,利于后续的多糖分析而广泛受到青睐,成为普遍接受的多糖提取法。
物理提取方法包括超声波处理、离心、微波处理及加热等形式,这些方法基本都是利用外力促使多糖从细胞中分离出来并溶解到溶液中达到分离目的,其效率通常比化学法效率低得多。Comte等〔10〕比较了8种提取方法对提取效率的影响,即四种化学方法:CER、EDTA、HCHO/NaOH和戊二醛;二种物理方法:超声波处理、加热;一种综合方法:CER + 超声波处理;用离心法对照。结果表明:EDTA、HCHO/NaOH和戊二醛等三种化学方法的提取效率(96~318 mg/g)远远高于CER、超声波处理、超声波处理 + CER、加热等方法(21~64 mg/g);对照方法效率则最低(仅为16~21 mg/g)。其中,CER方法比加热法略高,前者仅比后者效率高1.1~1.6倍〔4〕。物理提取法与化学提取法相比有一些优势,它仅使多糖分子断裂,引起多糖分子量大小分布的变化,而不会引入其他化学物,故不影响多糖的高效液相排阻色谱图谱指纹,有利于对多糖成分和结构的分析〔11〕。
目前,许多学者更倾向于选用综合方法,即不同方法的有机组合,通常采用超声波辅助其他物理和化学方法进行提取多糖的工艺参数的优化。优化参数包括提取温度、提取时间、溶液的pH值、溶剂的种类等〔12,13〕。郭霞等〔14〕采用复合酶超声波法对桑黄菌丝体多糖提取条件进行了优化,发现提取温度50℃、pH4.8、料液比1∶80、复合酶酶量5%、酶解60 min,提取率可达6.11%,如果再结合超声破碎20 min,多糖提取率可达8.576%,分别是热水提取法、复合酶法和超声波法等简单提取法提取率的2.7倍、1.4倍和1.6倍。
目前,从多糖提取效果来看,还不存在一种通用于所有微生物的万能提取法,只能根据不同样本特征进行方法选择和优化,即将几种提取方案加以比较,反复实验,不断修改,直到获得较满意效果为止。
2 多糖的分离和纯化方法
上述提取物浓缩后加沉淀剂(如乙醇)过夜后离心,沉淀部分再经乙醇分级或超滤分离后,冷冻干燥得到粗多糖。此粗多糖常含有蛋白质、色素、低聚糖、氨基酸等杂质,不仅影响产品的外观性状,而且有些大分子物质可能对人体有害(如致敏因子等),在纯化时应先除去,也就是对多糖纯化前先进行分离,然后再进一步纯化制备纯度较高或相对单一的多糖。
2.1多糖的分离 实验室中常采用蛋白质变性剂、盐析、透析等方法,也有的实验室采用层析(包括离子交换层析和亲和层析)、凝胶过滤、超滤和电泳法等较先进的方法。见表2。
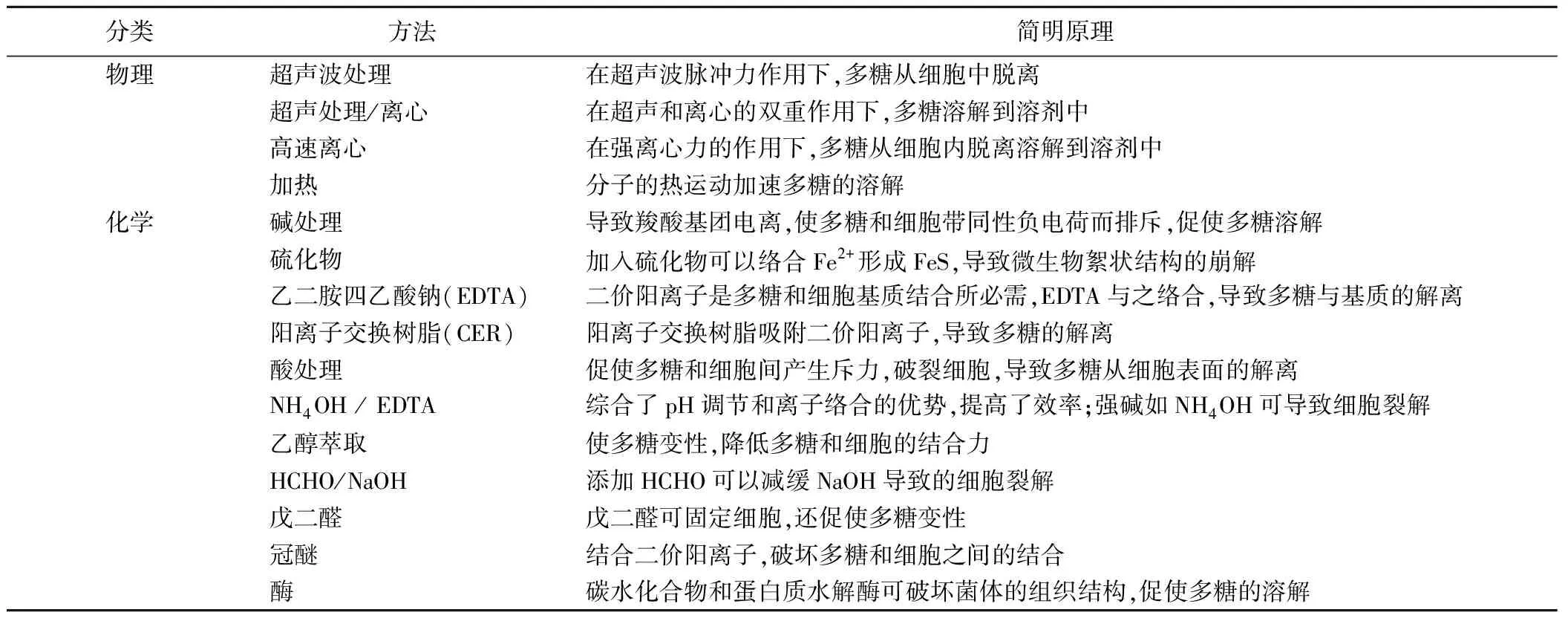
表1 微生物多糖提取方法和简明原理

表2 微生物多糖分离方法和简明原理
在实际操作中,如果采用化学方法除去杂质,应该注意反应过程中可能会产生熔解热,应给予降温措施,防止多糖降解;还应该考虑到化学试剂对目标物质造成不同程度损失和破坏,所以操作不易剧烈,而且应尽量避免使用次数过多。实验室中常用 sevag法除去蛋白,二乙氨基乙基纤维素(DEAE Cellulose)柱层析除去色素,透析法和超滤法除去小分子杂质〔15〕。
2.2多糖的纯化和分级 提取液除去色素、单糖、蛋白质等杂质后的多糖仍是多糖混合物,需进一步分离纯化为单一多糖,才能完成多糖分级。最常用方法是利用多糖在乙醇中溶解度差异进行分级沉淀分离。也可根据多糖电荷密度不同,用季铵盐络合物、电泳、色谱(包括阴、阳离子交换色谱,琼脂糖或葡聚糖凝胶色谱和高效液相色谱)、层析方法进行纯化分级,也可根据多糖分子量大小利用凝胶过滤色谱、超滤等技术进行分级,见表3。

表3 微生物多糖纯化分级方法和简明原理
利用30%~50%乙醇沉淀法纯化多糖,此时效率最高,但仍然要注意和多糖的损失和断裂破坏,而季铵盐只能与酸性多糖结合,需要注意调整溶液pH值,季铵盐浓度控制在100~1 000 g/L之间较为适宜。
随着分析化学技术的提高,目前纯化多糖等活性物质更倾向于利用层析法,包括按分子量大小和形状分离的凝胶柱层析、按多糖极性大小分离的离子交换柱层析和按配体性质分离的亲和层析。前两者需要采用洗脱液进行梯度洗脱,洗脱液为纯水、各种浓度的盐溶液及缓冲液,其离子强度依实验样本和分离目标确定。随着亲和技术发展,亲和层析分级法逐步成为研究热点,它具有高度特异性,甚至相同分子量大小的α-葡聚糖(吸附部分)和β-葡聚糖(非吸附部分)都可以区分开来,这是其他方法难以比拟的。Sigma-Aldrich公司已开发了多种含有配体的填料,不同配体与不同的多糖具有亲和特异性。如:L2507和L5147两者用于纯化与氧(-O)相连的糖蛋白及含有α-D-半乳糖的糖蛋白;L8775的特异性是直接与末端为α-D-甘露糖残基的糖复合物非还原端相连接;L4018具有与末端为α-D-甘露糖残基和α-D葡萄糖基残基的多糖亲和性,用于分离凝胶过滤层析分离后仍然结合在一起的α-和β-葡聚糖〔16〕。至于高效液相色谱(HPLC)法,其机制与层析法相似。
3 小 结
多糖的提取和纯化从传统的溶剂萃取法、乙醇分级法,到酶法、超声辅助法和微波辅助法及层析、超滤和电泳技术综合运用,使多糖提取效率和质量都有所提高,但同时提取条件的要求越来越苛刻,仪器成本和提取成本也逐步增加。对于不同用途的多糖,要根据其原料的来源、现具备的条件、多糖使用目的,采用切实可行的提取方法和预处理方法。为了达到最好提取效果,可以将数种提取方法配合起来使用,以获得较佳结果。
4 参考文献
1Sheng GP,Yu HQ,Li XY.Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems:a review〔J〕.Biotechnol Adv,2010;28(6):882-94.
2Frφlund B,Palmgren R,Keiding K,etal.Extraction of extracellular polymers from activated sludge using a cation exchange resin〔J〕.Water Res,1996;30(8):1749-58.
3Brown MJ,Lester JN.Comparison of bacterial extracellular polymer extraction methods〔J〕.Appl Environ Microbiol,1980;40(2):179-85.
4Domínguez L,Rodríguez M,Prats D.Effect of different extraction methods on bound EPS from MBR sludges.Part I:Influence of extraction methods over three-dimensional EEM fluorescence spectroscopy fingerprint〔J〕. Desalination,2010;261(1-2):19-26.
5Garcia Becerra FY,Acosta EJ,Allen DG. Alkaline extraction of wastewater activated sludge biosolids〔J〕.Bioresour Technol,2010;101(18):6983-91.
6Comte S,Guibaud G,Baudu M.Biosorption properties of extracellular polymeric substances (EPS) resulting from activated sludge according to their type:Soluble or bound〔J〕.Pro Biochem,2006;41(4):815-23.
7Bala Subramanian S,Yan S,Tyagi RD,etal. Extracellular polymeric substances(EPS) producing bacterial strains of municipal wastewater sludge: isolation, molecular identification, EPS characterization and performance for sludge settling and dewatering〔J〕. Water Res,2010;44(7):2253-66.
8Sheng GP,Yu HQ,Yu Z.Extraction of extracellular polymeric substances from the photosynthetic bacterium Rhodopseudomonas acidophila〔J〕. Appl Microbiol Biotechnol,2005;67(1):125-30.
9Sesay ML,Özcengiz G,Dilek Sanin F.Enzymatic extraction of activated sludge extracellular polymers and implications on bioflocculation〔J〕. Water Res,2006;40(7):1359-66.
10Comte S,Guibaud G,Baudu M.Relations between extraction protocols for activated sludge extracellular polymeric substances (EPS) and EPS complexation properties:Part I.Comparison of the efficiency of eight EPS extraction methods〔J〕.Enzyme Micr Technol,2006;38(1-2):237-45.
11Comte S,Guibaud G,Baudu M.Effect of extraction method on EPS from activated sludge:an HPSEC investigation〔J〕.J Hazard Mater,2007;140(1-2):129-37.
12Deng P,Zhang G,Zhou B,etal.Extraction and in vitro antioxidant activity of intracellular polysaccharide by Pholiota adiposa SX-02〔J〕.J Biosci Bioeng,2011;111(1):50-4.
13Erden G,Demir O,Filibeli A.Disintegration of biological sludge:Effect of ozone oxidation and ultrasonic treatment on aerobic digestibility〔J〕. Bioresour Technol,2010;101(21):8093-8.
14郭 霞,邹 祥,孙 敏.桑黄菌丝体多糖提取方法比较及优化研究〔J〕.食用菌,2009;31(3):62-4.
15鞠 海,张建民,魏 锋,等.天然多糖的分离、纯化和结构鉴定〔J〕.国外医药·植物药分册,2000;15(3):107-13.
16Zhang M,Cui SW,Cheung PCK,etal.Antitumor polysaccharides from mushrooms:a review on their isolation process,structural characteristics and antitumor activity〔J〕.Trends Food Sci Technol,2007;18(1):4-19.
