SiRNA 靶向RKIP促进肝星状细胞在细胞外基质上的黏附
2014-09-12马俊骥姜慧卿
马俊骥 赵 慧 姜慧卿
(河北医科大学第二医院消化内科 河北省消化病实验室 河北省消化病研究所,河北 石家庄 050000)
肝纤维化慢性肝损伤发展为肝硬化的共同病理改变,表现为肝脏细胞外基质(ECM)的过度合成与异常沉积〔1〕。肝星状细胞(HSC)是慢性肝损伤后合成ECM并参与纤维化进程最主要的细胞成分,HSC的激活是肝纤维化发生的中心环节〔2, 3〕。前期的研究发现,Raf激酶抑制蛋白(RKIP)在肝脏纤维化组织表达下降,HSC活化后RKIP表达降低,RKIP过表达可以促进HSC迁移〔4, 5〕。RKIP低表达与HSC在细胞外基质上黏附的关系目前尚不清楚。本研究采用siRNA靶向介导RKIP基因,研究RKIP低表达对HSC在细胞外基质上黏附的影响。
1 材料和方法
1.1材料 HSC细胞株人LX-2经美国Friedman教授授权由美国Mount Sinai医科大学惠赠。RKIP-RNAi-AD为靶向RKIP基因并表达绿色荧光蛋白 (GFP)的重组腺病毒载体,携带的靶向序列为5′-CGAGCAGCTGTCTGGGAAGTA-3′,NC-RNAi-GFP-AD为仅表达GFP的腺病毒对照。
1.2方法
1.2.1细胞培养和病毒感染分组 将保存于液氮中的LX-2细胞株取出,立即37℃水浴复苏,于超净工作台中加2 ml的DMEM培养基,1 200 r/min离心5 min,以10% FBS、100 IU/ml青霉素、100 μg/ml链霉素、4 mmol/L谷氨酰胺及1 mol/L HEPES的DMEM培养基稀释成1×106/ml的浓度接种于75 cm2培养瓶中,37 ℃、5% CO2条件的培养箱中培养。当生长至致密单层时,用0.25%胰蛋白酶消化,以1∶4传代,24 h换液1次,72 h再次培养传代。病毒感染HSC的分组: RKIP-RNAi-AD组,在HSC内靶向敲除RKIP基因并表达GFP基因;NC-RNAi-GFP-AD对照组,在HSC内表达外源GFP基因。将LX-2细胞以每孔3 000个接种于96孔板中,但细胞生长至90%左右时,RKIP-RNAi-AD重组腺病毒或者NC-RNAi-GFP-AD腺病毒按MOI值分别为5、10、15、20干预细胞,每种MOI设10个复孔,分别于12、24、48 h于荧光显微镜下观察细胞状态,并计数荧光数。
1.2.2Western 印迹 取腺病毒干预的LX-2细胞,弃去上清,冰冷的PBS漂洗两遍,加入1 ml PBS液,细胞刮刀将细胞刮下,移入Eppendorf管中,4℃ 3 000 r/min离心10 min。弃上清,加入150 μl改良的RIPA裂解缓冲液,微型混合器上充分振荡,冰上静置裂解30 min,4 ℃10 000 r/min离心10 min,取上清用Braford法测总蛋白含量。按每孔80 μg计算样品的上样量,将蛋白样品与上样缓冲液以4∶1的比例混匀,煮沸5 min加在上样孔中,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),分离胶的浓度为12%。用0.22 μm PVDF膜进行冰浴转膜,取出膜用5%脱脂奶粉在室温下封闭4 h。4 ℃下一抗封闭过夜。二抗室温封闭2 h。在暗室中滴加ECL试剂反应3 min,曝光、显影和定影。显影条带经香港基因公司G∶BOX凝胶成像分析仪采集后,用美国NIH ImageJ 1.38软件进行定量分析。RKIP以GAPDH作为内参照,结果以目的条带和内参照的光密度百分比来表示。
1.2.3黏附试验 (1) matrigel的配制:用DMEM (无Ca2+、Mg2+)稀释为50 μg/ml备用。(2) I型胶原的配制:用无菌10×PBS、dH2O和1N NaOH稀释成50 μg/ml。(3) 纤维连接蛋白:用DMEM (Ca2+、Mg2+)稀释为50 μg/ml备用。(4) 包被孔板:在超净工作台上,取配置好的基质胶以200 μl/孔均匀平铺于24板内,每组设3个复孔,置于4℃冰箱中过夜。之后用无菌PBS洗去多余的基质胶,每孔加入0.5% BSA 200 μl室温孵育30 min,无菌PBS漂洗3遍备用。(5) 将RKIP-RNAi-AD腺病毒或者NC-RNAi-GFP-AD腺病毒感染的细胞从培养箱中取出,弃上清,以0.25%胰蛋白酶消化至细胞松散后,弃去消化液,加入3 ml 0%DMEM培养基,制成单细胞悬液计数后稀释成1×105/ml的浓度。将细胞悬液接种在包被好的24孔板内,每孔接种1 ml,置于37 ℃、5% CO2培养箱中孵育1 h后取出培养板,吸去上清,无菌PBS洗去未黏附的细胞,4%多聚甲醛固定30 min,PBS漂洗后,结晶紫染色15 min,在200倍显微镜下随机选取12个不同视野计数细胞数,并采集图片。
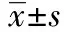
2 结 果
2.1SiRNA靶向敲除RKIP基因后Western 印迹鉴定结果 选择MOI值为5的RKIP-RNAi-AD感染LX-2后48 h,荧光显微镜下观察含荧光的细胞数,计算细胞感染率80%~90%。与NC-RNAi-GFP-AD组相比,RKIP-RNAi-AD组目的蛋白RKIP表达明显下降(0.29±0.06 vs 0.73±0.14,P<0.05)。 见图1。
2.2RKIP减少致HSC在matrigel上的黏附增多 RKIP-RNAi-AD组和对照NC-RNAi-GFP-AD组相比,在matrigel上黏附的LX-2细胞数明显增多(170±25 vs 66±12,P<0.05)。见图2。
2.3RKIP减少致HSC在I型胶原上的黏附增多 与NC-RNAi-GFP-AD组相比,RKIP-RNAi-AD感染的LX-2细胞在I型胶原上黏附的细胞数明显增多(200±25 vs 82±13,P<0.05)。见图3。
2.4RKIP减少致HSC在纤维连接蛋白上的黏附增多 与NC-RNAi-GFP-AD组相比,RKIP-RNAi-AD感染的LX-2细胞在纤维连接蛋白上黏附的细胞数明显增多(276±28 vs 96±17,P<0.05)。见图4。
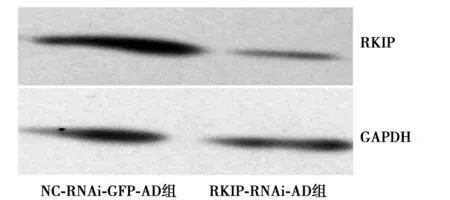
图1 RKIP的RNAi腺病毒感染HSC后的Western 印迹结果
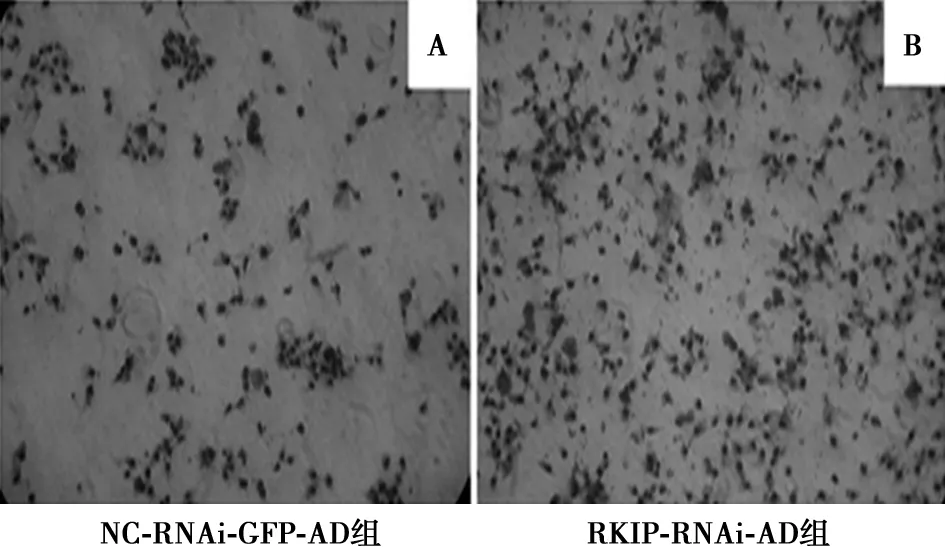
图2 HSC与matrigel基质胶的黏附
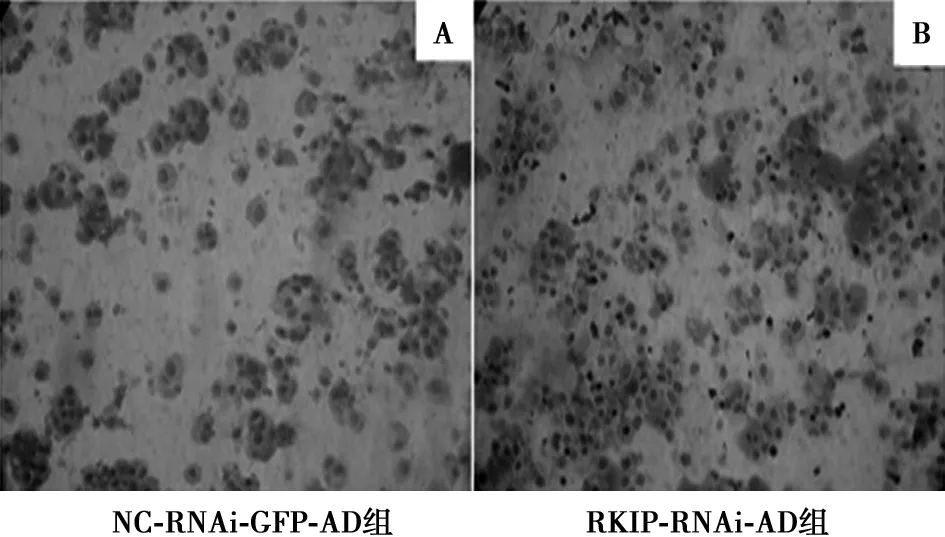
图3 HSC与I型胶原的黏附

图4 HSC与纤维连接蛋白的黏附
3 讨 论
病毒、酒精、糖尿病、肥胖、免疫性疾病、药物和胆汁淤积等损伤都能对肝脏产生慢性刺激,导致肝脏不断地再生进而引起实质结构和血管构成(门脉系统和肝静脉系统)的紊乱,最后可以形成肝结节样结构即肝硬化,血管构成紊乱可以导致门脉高压的形成〔6〕。如果肝脏维持正常承载量,则肝硬化患者能够保证一段时间正常肝功能(代偿期);但在很多时候肝脏功能最终出现失代偿,甚至需要肝脏移植才能维持生存。因此,肝纤维化作为各种慢性肝病进展过程中一个共同的病理环节,深入研究其发生机制至关重要。
我们前期利用胆总管结扎的肝纤维化动物模型发现RKIP在肝脏纤维化组织表达下降,同时伴随Raf/MEK/ERK信号通路活化〔4〕。原代HSC的体外培养证实随着HSC在体外活化,RKIP的表达也明显降低,进一步研究证实RKIP抑制HSC细胞增殖,但却促进其迁移,用RKIP抑制剂Locostatin可以抑制HSC迁移〔5〕。HSC在正常肝脏占肝脏细胞数量的5%~10%,定居在Disse间隙,病理因素刺激后HSC活化可以迁移黏附在受损伤的组织,参与损伤修复。长期的慢性刺激可以导致HSC过度活化并伴随ECM过度沉积,导致肝纤维化、肝硬化和门脉高压的产生。
ECM主要包括胶原、非胶原糖蛋白和蛋白多糖。肝纤维化的病理改变即是肝脏内ECM异常沉积〔7〕。在肝纤维化形成过程中,胶原成分中最密切的是I型的沉积,随着肝纤维化的发生,I型胶原从基因表达和蛋白水平上都明显增加〔8〕。已发现非胶原糖蛋白如纤维连接蛋白、层黏连蛋白、腱生蛋白、分层蛋白、巢蛋白和透明质酸表达增加。肝窦状腺内皮细胞和HSCs拥有共同的胚胎起源,由肝窦状腺内皮细胞生成的纤维连接蛋白薄片早期变化能够激活HSCs〔9〕。一些蛋白多糖成分如肝素、皮肤素、硫酸软骨素、基底膜蛋白多糖、核心蛋白多糖等也过度沉积。
本研究结果显示RKIP低表达可以明显增加HSC在细胞外基质matrigel基质胶上黏附的细胞数,同时也可以增加HSC在Ⅰ型胶原和纤维连接蛋白上的黏附。反映了在病理状态下RKIP在HSC中的降低与其黏附功能的改变密切相关,这可以保证HSC对损伤肝脏的修复,但同时会导致肝脏纤维过程的进展。RKIP低表达与肝纤维化的关系可能是其促进了HSC在I型胶原和纤维连接蛋白上的黏附,进而增加HSC在ECM上的黏附。结合前期的研究也有可能是因为RKIP低表达更促进了Raf-1/MEK/ERK1和NF-κB等信号通路的活化。RKIP的分子量为23 kDa,具有与磷脂酰乙醇胺结合的特性,RKIP可以干扰Raf-1的激活,进而负向调节Raf/MEK/ERK信号通路,还可以通过G蛋白耦联受体(GPCR)介导的信号通路及NF-κB信号通路发挥其调节作用〔5~10〕。
综上所述,在肝纤维化形成过程中,HSC活化后RKIP表达下降可以促进HSC在细胞外基质上的黏附功能,此与肝脏组织的修复功能有关,但却加重了肝纤维化的进程。
4 参考文献
1Friedman SL. Mechanisms of hepatic fibrogenesis〔J〕.Gastroenterology,2008;134(6):1655-69.
2马俊骥, 时军利, 赵 慧, 等. 大鼠原代肝星状细胞的分离方法研究〔J〕. 河北医科大学学报,2012; 33(1): 1-3, 封3.
3Olsen AL, Bloomer SA,Chan EP,etal.Hepatic stellate cells require a stiff environment for myofibroblastic differentiation〔J〕.Am J Physiol Gastrointest Liver Physiol,2011;301(1): G110-8.
4马俊骥, 姜慧卿, 李芳芳, 等. RKIP在胆总管结扎肝纤维化大鼠肝脏组织的表达〔J〕. 中国老年学杂志,2008; 28(20): 1998-2000.
5Ma J,Li F,Liu L,etal. Raf kinase inhibitor protein inhibits cell proliferation but promotes cell migration in rat hepatic stellate cells〔J〕.Liver Int,2009; 29(4): 567-74.
6Wells RG. The role of matrix stiffness in regulating cell behavior〔J〕.Hepatology,2008;47(4): 1394-400.
7Tarrats N,Moles A,Morales A,etal. Critical role of tumor necrosis factor receptor 1,but not 2,in hepatic stellate cell proliferation,extracellular matrix remodeling,and liver fibrogenesis〔J〕.Hepatology,2011;54(1): 319-27.
8Dooley S,Ten Dijke P. TGF-β in progression of liver disease〔J〕.Cell Tissue Res,2012;347(1): 245-56.
9Jarnagin WR,Rockey DC,Koteliansky VE,etal. Expression of variant fibronectins in wound healing: cellular source and biological activity of the EIIIA segment in rat hepatic fibrogenesis〔J〕.J Cell Biol,1994;127(6 Pt2): 2037-48.
10Klysik J,Theroux SJ,Sedivy JM,etal. Signaling crossroads: The function of Raf kinase inhibitory protein in cancer,the central nervous system and reproduction〔J〕.Cell Signal,2008;20(1):1-9.
