术后早期经口肠内免疫营养对老年胃肠癌患者术后营养状态和免疫功能的影响
2014-09-12郑建涛李良庆
郑建涛 张 琳 李良庆
(福建医科大学附属第一医院胃肠外科,福建 福州 350005)
随着人们的饮食习惯以及环境因素变化,我国胃肠癌(GIC)发病率也逐年上升〔1〕。胃癌(GC)发病机制虽然还没有完全明确,但是通常认为,GC和外界环境以及饮食因素有着密切关系〔2〕。研究〔3〕认为,GC的发生可能和遗传因素以及饮食因素相关。肠癌(IC)也和生活方式密切相关,如高脂肪类饮食以及纤维素类摄取量不足,均可能引发IC。运动少、生活条件好及久坐不动人群已成为高危群体。GIC病患大多伴随营养不良以及免疫抑制。研究〔4〕表明,癌症病患术后早期实施营养支持有利于减少感染,保持病患免疫功能,以及促进切口愈合,缩减住院时长等。我院自对GIC病患实施早期术后经口肠内免疫营养(OEIN)。通过评价其营养状态以及免疫功能变化,旨在为GIC早期术后实施OEIN提供理论依据。
1 资料和方法
1.1临床资料 选择2010年7月至2013年7月我院收治的100例GIC患者,术前均经CT或胃肠镜确诊断,术后病理组织活检证实为恶性肿瘤,并排除心、肺、肝、肾功能异常及糖尿病、及内分泌疾病等患者。按照数字随机法分为两组。观察组男27例,女23例;年龄62~80〔平均(69.1±7.5)〕岁;其中GC患者32例,结肠癌(CC)12例,直肠癌(RC)6例。对照组男26例,女24例;年龄60~83〔平均(70.9±7.3)〕岁;其中GC 30例,CC 13例,RC 7例。所有病患术前均未实施免疫营养(IN)。
1.2营养方式
1.2.1观察组实施早期OEIN 病患术后第1天起,由空肠造口管给予百普力(纽迪希亚制药有限公司,国药准字H20010285)。第1天385 ml,流速19 ml/h;第2天770 ml,流速38 ml/h,第3~8天1 150 ml,流速57 ml/h。供给量不足全量前,给予肠外营养(PN)补充。
1.2.2对照组实施PN 病患术后第1天起实施PN,第1天为全量1/3,第2天为2/3,第3~8天给予全量。全量配方:热量,125 kJ·kg-1·d-1,糖脂比6∶4;胆量,0.15~0.2 g·kg-1·d-1,热氮比150 kcal∶1 g。氮源为乐凡命(华瑞制药有限公司,国药准字H10980027)。
1.3观察指标 营养指标:转铁蛋白(TF),清蛋白(ALB)以及前清蛋白(PA)。免疫指标:免疫球蛋白(Ig):IgA、IgG、IgM、T细胞亚群(TCS):CD3、CD4、CD8。
炎症指标:补体C3、C4以及C反应蛋白(CRP)。营养指标和Ig以及炎症指标均选用Array360检测仪测定。TCS采用Beckman流式细胞仪检测。比较两组病患营养状态以及免疫功能情况。
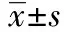
2 结 果
2.1两组病患营养情况比较 观察组术后TF、ALB、PA较对照组术后明显更高(均P<0.05)。见表1。
2.2两组病患免疫功能情况比较 观察组术后IgG、IgA、IgM以及CD3、CD4、CD4/CD8均明显上升,而对照组术后明显下降。观察组术后CD8明显下降,而对照组术后明显上升(均P<0.05)。见表2。
2.3两组病患炎症指标比较 观察组手术前后C3、C4没有明显变化(均P>0.05)。而对照组术后C3、C4均明显上升。两组术后CRP均明显上升,而观察组上升幅度明显小于对照组(均P<0.05)。见表3。
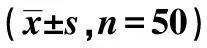
表1 两组病患营养情况比较
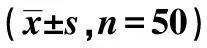
表2 两组病患免疫功能情况比较
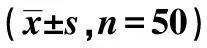
表3 两组病患炎症指标比较
3 讨 论
GIC会直接影响患者的进食以及消化吸收,再加上癌症本身对患者机体的耗损,导致患者在病情发展中往往会出现不同程度的营养不良,并进一步引发免疫功能衰减,从而造成患者恢复缓慢,甚至有可能引发癌症细胞扩散〔4〕。因此,术后改善GIC患者营养状态以及免疫功能意义重大。IN通过输入富含谷氨酰胺(Gln),精氨酸(Arg)以及ω-3脂肪酸(ω-3 FA)等营养成分,能够在机体免疫中起重要作用。目前,比较常用的营养方式为PN。但是PN的长期应用,很容易引起医源性肠饥饿综合征〔5〕。而肠内营养(EN)是通过胃肠道为患者提供代谢所需要的营养物质以及其他各类营养素的方式。较之PN支持,EN优越性除了体现在其营养素经肠直接吸收并利用,更加符合生理,给药更加方便,且费用便宜之外,还有利于肠的黏膜结构以及屏障功能的完整性维持〔6〕。因此在选择营养方式时,EN已经成为首选之法。
营养不良为GIC患者最常见临床表现,发生机制非常复杂。血清蛋白能够很好地反映患者营养情况,常用指标有TF、ALB以及PA。本研究结果与张志杰〔7〕的报道相符。说明OEIN更有利于改善病患营养状况。这可能是因为EN不但可以维持病患营养状况,还可以促进其肠道蠕动,从而维持肠黏膜的结构以及功能完整性,缓解肝脏负担,对消化液以及胃肠激素的分泌也有刺激作用,使得代谢更加符合生理,进而更好地改善患者营养状况〔8〕。从免疫功能方便分析,本研究提示观察组患者免疫功能更好。符合陶苏红等〔9〕报道。这可能是因为GIC患者术后处于高应激以及高分解状态,所必需的氨基酸下降,严重影响其免疫细胞能量供给,导致其生成减少,从而数量下降,而CD3为T细胞成熟标志物,当发生免疫缺陷,CD3便会下降〔10〕。T细胞分为CD4和CD8两个亚群。GIC患者免疫功能通常会受抑制,从而表现为CD4下降,CD8相对上升,以及CD4/CD8下降〔11,12〕。而观察组通过实施IN,为患者提供其免疫所需营养物质,改善其免疫功能。从炎症因子方面来看,本研究符合孙金利等〔13〕报道,说明OEIN能有效降低病患炎症反应。
4 参考文献
1陈思曾,张永炼,桂 翔,等.术后早期肠内免疫营养对胃肠癌病人营养状态、免疫功能和炎症反应的影响〔J〕.肠外与肠内营养,2011;18(5):277-80,283.
2周伯良.术后早期肠内免疫营养对结肠癌患者的影响〔J〕.中国现代普通外科进展,2013;16(10):828-30.
3张维丰.联合加用丙氨酰谷氨酰胺的肠外营养对胃肠癌患者术后营养及免疫功能的影响〔J〕.中国临床药理学杂志,2012;28(12):947-9.
4夏晓明,施仁忠,张亚锋,等.食管癌术后早期肠内营养对患者免疫功能的影响〔J〕.山东医药,2012;52(18):38-9.
5魏 立,孙 洋,朱 珍,等.经鼻肠管早期肠内营养在食管癌术后患者中的应用〔J〕.中华现代护理杂志,2012;18(35):4227-31.
6胡桂清.两种营养支持方式对食管癌根治术后患者营养指标的影响〔J〕.齐鲁护理杂志,2012;18(29):135-6.
7张志杰.食管癌术后早期肠内营养的疗效观察〔J〕.中国误诊学杂志,2012;12(2):289.
8顾荣民,文 旭,韦 达,等.术中腹腔灌注化疗及术后营养支持对进展期胃癌术后肠黏膜屏障功能及免疫功能的影响〔J〕.中华胃肠外科杂志,2012;15(5):468-72.
9陶苏红,邵建芬,徐研文,等.肠内营养及生长激素对食管癌病人术后营养和免疫的影响〔J〕.护士进修杂志,2009;24(21):2009-10.
10徐国栋,王树钦,林文君,等.食管癌术后早期肠内营养的临床应用观察〔J〕.中国基层医药,2011;18(5):650-1.
11钟武装,肖丽萍,蔡敏捷,等.早期肠内营养对老年胃癌患者术后免疫功能的影响〔J〕.中国老年学杂志,2013;33(2):280-2.
12肖喜春.免疫肠内营养支持对危重病患者细胞免疫功能及并发症的影响〔J〕.中国医药导报,2009;6(16):20-2.
13孙金利,祝国莲.早期肠内营养支持对胃癌术后患者营养状况和临床结局的影响〔J〕.中国实用医刊,2013;40(4):55-6.
