Mycoplas mamy coidessubsp.mycoidesBen-1株一个新的膜蛋白的特性研究
2014-09-10周玉梅邹晓辉刘素丽吴金迪辛九庆
周玉梅,汪 洋,李 媛,邹晓辉,刘素丽,白 帆,吴金迪,辛九庆*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/国家牛传染性胸膜肺炎指定检测实验室,黑龙江哈尔滨 150001;2.东北农业大学动物医学院,黑龙江哈尔滨 150001;3.吉林农业大学动物科学技术学院,吉林长春 130118)
Mycoplas mamy coidessubsp.mycoidesBen-1株一个新的膜蛋白的特性研究
周玉梅1,汪 洋1,李 媛1,邹晓辉1,刘素丽1,白 帆3,吴金迪2,辛九庆1*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/国家牛传染性胸膜肺炎指定检测实验室,黑龙江哈尔滨 150001;2.东北农业大学动物医学院,黑龙江哈尔滨 150001;3.吉林农业大学动物科学技术学院,吉林长春 130118)
为研究Mycoplasma mycoidessubsp.mycoides(Mmm)Ben-1弱毒疫苗传代致弱的机制,本研究通过比较Mmm Ben-1株和其兔体内传代致弱毒株Ben-470的全基因组序列,发现在Ben-470株中缺失了一个编码165个氨基酸(分子量约19 ku)的495 bp的假定蛋白基因,命名为p588,扩增该基因,并表达重组P588(rP588)蛋白,制备兔抗血清。经细菌膜蛋白不同组份的提取及western blot鉴定,结果显示P588是一种膜蛋白,并且rP588与CBPP国际标准血清呈阳性反应。通过激光共聚焦显微镜观察到rP588对牛肺细胞(EBL)具有明显的粘附作用,并且ELISA试验也证明该蛋白的这种粘附为特异性粘附。上述结果表明P588蛋白是Mmm Ben-1的一个粘附蛋白。
牛传染性胸膜肺炎;基因P 588;粘附
Mycoplasmamycoidessubsp.MycoidesSmall Colony(Mmm SC),根据最新的命名法改名为Mycoplasma mycoidessubsp.mycoides(Mmm)[1],是牛传染性胸膜肺炎(CBPP)的病原。CBPP被OIE列为必须通报的传染病,该疾病可引起牛呼吸道的一系列病理变化,能够引起很高的病死率,给畜牧业生产造成极大的经济损失。目前,由于经济落后等因素,CBPP在非洲许多国家还大范围流行[2]。20世纪50年代,中国从感染CBPP的牛体内分离到Mmm强毒株Ben-1,将该菌株在兔体内连续传代470次后,对牛的毒力明显降低[3]。Ben-1同其兔体传代致弱株Ben-470在毒力和免疫保护力之间存在明显的差异,但其致弱机理尚不清楚。
支原体是一种能自我复制的最小的微生物,对宿主细胞的粘附是致病性支原体感染过程的先决条件[4]。虽然粘附因子在许多支原体中已经鉴定到[5-7],但对Mmm的特异性粘附因子的研究鲜有报道。本研究比较了强毒株Mmm Ben-1同其异体动物传代致弱株Ben-470株全基因组序列,发现一个假定蛋白编码基因p588在Mmm Ben-1株中存在而在Ben-470株中缺失。通过原核表达重组P588蛋白,并证明制备的重组P588蛋白可以特异性粘附胎牛肺细胞(EBL),该研究为Mmm Ben-1致病机制及其致弱机理的研究奠定了基础。
1 材料和方法
1.1 菌株、细胞及载体 Mmm Ben-1、Ben-470基因组DNA及cDNA、EBL细胞及pET-30a载体均由本实验室保存。
1.2 主要试剂 rTaqDNA聚合酶、dNTP、PCR Buffer购自Fermentas公司;CBPP国际标准阳性血清及阴性血清由葡萄牙CBPP国际参考实验室提供;辣根过氧化酶标记的鼠抗兔IgG(HRP-IgG)、DyLight700羊抗兔 IgG、FITC-鼠抗兔 IgG(FITCIgG)购自Sigma公司;细胞核荧光染料DAPI购自Merk公司;质粒提取试剂盒、胶回收试剂盒均购自Omega公司;Ni-NTA树脂购自Novagen公司;激光共聚焦平皿购自Nest公司。
1.3 目的基因的扩增及重组质粒的构建 以Mmm Ben-1基因组提取物为模板,根据p588基因序列(KF439701)设计引物,5'-CCCGGATCCATGAAACA CAAAAACAAAC-3'为上游引物,5'-CCCAAGCTTT TAACCTCTAGTTAAAACTTTAG-3'为下游引物,扩增得到全长约为495 bp的目的基因全长片段。同时以Ben-1总RNA反转录得到的cDNA、Ben-470的基因组DNA、cDNA为模板,以上述引物扩增p588。将PCR产物进行BamHⅠ和HindⅢ双酶切,克隆于pET-30a载体中。
1.4 重组蛋白的表达与纯化 重组质粒转化感受态E.coliBL21中,重组菌经IPTG诱导,离心收集菌体超声破碎,离心后,上清液通过Ni-NTA树脂,按照Novagen说明书进行重组蛋白纯化,纯化的蛋白经超滤去除咪唑后通过BCA定量试剂盒定量。
1.5 抗重组蛋白兔血清的制备 将500 μL(2 mg/mL)纯化后蛋白通过SDS-PAGE电泳后,用250 mM的KCl染色,将目的条带切下碾碎加入500 μL PBS混匀后直接免疫新西兰大白兔,每间隔2周免疫1次,共3次。心脏采血制备抗血清,并利用ELISA测定血清效价,免疫前的兔血清为阴性对照。
1.6 重组蛋白的鉴定 将rP588与CBPP国际标准阳性血清(1∶200)反应,上述步骤中制备的抗rP588多克隆抗体(1∶200)和CBPP国际标准阴性血清(1∶200)分别作为阳性对照和阴性对照。鼠抗兔HRP-IgG(1∶8 000)为二抗,通过HRP-DAB底物显色试剂盒显色。
1.7r P 5 8 8在Mmm中的细胞定位 将提取的Mmm Ben-1的细胞膜蛋白和胞浆蛋白进行SDSPAGE电泳,转移至NC膜,与抗rP588多克隆抗体(1∶50)反应,rP588蛋白作为阳性对照,Ben-470总蛋白和BSA作为阴性对照。羊抗兔DyLight700-IgG(1∶5 000)为二抗,用红外荧光扫描仪扫描。
1.8 重组蛋白粘附细胞及粘附抑制试验 本试验操作步骤按改进的文献[8]方法进行。其中每个共聚焦平皿中加入rP588蛋白的量为20 μg,PBST洗去未粘附的蛋白后,以制备的抗重组蛋白多克隆抗体(1:400)为一抗,以鼠抗兔FITC-IgG(1:200)为二抗标记重组蛋白,以1 mL 5 μg/mL的Dii和DAPI分别进行细胞膜和细胞核染色。利用Leica TCS SP5激光共聚焦显微镜(CLSM)观察重组蛋白粘附情况。BSA同EBL细胞孵育作为阴性对照组。抑制试验中,20 μg蛋白先与20 μL的抗rP588多抗37℃孵育30 min,加入固定后的铺有80%EBL细胞的共聚焦平皿中,其后操作步骤同上。
1.9 重组蛋白的特异性粘附试验 本试验操作步骤按文献[8]的方法加以改进。其中重组蛋白用PBST从100 μg/mL开始进行倍比稀释至128倍,取每个稀释度的蛋白溶液100 μL包被ELISA板,37℃孵育 1 h,加入100 μL 1∶200倍稀释的兔抗重组蛋白血清,37℃孵育1 h后加入鼠抗兔HRP-IgG,37℃孵育1 h,显色并测其OD450nm值。以上操作均重复3次。另用PBST将兔抗重组蛋白血清依次以5、10、40…倍比稀释至640倍,取各个稀释度的血清50 μL与 50 μL 含有 0.5 μg 重组蛋白的 PBST 混合,使蛋白血清混合物中血清稀释倍数依次为10、20、40…至1 280,将各个稀释度的100 μL血清及重组蛋白混合液加入已包被的ELISA板中,依上述方式加一抗二抗标记,并测各个稀释度的OD450nm值。以上每个操作重复3次。
2 结 果
2.1 目的基因的扩增分析及重组质粒的构建 以Mmm Ben-1全基因组及其总RNA反转录制备的cDNA为模板,进行PCR扩增,得到了约500 bp的PCR产物,测序结果表明目的基因与参考基因完全一致(图1)。以Ben-470全基因组及其cDNA为模板,未得到相应的PCR产物。

图1 Mmm Ben-1和Ben-470中p588的克隆和分析Fig.1 Amplification of p588 gene from Mmm Ben-1 and Ben-470
2.2 重组蛋白的原核表达与纯化及多克隆抗体的制备 将重组质粒p588-pET-30a转化E.coliBL21(DE3)感受态细胞中,经IPTG诱导表达目的蛋白,经Ni-NTA树脂纯化该蛋白,SDS-PAGE电泳显示该重组蛋白大小约为25 ku(图 2)。根据重组蛋白在SDS-PAGE上的大小将其命名为rP588。
2.3 重组蛋白的鉴定 二抗孵育后的NC膜显色结果显示,rP588与CBPP国际标准阳性血清反应在25 ku处出现条带,与CBPP国际标准阴性血清反应在相应位置未出现条带。结果表明,Mmm感染的牛含有抗P588的抗体(图3)。
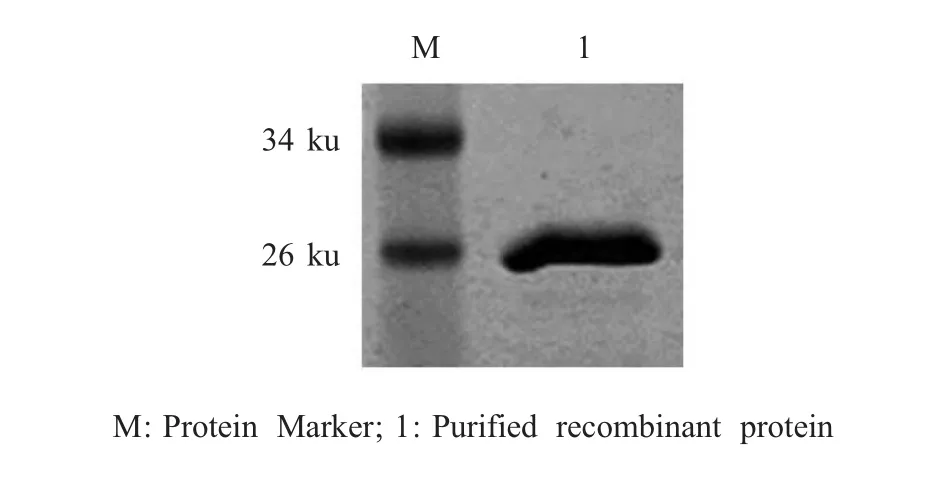
图2 rP588蛋白的SDS-PAGE鉴定Fig.2 SDS-PAGE analysis of rP588 protein expression

图3 rP588蛋白的western blot分析Fig.3 Identification of rP588 by western blot
2.4 r P 5 8 8在Mmm中的细胞定位 将Mmm Ben-1的细胞膜蛋白、胞浆蛋白、总蛋白与兔抗rP588血清反应,在约25 ku处出现条带,表明P588是Mmm的一个膜蛋白(图4)。
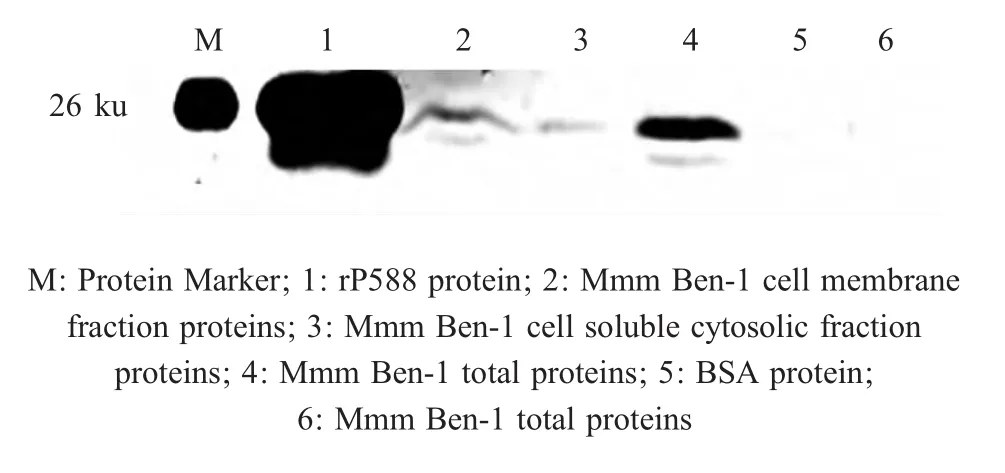
图4 rP588蛋白在Mmm中的细胞定位Fig.4 Location of rP588 in Mmm
2.5 r P 5 8 8粘附细胞试验结果 通过rP588蛋白直接与多聚甲醛固定的细胞作用,经过荧光二抗及DAPI染色,结果显示,红色的细胞膜上及胞浆中存在比较强烈的绿色荧光,其分布轮廓与EBL细胞形态相似(图5A),表明rP588蛋白粘附到EBL细胞上。抑制组中,绿色荧光强度明显变弱(图5B),表明rP588的抗体能够抑制该蛋白对EBL细胞的粘附。阴性对照组中,绿色荧光几乎不可见(图5C)。

图5 rP588蛋白对EBL细胞粘附试验Fig.5 Detection of rP588 adhesion to EBL cells by IFA
图6 兔抗rP588抗体对rP588蛋白粘附和粘附的抑制Fig.6 Adhesion and adhesion inhibition of rP588 by anti-rP588 serum
2.6 r P 5 8 8对细胞膜蛋白的吸附及吸附抑制试验结果 进行ELISA试验,OD450nm值测定显示,随着rP588蛋白浓度的依次降低,膜蛋白所吸附的rP588蛋白量呈明显的递减趋势,表明rP588重组蛋白对膜蛋白具有粘附作用(图6A)。当等量rP588与不同浓度的抗体预先孵育时,高浓度的抗体能与绝大部分蛋白结合产生抗原抗体复合物,封闭了可能的参与粘附的表位,进而使参入粘附的蛋白大量减少;而当抗体稀释到1 280倍时,抗体对rP588的结合减少,参入粘附的重组蛋白也随之增多(图6B)。各实验中空白对照及阴性对照BSA对重组蛋白吸附均处于低水平。以上实验均重复3次。抑制试验表明,rP588抗体能够显著的抑制该蛋白对EBL细胞膜的粘附。
3 讨 论
Mmm是一种最小的拥有完整生物合成系统的病原菌,该病原通过在宿主细胞表面的粘附,继而激发宿主细胞的一系列病理反应[9]。Mmm毒力机制的研究,对研发有效的Mmm弱毒疫苗具有重要意义。Mmm Ben-1弱毒疫苗在异体动物体内连续传代致弱的机制尚不明确。
在本研究中,选取Ben-1,Ben-470分别代表Mmm中国分离株的强弱毒株,利用PCR和RT-PCR试验证明了一个假定蛋白基因p588在Ben-470代中缺失。这种通过在体内或体外连续传代使致病性支原体毒力减弱的方法在支原体中很常见。例如,Mycoplasma bovis2610株在人工改造后的培养基中连续传代以后,对EBL的粘附能力明显降低,经鉴定,一个24 ku的粘附蛋白在高代次菌株中表达量比低代次中低[10-11];强毒力的低代次Mycoplasma gallisepticumR株在肉汤培养基中连续传代数次后能致弱,并且一个粘附相关蛋白GapA在致弱菌株中缺失[12]。虽然目前还不能确定Mmm Ben-470中p588的缺失与Mmm的毒力减弱是否有直接联系,但P588蛋白的体外粘附试验表明其在强毒力Mmm Ben-1粘附宿主细胞过程中起着重要作用。
在支原体中,许多粘附相关蛋白都定位在菌体的细胞膜上。在本研究中,制备了rP588蛋白,利用western blot方法检测rP588蛋白与CBPP国际标准血清之间的交叉反应阳性,证明了P588蛋白确实在Mmm强毒株中存在,并且具有免疫原性。虽然经生物信息学方法预测,P588蛋白缺乏典型的信号肽和跨膜结构域,但通过支原体蛋白细胞定位试验证明,P588同时存在Mmm Ben-1的胞膜和胞浆内。通过激光共聚焦和间接ELISA方法,证明了rP588对宿主细胞的粘附能力。虽然目前尚无研究证明Mmm在侵染宿主过程中能够进入宿主细胞内,但其他表面寄生的支原体,例如M.pneumonia,M.genitalium和M.gallisepticum,在特殊情况下,能够寄生在非吞噬细胞内[13-14]。最近的一个研究显示,Mmm的一些分泌型组分能够侵入牛血液白细胞内而引起细胞程序性死亡[15]。巧合的是,本研究表明,rP588能除了能粘附EBL的细胞膜组分,也能与其胞浆组分发生相互作用。本研究鉴定了一个Mmm的一个差异蛋白的粘附功能,该蛋白的鉴定对Mmm致病机制以及Mmm Ben-1致弱机理的研究有着重要意义。
[1]Tonelli A,Sacchini F,Krasteva I,et al.One test microbial diagnostic microarray for identification ofMycoplasma mycoidessubsp.mycoidesand otherMycoplasmaspecies[J].Mol Biotechnol,2012,52(3):285-299.
[2]Dupuy V,Manso-Silván L,Barbe V,et al.Evolutionary history of contagious bovinepleuropneumoniausing next generation sequencing ofMycoplasma mycoidessubsp.mycoidessmall colony[J].PloS One,2012,7(10):e46821.
[3]Xin Jiu-qing,Li Yuan,Nicholas R A,et al.A history of the prevalence and control of contagious bovinepleuropneumoniain China[J].Vet J,2012,191(2):166-170.
[4]Razin S,Yogev D,Naot Y.Molecular biology and pathogenicity ofMycoplasmas[J].Microbiol Mol Biol Rev,1998,62(4):1094-1156.
[5]Kitzerow A,Hadding U,Henrich B:Cyto-adherence studies of the adhesin P50 ofMycoplasma hominis[J].J Med Microbiol,1999,48(5):485-493.
[6]Sachse K,Helbig J H,Lysnyansky I,et al.Epitope mapping of immunogenic and adhesive structures in repetitive domains ofMycoplasmabovisvariable surface lipoproteins[J].Infect Immun,2000,68(2):680-687.
[7]Fleury B,Bergonier D,Berthelot X,et al.Characterization of P40,a cytadhesin ofMycoplasma agalactiae[J].Infect Immun,2002,70(10):5612-5621.
[8]Zou Xiao-hui,Li Yuan,Wang Yang,et al.Molecular cloning and charac-terization of a surface-Localized adhesion protein inMycoplasma bovisHubei-1 Strain[J].PloS One,2013,8(7):e69644.
[9]Pilo P,Frey J,Vilei E M.Molecular mechanisms of pathogenicity ofMycoplasma mycoidessubsp.mycoidesSC[J].Vet Res,2007,174(3):513-521.
[10]Thomas A,Sachse K,Dizier I,et al.Adherence to various host cell lines ofMycoplasma bovisstrains differing in pathogenic and cultural features[J].Vet Microbiol,2003,91(2):101-113.
[11]Thomas A,Leprince P,Dizier I,et al.Identification by twodimensional electrophoresis of a new adhesin expressed by a low-passaged strain ofMycoplasma bovis[J].Res Microbiol,2005,156(5):713-718.
[12]Levisohn S,Dykstra M,Lin M,et al.Comparison of invivoandin vitromethods for pathogenicity evaluation forMycoplasma gallisepticumin respiratory infection[J].Avian Pathol,1986,15(2):233-246.
[13]Jensen J S,Blom J,Lind K:Intracellular location ofMycoplasma genitaliumin cultured Vero cells as demonstrated by electron microscopy[J].J Exp Pathol,1994,75(2):91.
[14]Winner F,Rosengarten R,Citti C.In vitrocell invasion ofMycoplasma gallisepticum[J].Infect Immun,2000,68(7):4238-4244.
[15]Dedieu L,Chapey E,Balcer R V.Mycoplasma mycoidesssp.mycoidesbiotype small colony secreted components induce apoptotic cell death in bovine leucocytes[J].Scand J Immunol,2005,62(6):528-538.
Identification of a novel membrane protein in theMycoplasma mycoidessubsp.mycoidessmallcolony Ben-1 strain
ZHOU Yu-mei1,WANG Yang1,LI Yuan1,ZOU Xiao-hui1,LIU Su-li1,BAI Fan3,WU Jin-di2,XIN Jiu-qing1*
(1.National Contagious Bovine Pleuropneumonia Designated Detection Laboratory,State Key Laboratory of Veterinary Biotechnology,Harbin Veterinary Research Institute,Chinese Academy of Agricultural Sciences,Harbin 150001,China;2.College of Veterinary Medicine,Northeast Agricultural University,Harbin 150001,China;3.College of Animal Science and Technology,Jilin Agriculture University,Changchun 130118,China)
Mycoplasma mycoidessubsp.mycoides(Mmm)is the causative agent of contagious bovine pleuropneumonia(CBPP)which had been eliminated by vaccination of attenuated vaccine of the Ben-1 strain since early 1950's in China.To investigate the mechanism of the Mmm attenuation,we compared the entire genomes of the Ben-1 strain and the attenuated Ben-470 strain and revealed that an open reading frame of 495 bp(designed p588 gene)coding for a putative protein of 165 amino acids(about 19 ku)was absent from the Ben-470 strain.Then the p588 gene was cloned from virulent strain of Ben-1 and the recombinant P588(rP588)was expressed inE.coli.In addition,western blot analysis demonstrated that the P588 protein was a membrane-associated protein and reacted positively with the international standard serum against CBPP.Furthermore,the rP588 was able to adhere to embryonic bovine lung cells detected by immunostaining visualised via confocal laser scanning microscopy,and this was also confirmed by a sandwich ELISA.In conclusion,the P588 protein,which exists in Ben-1 strain but deleted from the Ben-470 strain during the attenuated process,is an adhesion protein in Mmm.
Mycoplasma mycoidessubsp.mycoides;P588 gene;adhesion
S852.61
A
1008-0589(2014)05-0354-05
10.3969/j.issn.1008-0589.2014.05.05
*Correspondingauthor
2013-11-09
国家自然科学基金(31072131)
周玉梅(1988-),女,江苏盐城人,硕士研究生,主要从事动物支原体表面膜蛋白研究.
*通信作者:E-mail:xinjiuqing2001@sohu.com
(本文编辑:彭永刚)
