猪白细胞介素-2,4作为猪圆环病毒灭活疫苗免疫增强剂对仔猪免疫效果的研究
2014-09-10章红兵
章红兵
(金华职业技术学院,浙江金华 321007)
猪白细胞介素-2,4作为猪圆环病毒灭活疫苗免疫增强剂对仔猪免疫效果的研究
章红兵
(金华职业技术学院,浙江金华 321007)
为评价猪白细胞介素-2,4(PoIL-2,4)与猪圆环病毒灭活疫苗(PCV2灭活疫苗)联合免疫对仔猪免疫增强作用,本研究将60头三元杂交仔猪随机平均分成3组,试验组于14日龄和28日龄注射PCV2灭活疫苗0.5头份+“PoIL-2,4”0.1 mL,对照组接种PCV2灭活疫苗0.5头份,空白组注射等体积生理盐水。结果显示:试验组仔猪各免疫器官指数均比对照组有所提高,不同日龄淋巴细胞转化率均显著高于对照组,外周血白细胞数量和淋巴细胞数量显著增加,PCV2 ELISA抗体及中和抗体均极显著高于对照组,攻毒后其临床症状和病理变化未受到影响,抗体水平经历短暂下降后显著升高,血清和组织中均未检出PCV2。表明PCV2灭活疫苗与PoIL-2,4联合免疫可以提高仔猪对PCV2的细胞和体液免疫水平,有效阻止病毒在机体内的复制,改善仔猪的生长性能。
IL-2, 4;PCV2灭活疫苗;仔猪;免疫增强;细胞免疫
多年来,猪圆环病毒病(Porcine circovirus diseases,PCVD)对我国养猪业造成了严重的经济损失,研究结果显示猪圆环病毒灭活疫苗(PCV2灭活疫苗)具有较好的安全性和免疫保护效力[1-3]。但临床应用表明,PCV2灭活疫苗免疫后存在空白期比较长、免疫保护期比较短等缺点。
白细胞介素-2(IL-2)又称为T细胞生长因子,可以促进T淋巴细胞增殖与分化,诱导具有细胞毒样活力的杀伤细胞,诱导及增强杀伤性T细胞、单核细胞、巨噬细胞的活力等。白细胞介素-4(IL-4)是由活化的Th2细胞产生的细胞因子,能够促进活化B细胞增殖、分化、免疫球蛋白产生,促进T细胞生长、Th2细胞分化和肥大细胞增殖。
本实验将猪白细胞介素-2,4(PoIL-2,4)与PCV2灭活疫苗联合免疫,研究其提高仔猪免疫的效果。
1 材料和方法
1.1 主要实验材料与仪器 PoIL-2,4购自河南纳瑞森生物药业有限公司(20120622);PCV2灭活疫苗(SH株)购自洛阳普莱柯生物工程有限公司(120516);PCV酶联免疫诊断试剂盒购自农业部兽医诊断中心世纪元亨公司;PCV2-SH株由洛阳普莱柯生物工程有限公司惠赠;Uritest-3000型全自动血细胞分析仪购自优利特集团有限公司。
1.2 实验猪的选择与分组试验 选用金华市金淳农业开发有限公司提供的遗传背景相近、ELISA检测仔猪PCV2抗体一致(p>0.05)的14日龄“杜洛克×(长白×大约克)”三元杂交健康仔猪60头,随机分为3组。常规饲养管理,自由采食和饮水。试验组于14日龄和28日龄注射PCV2灭活疫苗0.5头份+PoIL-2,4 0.1 mL,对照组于14日龄和28日龄注射PCV2灭活疫苗0.5头份,空白组注射等体积生理盐水。
1.3 样品的采集
1.3.1 血液样品免疫后第21 d、35 d及49 d分别于各组随机选取4头仔猪(公母各半)采集静脉血液4份。其中,1份2 mL肝素钠抗凝,用于血液淋巴细胞转化试验;1份EDTA-K2抗凝血1 mL,用于血细胞分类计数;2份制备血清用于抗体检测。
1.3.2 组织样品在免疫后第28 d和42 d各组随机选取4头仔猪(公母各半),自由饮水条件下禁食24h,称重后迫杀,采集腹股沟淋巴结、颌下淋巴结、肝脏、脾脏和胸腺,并剔除结缔组织,用于检测免疫器官指数。
1.4 攻毒试验 首免后28 d各组随机选取4头仔猪(公母各半),经口、鼻接种PCV2-SH株2 mL,颈部肌肉注射接种3 mL。
1.5 检测指标及方法 免疫器官指数测定公式为:免疫器官指数=免疫器官重量(g)/体质量(kg);血液淋巴细胞转化率测定参照文献[4],采用MTT法;外周血细胞分类计数的测定采用全自动血细胞分析仪测定。
各组分别于首免后第21 d、35 d和49 d前腔静脉采血,进行PCV2抗体检测。血清样品中的PCV2抗体检测按PCV2抗体酶联免疫诊断试剂盒的说明书进行操作。
中和抗体检测参照文献[5]方法检测PCV2中和抗体。
攻毒后每天记录各组试验猪采食量、每周每头试验猪体质量,计算平均每头仔猪日采食量、平均每头仔猪日增重以及饲料增重比。观察各组试验猪的临床表现,并于每天早上测量体温,绘制体温变化曲线。于攻毒后21 d各组分别迫杀2头仔猪,观察病理变化。
ELISA方法测定各组攻毒后第14 d、21 d、28 d和35 d仔猪血清PCV-2抗体水平,并绘制抗体水平动态消长曲线。将各组攻毒仔猪血清、淋巴结、肺脏、脾脏及肾脏等组织参照文献[6]方法检测PCV2。
1.6 数据处理与分析 采用Excel进行数据前处理,利用SPSS16.0统计软件进行统计分析和LDS多重比较。
2 结 果
2.1 P o I L-2,4对仔猪免疫器官指数的影响 迫杀实验猪、采取并称重免疫器官,各组免疫器官指数见表1。结果显示,首免后28 d,试验组仔猪脾脏指数和胸腺指数显著高于对照组(p<0.05)、极显著高于空白组(p<0.01),试验组仔猪腹股沟淋巴结指数、颌下淋巴结指数和肝脏指数显著高于空白组(p<0.05),对照组仔猪各免疫器官指数均显著高于空白组(p<0.05);初次免疫后42 d,试验组仔猪各免疫器官指数(除肝脏指数)均显著高于对照组(p<0.05),试验组与对照组仔猪各免疫器官指数均显著高于空白组(p<0.05),表明PoIL-2,4与PCV2灭活疫苗联合免疫能够显著提高仔猪的免疫力。对照组和试验组仔猪56日龄时各免疫器官指数均比42日龄要高,表明PCV2灭活疫苗免疫后仔猪第42 d的免疫力比第28 d更强。
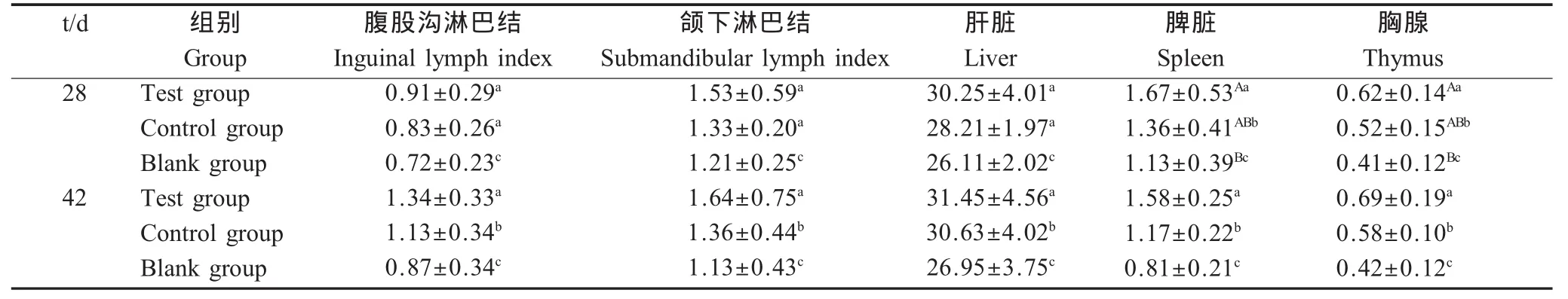
表1 免疫器官指数Table 1 Immune organ indices(g/kg)
2.2 P o I L-2,4对仔猪淋巴细胞转化率的影响 测定血液淋巴细胞转化率,结果显示,试验组不同日龄淋巴细胞转化率均显著高于对照组和空白组(p<0.05),对照组不同日龄淋巴细胞转化率均显著高于空白组(p<0.05)。表明PoIL-2,4与PCV2灭活疫苗联合免疫能够显著增强细胞免疫活性(表2)。
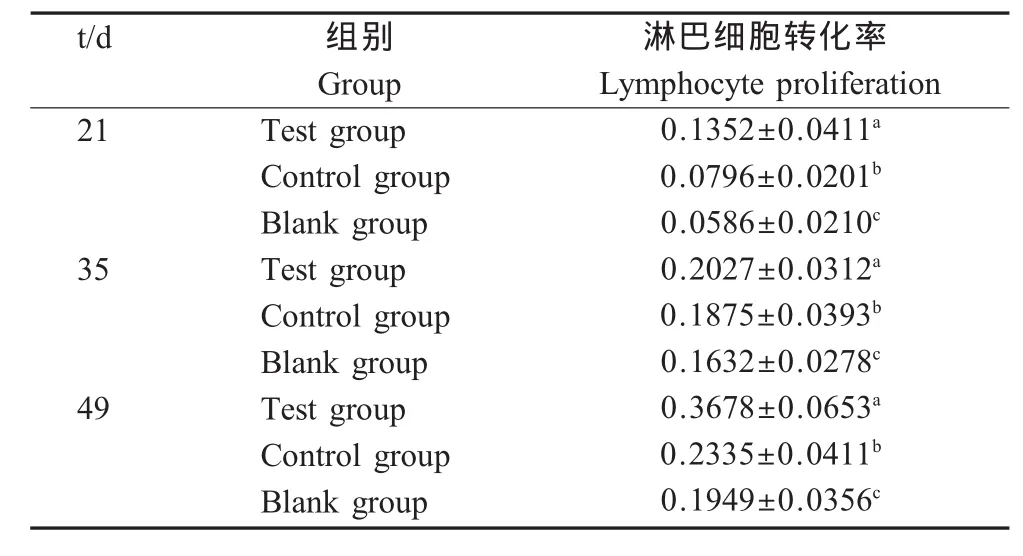
表2 淋巴细胞转化率Table 2 Lymphocyte proliferation(%)
2.3 P o I L-2,4对仔猪外周血细胞分类计数的影响外周血细胞分类计数结果显示,首免后21 d和35 d试验组外周血白细胞数量和淋巴细胞数量比对照组和空白组显著增加(p<0.05),首免后35 d对照组外周血白细胞数量和淋巴细胞数量比空白组显著增加(p<0.05),红细胞和中性粒细胞数量有上升的趋势,但差异不显著(p>0.05)(图1)。表明PoIL-2,4与PCV2灭活疫苗联合免疫比单独使用PCV2灭活疫苗免疫能够增加外周血白细胞和淋巴细胞数量,增强细胞免疫功能。
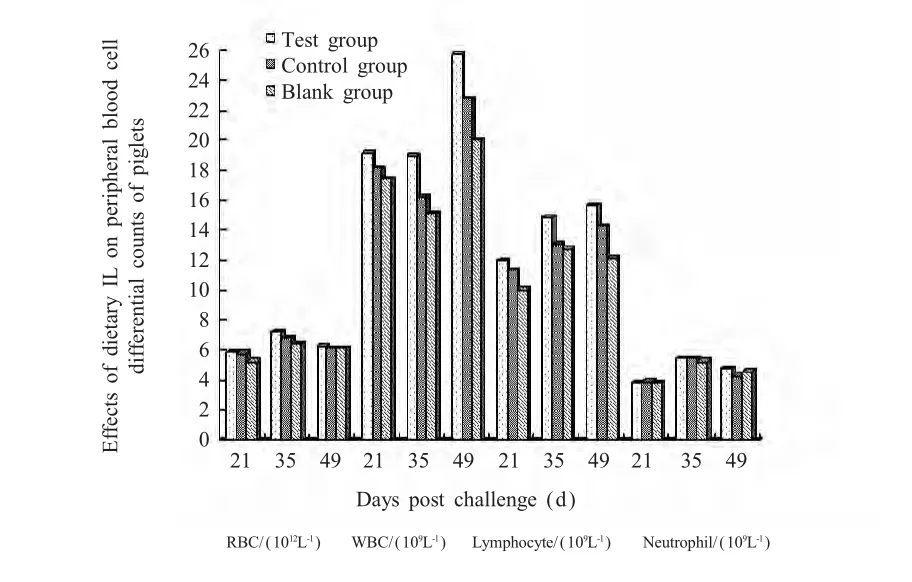
图1 白细胞介素对仔猪外周血细胞分类计数的影响Fig.1 Effects of dietary IL on peripheral blood cell differential counts of piglets
2.4 仔猪P C V 2抗体检测结果 免疫后仔猪PCV2抗体检测,结果显示,各组首免后21 d,血清PCV2抗体水平开始上升,试验组PCV2抗体水平均极显著高于对照组(p<0.01),表明 PoIL-2,4与PCV2灭活疫苗联合免疫能够提高仔猪PCV2抗体水平(图2)。空白组21 d后抗体水平快速上升,可能是因为野毒感染所致。
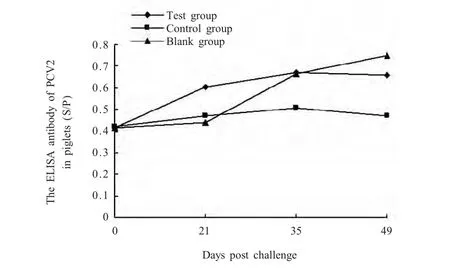
图2 仔猪PCV2抗体(S/P值)Fig.2 The antibody of PCV2 in piglets(S/P)
2.5 仔猪P C V 2中和抗体检测结果 检测仔猪PCV2中和抗体结果显示,在首免后21 d各组仔猪均产生PCV2中和抗体,之后抗PCV2血清中和抗体逐渐升高。首免后试验组各日龄中和抗体水平均极显著高于对照组和空白组(p<0.01)(图3),表明在PCV2灭活疫苗免疫时联合PoIL-2,4可以发挥协同作用,增强免疫效果。
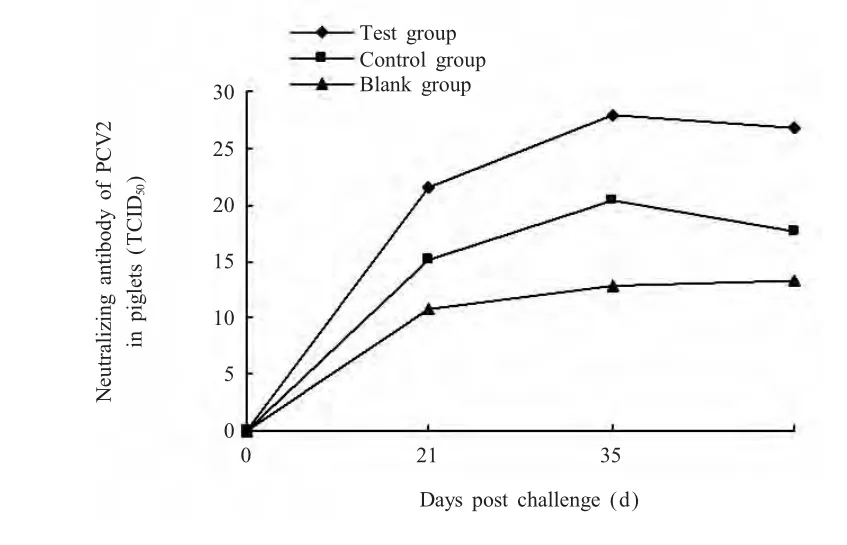
图3 仔猪PCV2中和抗体(TCID50值)Fig.3 Neutralizing antibody of PCV2 in piglets(TCID50)
2.6 攻毒对仔猪生长性能的影响 试验猪首免后28 d攻毒,攻毒后21 d内各组仔猪生产性能观测结果表明,攻毒后试验组各个阶段平均日增重稍高于对照组,料重比稍低于对照组,但差异不显著(p>0.05)。试验组和对照组各阶段平均日增重和料重比与空白组对照均有显著差异(p<0.05)(表3)。表明在PCV2灭活疫苗与PoIL-2,4联合免疫能更有效地抵抗野毒感染,保护仔猪不受野毒侵袭。
2.7 攻毒后仔猪临床症状和病理变化 攻毒后观察各组试验猪的临床表现和病理变化,结果显示攻毒后试验组与对照组仔猪均未出现典型的PMWS临床症状,平均体温变化见图4,其中2号仔猪体温在攻毒后第7 d达到40.6℃,食欲及精神状态欠佳,偶见咳嗽,但3 d后开始逐渐恢复正常。攻毒后21 d 3组各迫杀2头仔猪,试验组与对照组仔猪组织(淋巴结、肺脏、脾脏、肾脏及肝脏等)均未见明显病理变化;空白组仔猪淋巴结肿大,肺呈现间质性肺炎,肾脏水肿、苍白,脾脏轻度肿大,肝脏发暗、萎缩。
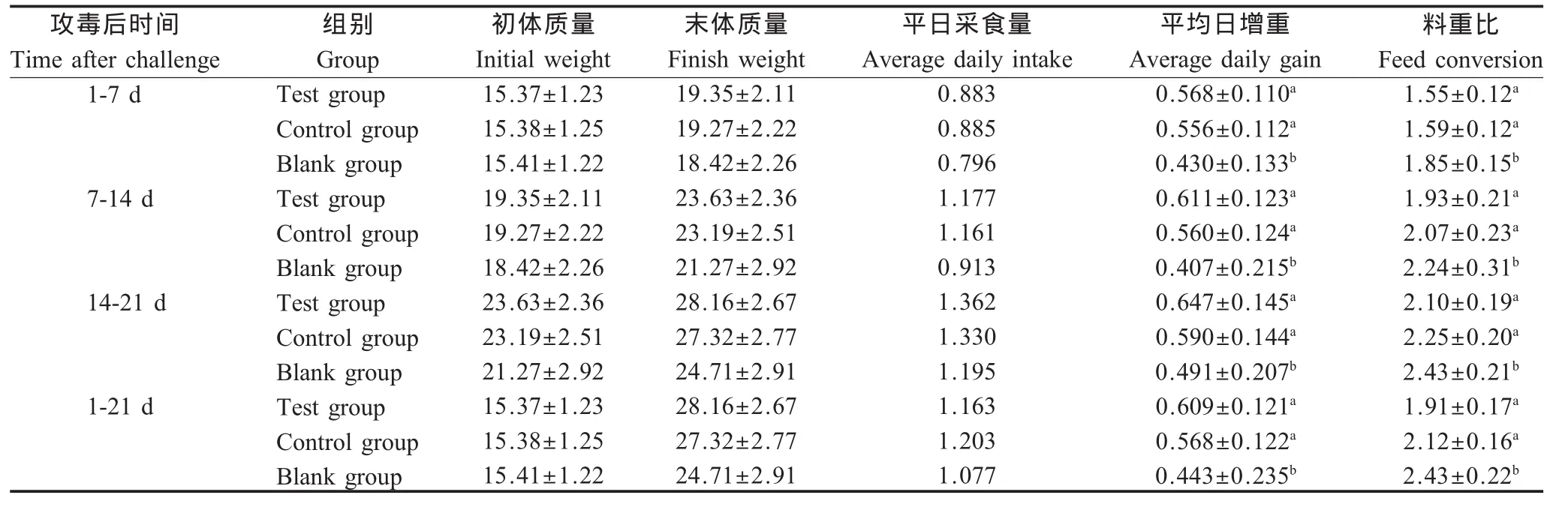
表3 攻毒后仔猪生长增重情况(kg)Table 3 Weight gain of piglets after challenge(kg)
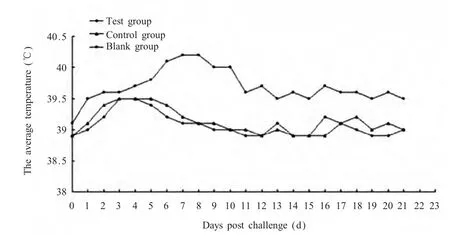
图4 攻毒后仔猪平均体温变化曲线Fig.4 Temperature curve of piglets post challenge
2.8 攻毒后仔猪血清P C V 2抗体水平检测 ELISA试剂盒检测攻毒试验仔猪56日龄、63日龄、70日龄和77日龄血清PCV2抗体水平,结果显示攻毒后试验组和对照组PCV2抗体水平均出现短暂下降,之后开始上升,表明PCV2灭活疫苗免疫或与PoIL-2,4联合免疫均能够抵抗野毒感染;而空白组PCV2抗体水平出现上升,持续至试验结束(图5)。
2.9 攻毒后仔猪血清和组织中P C V 2检测 分别对攻毒后7 d、14 d和21 d血清和淋巴结、肺脏、脾脏、肾脏等组织进行PCR检测,显示试验组和对照组仔猪在攻毒后均未检测到PCV2 DNA,空白组仔猪血清、淋巴结和肺脏中检测到PCV2 DNA。表明PCV2灭活疫苗免疫或与PoIL-2,4联合免疫均能够有效阻止病毒在机体内的复制。

图5 攻毒后仔猪PCV2抗体(S/P值)Fig.5 PCV2 antibody of piglets after challenge(S/P)
3 讨 论
IL-1、IL-2、IL-4和IL-12等是机体细胞免疫中重要的多功能细胞因子,可作用机体活性免疫细胞,促进其增殖与分化,加强其活性和功能,影响细胞内活性分子的表达,改善免疫功能,对多种抗原均有增强作用,但大多数均是以小鼠为实验动物,证明这些细胞因子在小鼠中起到了显著的免疫调节作用[7-9],关于PoIL-2,4在对PCV2免疫保护方面尚未见报道。本实验表明,PCV2灭活疫苗加入外源性PoIL-2,4淋巴细胞增殖反应上升,明显提高血液中淋巴细胞转化能力,有效促进仔猪的细胞免疫功能。检测抗体结果首免后各日龄试验组ELISA抗体和中和抗体极显著高于对照组,表明在PCV2灭活疫苗免疫时联合PoIL-2,4可以发挥协同作用,增强免疫效果。
研究表明,IL-2对机体腹股沟淋巴结、颌下淋巴结、脾脏和胸腺等免疫器官生长发育有显著影响,但对肝脏影响不显著[10-11]。本实验结果表明,PoIL-2,4与PCV2灭活疫苗联合免疫对仔猪免疫器官指数较对照组均有不同程度的提高。
本实验中,试验组比对照组仔猪外周血红细胞和中性粒细胞数量有所上升,外周血白细胞数量和淋巴细胞数量显著增加,这在一定程度上表明PoIL-2,4对仔猪的血红蛋白合成、造血功能的提高有促进作用,有利于提高机体非特异性免疫力和清除体内的病原微生物,增强细胞免疫功能。
攻毒保护试验表明,试验组与对照组均能较好地诱导机体产生特异性免疫反应,免疫仔猪在受到PCV-2攻击后其临床症状和病理变化未受到影响,抗体水平经历短暂下降后即显著升高,同时各组织中也未检测到PCV2的存在。而空白组仔猪攻毒后体温升高,剖检可见明显病理变化,在血清、肺脏和淋巴结组织中检测到PCV2。这些结果与许多学者的研究结果基本一致,表明PCV2灭活疫苗或PCV2灭活疫苗与PoIL-2,4联合免疫均可以对仔猪起到良好的保护作用。
[1]刘长明,危艳武,张超范,等.猪圆环病毒2型灭活疫苗免疫佐剂的比较试验[J].中国预防兽医学报.2007,29(9):690-693.
[2]董信田,李玉峰,姜平,等.猪圆环病毒2型灭活疫苗的制备与免疫效力研究[J].中国预防兽医学报,2007,29(9):690-693.
[3]张建远,王红宁,陈锦锐,等.猪圆环病毒核酸疫苗pcDNA-PCV-ORF2-ISS的构建及分子佐剂联合免疫研究[J].中国预防兽医学报,2009,29(12):1511-1515.
[4]高云航.猪瘟超前免疫效果综合评价[D].长春:吉林农业大学,2007:80-81.
[5]黄立平,刘长明,危艳武,等.猪圆环病毒2型血清中和抗体阻断ELISA检测方法的建立及应用[J].中国兽医科学,2009,39(9):779-785.
[6]赵浩军,范伟兴,姜平,等.应用套式PCR方法检测猪圆环病毒2型[J].畜牧与兽医,2006,38(12):40-42.
[7]Wu Mei,Gao Rong,Meng Ming-jie,et al.Regulating effects of porcine interleuk in-6 gene and CpG motifs on immune responses to porcine trivalen tvaccines in mice[J].Res Vet Sci,2004,77:49-57.
[8]Fu Man-liang,Ying San-cheng,Wu Mei,et al.Regulating effects of novel CpG chitosan-nanoparticles on immune responses of mice to porcine paratyphoid vaccines[J].Biomed Environ Sci,2006,19:315-322.
[9]Zhang Han,Cheng Chi,Zheng Min,et al.Enhancement of immunity to an E scherichia coli vaccine inmice orally inocu lated with a fusion gene encoding porcin e interleuk in 4 and 6[J].Vaccine,2007,25:7094-7101.
[10]Lonneke V.Caparison of the insitu changes in lymphoid cellsduring infection with infectious bursal disease virus in chickens of different ages[J].Avian Pathol,1997,26(4):803-821.
[11]李宏梅,郭慧君,李祥瑞,等.重组鸡IL-2作为传染性法氏囊病疫苗免疫增强剂对鸡细胞免疫水平的影响[J].中国兽医杂志,2005,41(6):13-14.
The effect of porcine interleukin-2,4 as immunopotentiator for PCV inactivated vaccine to enhanceimmune responses in piglets
ZHANG Hong-bing
(Jinhua Polytechnic,Jinhua 321007,China)
To investigate the combined immune of porcine circovirus 2(PCV2)inactivated vaccine with PoIL-2,4,a total of 60 crossbred piglets were randomly divided into 3 groups,including the test group inoculation of 0.5 dose PCV2 inactivated vaccine with 0.1 mL PoIL-2,4 at 14 and 28 day-old,the positive control group inoculation of 0.5 dose PCV2 inactivated vaccine and the blank control group.The results indicated that the immune organ index,the lymphocyte proliferation rate under different age and the number of leukocyte and lymphocyte in peripheral blood were significantly increased in the test group,compared to control group.In addition,the antibody and neutralizing antibody were also significantly higher in the test group than that in control group.Moreover,the clinical symptoms and pathological changes were not found,and the PCV2 was not detected in serum and tissue post challenge in the test group,which indicated that the PCV2 inactivated vaccine with PoIL-2,4 was able to significantly improve abilities of lymphocyte proliferation and antibody production to provided effectively protection to the piglets against PCV2.
IL-2,4;PCV2 inactivated vaccine;piglets;immune enhancement;celluar immune
S852.65
A
1008-0589(2014)05-0395-05
10.3969/j.issn.1008-0589.2014.05.15
2013-02-06
浙江省科学技术项目(2011C22093)
章红兵(1966-),男,浙江兰溪人,教授,主要从事猪场管理与猪病防治研究.E-mail:zlrui@126.com
(本文编辑:彭永刚)
