SV40LT抗原介导的蝙蝠胎儿肾细胞永生化
2014-05-21张思春杨凡力涂长春
张思春,杨凡力,余 乐,何 彪,涂长春
(军事医学科学院军事兽医研究所吉林省人兽共患病预防与控制重点实验室,吉林 长春 130122)
蝙蝠是地球上仅次于啮齿类的第二大类哺乳动物。目前发现的4600个哺乳动物物种中,有942种(约占20%)为蝙蝠[1]。蝙蝠被认为是许多新发人兽共患病病毒如尼帕病毒[2]、亨德拉病毒[3]、SARS冠状病毒[4]等的自然储存宿主。在中国菊头蝠体内发现的SARS-样冠状病毒(SARS-like coronaviruses,SL-CoVs)引发人们尝试在不同的蝙蝠物种中分离SL-CoV病毒。目前从蝙蝠组织中已经检测到至少66种病毒,但由于缺少蝙蝠细胞系,利用其它哺乳动物的细胞系来分离蝙蝠病毒较困难,所以分离出的病毒株较少。
从动物组织器官分离到的原代细胞在体外进行有限的增殖后会进入衰老期,称为Hayflick限制。但包括病毒癌基因在内的多种因子可以延长细胞的生命周期,甚至使细胞在体外无限增殖,建立永生化的细胞系。Crameri等通过转导SV40 LT抗原或人端粒酶催化亚基(hTERT)基因进入中央狐蝠(Pteropus alecto)的脑、肺、肾等组织细胞中,建立了几种永生化的蝙蝠细胞系[5]。Krahling等转移腺病毒血清5型的E1A基因到北非果蝠(Rousettus aegyptiacus)胎儿细胞中,建立了R06E细胞系,并用于马尔堡病毒的研究[6]。本研究将SV40 LT基因导入原代蝙蝠胎儿肾细胞(Bat fetal kidney cell,BFK)中,建立了能够在体外长期传代培养的永生化细胞系。
1 材料和方法
1.1 质粒、细胞和病毒株 pBABE-puro-SV40 LT质粒由Addgene公司惠赠;pVSV-G质粒及GP2-293细胞购自Clontech公司;小鼠神经瘤N2a细胞、Marc-145细胞、Vero-E6细胞由本实验室保存;蝙蝠西江病毒(XRV)和蝙蝠轮状病毒RVA/Bat/MSLH14株由本实验室分离并保存。
1.2 主要实验材料 低熔点琼脂糖、polybrene和嘌呤霉素购自Sigma公司;FuGENE HD转染试剂购自Roche公司;Prime Script RT reagent kit with gDNA eraser试剂盒购自TaKaRa公司;鼠抗SV40 LT抗原单克隆抗体(MAb)购自Santa Cruz Biotechnology公司;驴抗小鼠荧光二抗Alexa Flour 680购自Invitrogen公司。
1.3 BFK的分离培养 将捕获的怀孕母蝙蝠用乙醚麻醉,取出胎儿置入玻璃皿内,分离肾脏并剪碎,用冷的DMEM洗涤3次,加入EDTA-胰蛋白酶,37℃水浴30 min;移除上清液,DMEM反复吹打组织块,取上清液200×g离心5 min,沉淀重悬于含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DEME培养基中,于37℃5%CO2中培养,每2 d~3 d传代1次。
1.4 蝙蝠种类鉴定 首先对蝙蝠进行形态学鉴定,此外提取BFK的基因组DNA,扩增其线粒体1140 bp的细胞色素cyt b基因并测序,通过BLAST序列比对鉴定该蝙蝠的物种。
1.5 永生化蝙蝠胎儿肾细胞系的建立 培养GP2-293细胞至80%~90%单层时,按FuGENE HD转染试剂说明书方法共转染pBABE-puro-SV40 LT和pVSV-g质粒,48 h后收集含假病毒颗粒的培养基上清液,过滤后分装于冻存管,-80℃保存。将第4代BFK培养于6孔板,待细胞生长至50%汇合时进行假病毒感染,加入终浓度为8 μg/mL的polybrene。感染8 h后更换正常培养基再培养48 h,将细胞传至100 mm培养皿中并加入3 μg/mL的嘌呤霉素进行筛选,获得具有嘌呤霉素抗性的转导细胞,并采用已建立的方法检测转导细胞中LT基因的表达[7]。提取细胞总RNA,RT-PCR检测SV40 LT基因的表达,采用裂解液裂解蝙蝠细胞,进行10%SDS-PAGE电泳,半干转印到NC膜上,进行化学发光western blot检测转导细胞中LT抗原表达。一抗为小鼠抗SV-40 LT MAb,二抗为驴抗小鼠荧光抗体Alexa Flour 680,洗膜后进行荧光扫描。
为制备细胞系,将转导的细胞进行终点稀释克隆纯化,以胰酶消化,计数并将之稀释至1个细胞/100 μL培养基,加入到96孔培养板中,每孔中平均有1个细胞,于37℃5%CO2中培养,挑取单细胞长出的克隆孔,待长满单层后消化,转移到24孔板培养板放大培养,随后挑取不同克隆进行进一步放大培养以制备更多的细胞并冻存。
1.6 软琼脂克隆形成试验 将培养皿预先用0.6%的低熔点琼脂糖包被。将转导细胞消化后悬浮于含0.3%的琼脂糖的完全培养基中,加入包被好的培养皿中,使培养皿中分别含1×104和2×103个细胞。于37℃5%CO2条件下培养,7 d后补充含0.3%琼脂糖的培养基,2周~3周后观察有无克隆生长。同时取小鼠神经瘤N2a细胞系作为对照。
1.7 病毒感染性评价 取XRV细胞培养物,稀释至104TCID50/mL,分别感染上述建立的BFK细胞系和Vero-E6细胞,观察细胞病变(CPE),待CPE稳定后,收集细胞培养物并反复冻融,离心后取上清液在Vero-E6细胞上进行病毒TCID50的测定。同时将蝙蝠轮状病毒RVA/Bat/MSLH14株稀释至107TCID50/mL,分别感染建立的BFK细胞系和Marc-145细胞,观察CPE。
2 结 果
2.1 BFK的分离培养与蝙蝠种类鉴定 利用倒置相差显微镜观察原代培养细胞,发现消化的细胞团块贴壁后,从其周围有细胞贴壁生长,逐渐铺满瓶底,细胞呈不规则多角形,形成紧密排列的单层。随着细胞传代,形态变得更加均一,为典型的上皮细胞形态(图1)。通过提取BFK细胞基因组DNA,扩增长度为1140 bp的线粒体cyt b基因并测序,序列比对分析结果表明该蝙蝠为东亚水鼠耳蝠(Myotis petax)。
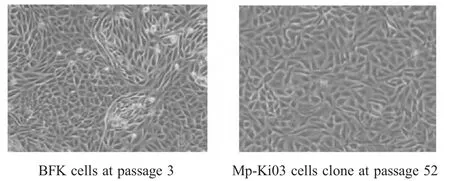
图1 蝙蝠胎儿原代及永生化细胞系(100×)Fig.1 Morphology of primary and immortalized BFK cells(100×)
2.2 转导细胞的特征 转导细胞经嘌呤霉素筛选6 d左右,未见细胞死亡。在传到33代时进行了单细胞克隆,获得3个单细胞衍生的细胞系,分别命名为Mp-Ki01、Mp-Ki02、Mp-Ki03。这 3个细胞系的细胞群体倍增时间均约在36 h,并且保持上皮细胞典型的不规则多角形态,呈紧密的单层排列(图1)。由于Mp-Ki03细胞系的增殖速率更稳定,形态更均一,因此被用于后续的实验,现已培养至第60代。
2.3 SV40LT基因表达的检测 SV40 LT转导细胞后,通过RT-PCR和western blot进行鉴定。结果显示,在转导细胞中均检测到SV40 LT基因的表达(图2A),western blot结果出现特异性条带,表达蛋白的大小为94 ku(图2B)。表明SV40 LT基因在转导细胞中已整合并表达。

图2 SV40 LT基因表达检测Fig.2 Detection of SV40 LT gene expression
2.4 软琼脂克隆形成分析 第33代Mp-Ki细胞在克隆前进行了软琼脂克隆形成试验,结果显示培养17 d后细胞仍呈单细胞悬浮状,未形成克隆,而对照的N2a细胞则形成了明显的细胞团,表明Mp-Ki转导细胞未发生癌变,仍为正常细胞,可以用于后续的单细胞克隆(图略)。
2.5 病毒易感性试验 将XRV细胞培养物感染Mp-Ki03细胞和Vero-E6细胞,结果显示,XRV可以感染Mp-Ki03并引起典型的CPE,至第60 h时可见较多细胞融合,细胞层出现的空隙更多,增大,而未感染的Mp-Ki03细胞仍呈单层排列生长,Vero-E6出现更明显的CPE(图3)。收集细胞培养物反复冻融后测定毒价,Mp-Ki03细胞培养物的TCID50为 104.0TCID50/mL,Vero-E6细胞的 TCID50为105.125TCID50/mL。
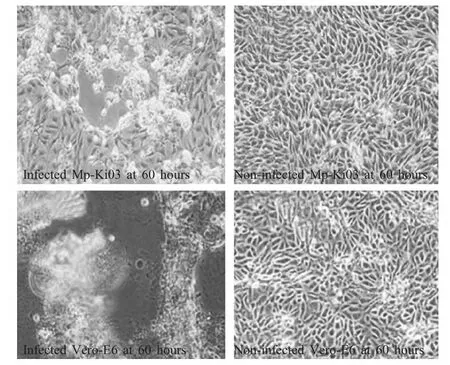
图3 XRV感染Mp-Ki03细胞和Vero-E6细胞Fig.3 CPE on XRV-infected Mp-Ki03 and Vero-E6 cells
以蝙蝠轮状病毒感染Mp-Ki03细胞20 h后,细胞圆缩脱落,部分未脱落细胞形态变得不规则并牵出胞浆丝,24 h后细胞脱落50%。感染该轮状病毒的Marc-145也出现相似的CPE(图4)。
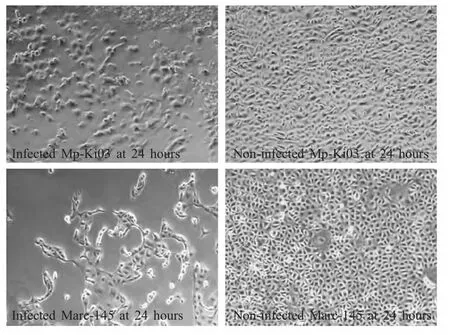
图4 蝙蝠轮状病毒感染Mp-Ki03细胞和Marc-145细胞的CPEFig.4 CPE on rotavirus-infected Mp-Ki03 and Marc-145 cells
3 讨 论
由于蝙蝠携带的病毒越来越多地跨越种间屏障,并在人类及其它动物中引起严重的疾病,因此亟待建立多种蝙蝠细胞系用于蝙蝠病毒的分离及病毒与宿主相互作用的研究。本研究在分离培养东亚水鼠耳蝠BFK细胞的基础上,利用逆转录病毒将SV40 LT基因转入BFK,筛选的转导细胞通过RT-PCR和western blot均检测到SV40 LT基因的表达,经单细胞克隆获得的一株细胞系Mp-Ki03已培养至第60代,成为了永生化的蝙蝠胎儿肾细胞系。
SV40 LT是建立永生化细胞最简单可靠的基因[8],此外其他用于细胞永生化的基因还包括人乳头瘤病毒HPV的E6和E7基因、人5型腺病毒的E1A基因,以及人端粒酶催化亚基(hTERT)等[9]。本研究前期分别利用含hTERT基因的假病毒和含SV40 LT基因的假病毒感染BFK,但只有SV40 LT基因成功筛选到抗性克隆。其原因可能是SV40 LT能够直接抑制细胞周期的检查,使少量的转导细胞继续快速增殖,进而被筛选出来。
对获得的Mp-Ki03细胞系进行病毒感染性试验分析表明,来自棕果蝠的呼肠孤病毒XRV和来自菊头蝠的轮状病毒在初代接种时即可感染该细胞并引起典型的CPE,表明建立的细胞系对蝙蝠病毒具有一定的易感性。但由于未进行适应性传代,Mp-Ki03对2种病毒的敏感性低于分离这2种病毒的细胞。Mp-Ki03细胞感染XRV后的病变程度较Vero-E6细胞弱,病毒滴度也比Vero-E6细胞的低。同样,Mp-Ki03细胞对轮状病毒的敏感度也比Marc145细胞略差。这2种病毒分别在Vero-E6和Marc-145细胞上连续传代培养,所以其更适应、更敏感。因此,推测当这2种病毒在Mp-Ki03细胞多次连续传代适应培养后,该细胞对病毒的敏感性可能进一步提高。并且推测Mp-Ki03细胞系对其他种类蝙蝠的病毒可能也具有较好的敏感性和广谱适应性,可以用于尝试不同蝙蝠来源的病毒的分离培养,对建立其他种类蝙蝠的细胞系具有指导意义。
[1]Teeling E C,Springer M S,Madsen O,et al.A molecular phylogeny for bats illuminates biogeography and the fossil record[J].Science,2005,307(5709):580-584.
[2]Reynes J M,Counor D,Ong S,et al.Nipah virus in Lyle's flying foxes,Cambodia[J].Emerg Infect Dis,2005,11:1042-1047.
[3]Halpin K,Young P,Field H E,et al.Isolation of Hendra virus from pteropid bats:a natural reservoir of Hendra virus[J].J Gen Virol,2000,81:1927-1932.
[4]Lau S K,Woo P C,Li K S,et al.Severe acute respiratory syndrome coronavirus-like virus in Chinese horseshoe bats[J].Proc Natl Acad Sci U S A,2005,102:14040-14045.
[5]Crameri G,Todd S,Grimley S,et al.Establishment,immortalization and characterization of pteropid bat cell lines[J].PloS One,2009,4(12):e8266.
[6]Krahling V,Dolnik O.Establishment of fruit bat cells(Rousettus aegyptiacus)as a model system for the investigation of filoviral infection[J].PLoS Negl Trop Dis,2010,4(8):e802.
[7]张思春,余乐,李素,等.人端粒酶催化亚基和SV40大T抗原永生化猪静脉血管内皮细胞[J].中国预防兽医学报,2012,34(2):87-91.
[8]Jha K K,Banga S,Palejwala V,et al.SV40-mediated immortalization[J].Exp Cell Res,1998,245(1):1-7.
[9]Freedman D A.Senescence and its bypass in the vascular endothelium[J].Front Biosci,2005,10:940-950.
