siRNA靶向沉默HIF-1α基因对肺癌A549细胞转移和侵袭的影响
2014-09-06杨成梁郑晓丽翟冲亚赵慧云
冯 潇,杨成梁,郑晓丽,翟冲亚,赵慧云,葛 红
(郑州大学附属肿瘤医院 放疗科 河南 郑州 450008)
siRNA靶向沉默HIF-1α基因对肺癌A549细胞转移和侵袭的影响
冯 潇,杨成梁,郑晓丽,翟冲亚,赵慧云,葛 红
(郑州大学附属肿瘤医院 放疗科 河南 郑州 450008)
目的:探讨质粒介导RNA干扰抑制HIF-1α基因对肺癌A549细胞转移和侵袭能力的影响。方法:利用基因工程方法构建HIF-1α的干扰表达载体,并将其转染至肺腺癌A549细胞;分别用RT-PCR方法、Western blot方法检测细胞转染前后HIF-1α以及MMP-2的mRNA及蛋白表达的变化。细胞划痕试验和Transwell实验检测转染前后肺腺癌A549细胞迁移及侵袭能力的改变。结果:转染后肺腺癌A549细胞中HIF-1α和MMP-2的mRNA表达分别下降86%和64%(P<0.05)。转染后细胞蛋白表达明显下降。转染前后穿膜细胞数分别为(135.2±13.2)、(63.7±10.5),差异具有统计学意义(P<0.05)。转染前后划痕宽度分别为(0.48±0.14)、(1.04±0.15)mm,差异具有统计学意义(P<0.05)。结论:RNAi可有效抑制HIF-1α的表达,同时可结合MMP-2启动子下调MMP-2基因和蛋白的表达,降低肺癌A549细胞的转移和侵袭能力。关键词:RNA干扰;乏氧诱导因子;基质金属蛋白酶-2
低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)是调节肿瘤细胞适应低氧的核心转录因子,参与多种基因的转录调控,在肿瘤的血管形成、能量代谢、侵袭转移等方面扮演重要角色,是在低氧环境中起到中枢纽带的重要转录因子[1],也是参与多种肿瘤转移和侵袭相关的调节通路。基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)是一种能降解细胞外基质和基底膜的蛋白水解酶,在肿瘤的侵袭和转移中发挥重要作用[2]。近年来开展的RNA干扰技术是指具有同源性的双链RNA(double-stranded RNA,dsRNA)能高效特异地使靶mRNA发生降解、使基因转录后的mRNA不能表达而导致基因沉默的一种现象,为研究内源性基因功能和信号转导提供了有效的技术手段。本研究旨在通过构建可表达人HIF-1α基因siRNA的真核重组表达质粒,转染人肺腺癌 A549细胞,观察HIF1-α基因沉默对人肺腺癌A549细胞MMP-2基因表达的影响,以及转移和侵袭能力的影响。
1 材料与方法
1.1 实验材料与设备 人肺腺癌A549细胞株购自上海细胞研究所,pSilencer2.1质粒购自Ambion公司,RPMI1640培养液和胎牛血清购于美国Gibco公司。Trizol试剂、RNA提取试剂盒、cDNA合成试剂盒、RTPCR扩增试剂盒购于德国Qiagen公司。HIF-1α、MMP-2和GAPDH引物由北京金唯智公司合成。兔抗人HIF-1α单克隆抗体和兔抗人MMP-2多克隆抗体购自ABCAM公司;碱性磷酸酶标记的IgG羊抗兔二抗购自北京中杉金桥生物公司。Western blot相关试剂是北京康为世纪公司产品。使用的实验仪器主要有:细胞培养箱,荧光定量PCR仪等。
1.2 实验方法
1.2.1 细胞培养:A549细胞在含有100 m l/L胎牛血清(FBS)的 RPMI 1640培养基中贴壁生长,置于37℃,95%饱和湿度、含5%CO2的孵箱中培养,每1~2 d换1次液,于细胞80%融合时,用0.25%的胰酶细胞消化液消化,1∶2或1∶3传代1次。
1.2.2 HIF-1α基因RNAi寡核苷酸的合成:利用shRNA设计软件,针对HIF-1α靶基因序列,按照RNA干扰序列设计原则,选取特异性的序列5'-GTGATGAAAGAATTACCGAAT-3',同时选取一条非特异性干扰序列5'-CCAGTTATGATTGTGAAGTTA-3'。并引入BamHⅠ和HindⅢ两个酶切位点以确保引物退火后可以插入质粒pSilencer2.1且读框正确。
1.2.3 重组质粒的构建与转染:用BamHⅠ和HindⅢ双酶切质粒pSilencer2.1,酶切产物胶回收并溶于超纯水中,ATM基因RNAi寡聚核苷酸退火后以3∶1的比例与胶回收质粒进行连接,然后将连接产物转化感受态细菌DH5α中。次日随机挑取菌落,接种LB培养液,振荡培养过夜,碱裂解法小量快速抽提质粒,并用pSilencer2.1特有的测序引物进行测序。非特异siRNA寡聚DNA与pSilencer2.1质粒的连接、克隆同上。置于37℃,95%饱和湿度、含5%CO2的孵箱中培养。当细胞生长密度为80%时,胰酶消化收取细胞并分别加入上述构建好的重组质粒,电穿孔法进行瞬时转染,48 h后收取细胞待用。实验分为3组:实验组(转染pSilencer2.1-HIF-1α质粒)、空白对照组(未转染质粒)、阴性对照组(转染pSilencer2.1-nonspecific质粒)。
1.2.4 总RNA提取:将实验组、空白对照组、阴性对照组分别接种入六孔板中,放入37℃,95%饱和湿度、含5%CO2的孵箱中培养,待细胞融合度达到80%时使用RNA提取试剂盒提取总RNA。
1.2.5 RealTime RT-PCR检测mRNA表达:常规合成cDNA第一链,以此第一链为模板,PCR扩增MMP-2及HIF-1αmRNA片段,同时扩增三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参照,目的基因、内参引物序列和PCR扩增反应条件见表1,表2。每组实验重复3次。
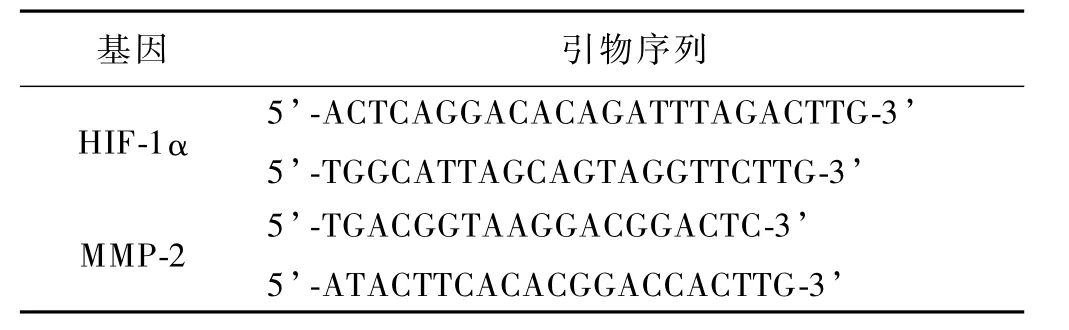
表1 HIF-1α和MMP-2基因引物序列

表2 HIF-1α和MMP-2 PCR扩增反应条件
1.2.6 Western blot检测HIF-1α和MMP-2蛋白的表达:蛋白裂解液裂解细胞,冰上放置20 min,12 000转离心20 min,取上清液。BCA法蛋白定量试剂盒检测总蛋白浓度;使用SDS-PAGE凝胶制备试剂盒制胶,每个泳道蛋白的上样量均为14μl,于SDS-PAGE进行电泳分离后,转移至硝酸纤维素膜,用5%无脂牛奶(TBST配制)封闭1 h。加一抗后4℃冷室中封闭过夜,HIF-1α、MMP-2效价均为1∶1 000。TBST洗膜3次,每次15 min。HRP标记的二抗(山羊抗兔为1∶2 000)室温下置于摇床上摇动孵育1 h。用TBST洗膜3次,每次15 min。应用ECL化学显色试剂盒(A液∶B液=1∶1)显色,并于暗室中显影。
1.2.7 细胞划痕实验:取对数生长期细胞,按1×105个/m l接种于6孔培养板培养至细胞汇合(80%~90%满),形成单细胞层。用无菌200μl的枪头在细胞上垂直划过形成一无细胞的细痕,PBS清洗3遍,去除漂浮细胞,37℃、5%CO2培养箱培养24 h,4%多聚甲醛固定后显微镜下观察。通过观察划痕宽度变化来判断迁移能力。
1.2.8 Transwell侵袭实验:聚碳酸脂微孔滤膜上铺Matrigel凝胶(8.4 mg/m l)50μl包被30 h,风干。将500μl含 10%FBS的1640完全培养基加入下层小室;细胞用无血清的1640培养基制成1×105个细胞/m l的细胞悬液,各取200μl移入小室,培养24 h后剪下聚碳酸脂微孔滤膜,以4%多聚甲醛固定侵袭并黏附至下室面的细胞。常规HE染色。每张膜中央部分和周围部分各随机取5个视野(×200倍)。计数每个视野内的细胞数,以每个视野的平均数表示肿瘤细胞的侵袭能力。
1.3 统计学处理 数据采用SPSS 18.0软件进行统计处理。均数±标准差(±s)表示各组数据,两组数据比较采用两独立样本t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 转染效率 转染48 h,通过在荧光显微镜下观察可见视野内EGFP细胞个数与所有细胞的比率,结果显示实验组和阴性对照组的转染效率分别是(93.0± 4.2)%、(91.0±3.5)%。见图1。

图1 实验组和阴性对照组的转染效率比较
2.2 siRNA导入A549细胞对H IF-1α和MM P-2基因m RNA表达水平的影响 行Real-Time PCR,经2-△△ct法计算各组HIF-1α及MMP-2 mRNA的相对表达量,结果显示:实验组HIF-1α及MMP-2的mRNA表达较空白对照组分别下降了86%和64%,差异有统计学意义(P<0.05)。见图2。
2.3 siRNA导入A549细胞对H IF-1α和MM P-2基因蛋白表达水平的影响 Western blot检测结果显示,实验组HIF-1α与MMP-2蛋白表达较空白对照组均有明显下降,阴性对照组HIF-1α与MMP-2蛋白表达较对照组无差异。见图3。
2.4 siRNA导入A549细胞对其迁移能力的影响
空白对照组宽度为(0.48±0.14)mm,实验组为(1.04 ±0.15)mm,两者比较,差异有统计学意义(P<0.05)。阴性对照组为(0.61±0.11)mm,与对照组比较,差异无统计学意义(P>0.05)。见图4、图5、图6。
2.5 siRNA导入A549细胞对其侵袭能力的影响
空白对照组穿膜数为(135.2±13.2),实验组为(63.7± 10.5),两者比较,差异有统计学意义(P<0.05)。阴性对照组穿膜细胞数为(129.6±16.3),与空白对照组比较差异无统计学意义(P>0.05)。
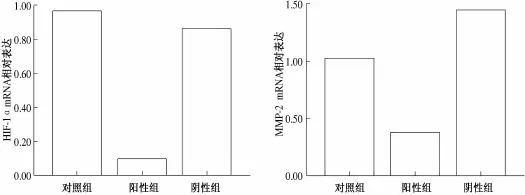
图2 空白对照组、实验组与阴性对照组HIF-1α与MMP-2的mRNA表达情况比较
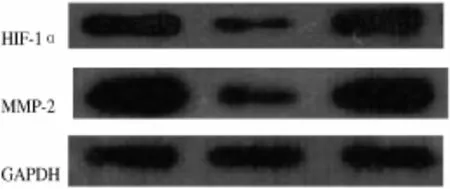
图3 空白对照组、实验组与阴性对照组中HIF-1α与MMP-2的蛋白表达对比

图4 空白对照组细胞24 h划痕对比(左侧为初始划痕,右侧为培养24 h后的划痕)

图5 实验组细胞24 h划痕对比(左侧为初始划痕,右侧为培养24 h后的划痕)

图6 阴性对照组细胞24 h划痕对比(左侧为初始划痕,右侧为培养24 h后的划痕)
3 讨论
肺癌是当今世界上发病率增长最快和死亡率最高的恶性肿瘤之一,治疗失败的原因主要为局部复发和远处转移。发生复发和转移的重要因素之一是肿瘤细胞中乏氧细胞的生成。研究显示,当肿瘤体积大于1 mm时,自身的血液供应就不能满足肿瘤细胞快速生长的需要,使其内部处于相对低氧的环境中,低氧能使很多基因转录活性发生改变,其基因产物可引起肿瘤细胞产生一系列病理生理、生化改变,增强肿瘤转移和侵袭的能力,其中的关键是使HIF-1α基因表达量增高,有研究显示HIF-1α表达与胃癌远处转移和淋巴结转移呈正相关。HIF-1α是诱导肿瘤细胞发生转移过程中的重要基因,其表达受到氧分压的调控,细胞低氧可激活HIF-1α基因,使其表达量增加,参与到多个调节肿瘤侵袭和转移的信号通路中[3-4],同时也使细胞免受乏氧的伤害[5]。HIF-1α还可诱导肿瘤细胞内的一系列基因做出应答反应,使肿瘤细胞在低氧环境中保持能量供应。Ji等[4]发现在乏氧条件下,HIF-1α通过调控LOX-FAK/AKT信号通路调节卵巢癌细胞的迁移和侵袭,从而能促进卵巢癌的转移,加大治疗难度。本研究通过质粒载体将HIF-1α基因的干扰序列转染到肺腺癌A549细胞中,使HIF-1α基因mRNA及蛋白表达水平下降,观测MMP-2基因mRNA及蛋白质表达水平的变化。
本研究通过Western blot和RT-PCR实验发现阳性组细胞MMP-2的mRNA和蛋白表达较阴性组与对照组细胞有明显下降,证明通过RNA干扰技术成功构建了HIF-1α低表达细胞,同时MMP-2基因mRNA与蛋白表达也下降,说明其在HIF-1α在MMP-2的转录调控中起重要作用。MMP-2基因与肿瘤侵袭和转移能力密切相关,在恶性肿瘤组织中有较高的表达[6-7],基质金属蛋白酶表达越高,肿瘤预后越差[8]。肿瘤侵袭转移的潜能与肿瘤细胞表达MMP-2的能力呈正相关,MMP-2高表达与多种肿瘤的侵袭、转移能力增强有关,HIF-1α的高表达可促进MMP-2蛋白的表达[9]。MMP-2基因能够降解细胞外基质,破坏基底膜等物理屏障,重塑细胞间黏附力并促进肿瘤新血管形成,从而导致肿瘤的侵袭和转移。Choi等[6]报道,使用腺病毒的shRNA转染肝癌细胞株降低HIF-1α基因表达后,肝癌细胞中MMP-2表达降低,肝癌细胞的侵袭和生长能力显著降低。有研究显示降低MMP-2基因表达后,可使乳腺癌细胞的侵袭性受到抑制[10]。
Transwell小室是目前常用的Matrigel胶重建基膜系统,是体外研究肿瘤细胞侵袭行为的简便和快速有效的方法,肿瘤细胞穿过Matrigel胶的能力能够反应细胞的侵袭能力。Transwell实验结果显示:实验组穿膜数较空白对照组和阴性对照组明显下降,可以证实转染后细胞转移和侵袭能力下降。本研究通过划痕实验也证实了上述结果,实验组细胞24 h后划痕的宽度明显大于空白对照组和阴性对照组,转染后细胞的转移和侵袭能力下降。
总之,通过 RNA干扰技术靶向沉默肺癌细胞HIF-1α基因可降低MMP-2基因的表达,减弱肺癌A549细胞的转移和侵袭能力,而且MMP2和HIF-1α的表达呈正相关。选择性抑制肿瘤细胞中HIF-1α基因表达将为降低肿瘤侵袭和转移,为抑制和延缓肿瘤治疗后复发转移提供重要思路与途径。
[1]Ellis L,Hammers H,Pili R.Targeting tumor angiogenesis with histone deacetylaseinhibitors[J].Cancer Lett,2009,280(2):145-153.
[2]Kenny H A,Lengyel E.MMP-2 functions as an early response protein in ovarian cancermetastasis[J].Cell Cycle,2009,8(5):683-688.
[3]Wang Y,Li Z,Zhang H,et al.HIF-1αand HIF-2αcorrelate with m igration and invasion in gastric cancer[J].Cancer Biol Ther,2010,10(4):376-382.
[4]Ji F,Wang Y,Qiu L,et al.Hypoxia inducible factor 1α-mediated LOX expression correlates with migration and invasion in epithelial ovarian cancer[J].Inter JOncol,2013,42(5):1578-1588.
[5]Jia X,Fu Z X,Yao J,et al.Effects of chlorogenic acid on the viability and HIF-1alphamRNA expression of PC12 cells exposed to hypoxia[J].Zhong Yao Cai,2013,36(10):1644-1647.
[6]Choi S H,Shin H W,Park J Y,et al.Effects of the knockdown of hypoxia inducible factor-1alpha expression by adenovirus-mediated shRNA on angiogenesis and tumor growth in hepatocellular carcinoma cell lines[J].Korean JHepatol,2010,16(3):280-287.
[7]Littlepage L E,Sternlicht M D,Rougier N,et al.Matrix metalloproteinases contribute distinct roles in neuroendocrine prostate carcinogenesis,metastasis,and angiogenesis progression[J].Cancer Res,2010,70(6):2224-2234.
[8]Yang R,Xu Y,Li P,etal.Combined upregulation ofmatrixmetalloproteinase-1 and proteinase-activated receptor-1 predicts unfavorable prognosis in human nasopharyngeal carcinoma[J].Oncol Targets T-her,2013,(6):1139-1146.
[9]Wang B,Ding Y M,Fan P,et al.Expression and significance of MMP2 and HIF-1αin hepatocellular carcinoma[J].Oncol Lett,2014,8(2):539-546.
[10]Yan W,Tu B,Liu Y Y,et al.Suppressive effects of plumbagin on invasion and migration of breast cancer cells via the inhibition of STAT3 signaling and down-regulation of inflammatory cytokine expressions[J].Bone Research,2013,(4):362-370.
Effect of silence of HIF-1αexpression by siRNA on invasion and metastasis of human lung adenocarcinoma A549 cells
FENG Xiao,YANG Chengliang,ZHENG Xiaoli,ZHAIChongya,ZHAO Huiyun,GE Hong
(Department of Radiation Oncology,the Affiliated Cancer Hospital of Zhengzhou University,Zhengzhou 450003,China)
Objective:To investigate the effect of silence of HIF-1αexpression by p lasmid-mediated RNA interference on the invasion and metastasis of human lung adenocarcinoma A549 cells.M ethods:The interference carrier of HIF-1αexpression was constructed by using genetic engineeringmethods,and transfected into lung adenocarcinoma cell line A549.The expressions of HIF-1α and MMP-2 mRNA were detected by PCR.The proteins of them before and after cell transfection were detected by western blot.The functional of migration and invasion were detected by the scratch test and transwell assay before and after cell transfection.Resu lts:After cell transfection,the HIF-1αand MMP-2 mRNA expressions were decreased by 86%and 64%(P<0.05).After transfection,protein expressions were significantly decreased.The number of penetrating cells was(135.2±13.2)before transfection and(63.7±10.5)after transfection,the difference was statistically significant(P<0.05).The scratch width was(0.48±0.14)mm,(1.04±0.15)mm respectively,the difference was statistically significant(P<0.05).Conclusion:RNA interference could effectively inhibit the expression of HIF-1α,decrease mRMA and protein levels of MMP-2 by attaching to its gene promoter,inhibit the metastasis and invasion of A549 cells.
RNA interference;HIF-1α;MMP-2
葛红,E-mail:gehong666@126.com。
R 734.2
10.3969/j.issn.1004-437X2014.11.001
河南省科技厅国际合作项目(124300510016);郑州市科技创新团队(121PCXTD524)。
2014-06-27)
