骨髓间充质干细胞影响CCl4肝纤维化大鼠的实验研究
2014-08-24杨志坚
杨志坚
(咸宁市中医医院骨伤科,湖北 咸宁 437100)
骨髓间充质干细胞(BMSCs)具有向多种细胞分化的能力[1,2]。新近的研究指出,BMSCs可在体外和体内分化为肝细胞,BMSCs注射可修复损伤的肝、肺和心脏组织,减少炎症、胶原沉积[3]。这些结果提示BMSCs不但可修复损伤组织,还具有减少慢性纤维化的能力[4]。因此,我们将体外培养良好的BMSCs注入以CCl4制备的肝纤维化模型,观察BMSCs对肝纤维化大鼠模型的干预作用,以期为肝纤维化的治疗提供新的治疗方向和思路。
1 材料与方法
1.1 仪器与试剂 荧光倒置显微镜(Olympus)、DMEM培养基、胎牛血清、胰蛋白酶(美国Gibco公司),大鼠透明质酸(HA)(美国Sigma公司),四氯化碳(CCl4)(重庆川江化工厂),免疫组化试剂盒(美国Sigma公司)
1.2 动物分组与模型制备 雌性6周龄SD雄性大鼠,体重140~160g,大鼠随机分为4组,每组10只:①对照组:1周2次,连续6周注射蓖麻油(0.2ml/100g);②CCl4组:1周2次,连续6周皮下注射CCl4(0.2ml/100g);③CCl4/BMSCs组:大鼠注射CCl46周后,每只大鼠尾静脉注射3×106BMSCs;④CCl4/生理盐水组:大鼠注射CCl46周后,每只大鼠尾静脉注射等体积的生理盐水。所有动物购置于武汉大学实验动物中心,大鼠在无菌条件下饲养,不限进食和饮水。
1.3 BMSCs提取 通过对6周龄的SD雄性大鼠的胫骨和股骨进行冲洗获取骨髓,随后在添加了10%胎牛血清的DMEM培养基中培养,通过梯度分离法分离出有核细胞后在加入了1%的青霉素-链霉素中重悬。细胞在37 ℃,5%湿化的 CO2条件下孵育12~14d。
1.4 CCl4诱导肝纤维化模型的制备及骨髓间充质干细胞的注入方法
1.4.1 肝纤维化模型的制备 将CCl4溶解在等体积的蓖麻油中,通过皮下注射至大鼠体内,其中CCl4剂量为0.2 ml/100g,浓度为40 ml/L,其中对照组注射等体积的蓖麻油。
1.4.2 骨髓间充质干细胞的注入方法 BMSCs对肝纤维化大鼠的干预:CCl4注射6周后,每只大鼠注射3×106细胞数[5]BMSCs。
1.5 检测指标与方法 以显微镜观察肝组织形态学改变、比色法分析羟脯氨酸含量[5]、采用标准实验室方法检测血清氨基转移酶(ALT)和白蛋白。
1.6 统计分析方法 以SPSS 13.0 软件进行统计分析,数据采用平均值±标准差表示,组间采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 肝纤维化的评定 CCl4组大鼠与对照组相比,血清白蛋白明显降低(P<0.05),ALT水平则明显上升(P<0.05),肝组织羟脯氨酸水平则有明显升高(P<0.05),见表1。组织学观察发现肝脏出现明显的细胞外基质含量的增加,在肝小叶周围出现很多胶原沉积等肝纤维化特征。
2.2 BMSCs对肝纤维化大鼠的干预影响 经过BMSCs处理后的肝纤维化大鼠,BMSCs注射后4周处死动物观察:与CCl4组大鼠相比,CCl4/ BMSCs组大鼠血清白蛋白含量显著升高(P<0.05)。羟脯氨酸显著降低(P<0.05),而肝脏的ALT则并未有显著降低(P>0.05)。组织学观察,骨髓间充质干细胞具有明显的抗纤维能力,CCl4/BMSCs组肝纤维程度显著降低。
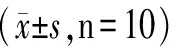
表1 不同组别之间肝功能与羟脯氨酸含量比较
3 讨 论
CCl4诱导的大鼠常常被用来作为肝纤维化的实验模型予以研究。CCl4可产生自由基,通过脂质过氧化反应引起持续性肝脏损伤[6]。在本实验中,当大鼠每周给予CCl42次,连续6周后,肝纤维化明显,模型制备成功。
Xiang等[7]发现CCl4诱导的肝组织损伤大鼠中,注射BMSCs可定向迁移到损伤部位而不依赖于BMSCs注射部位。BMSCs修复纤维化的过程仍不清楚,Ortiz等[8]发现尽管干细胞生成的干细胞形成的白蛋白在CCl4诱导的肝组织中低频率的表达,BMSCs与Flk1的融合可减轻细胞纤维化。尽管目前很少的研究能说明BMSCs移植到肝脏中的数量和质量,但BMSCs在损伤肝脏中的抗纤维化作用是确定的。
我们运用起源于健康雄性SD大鼠的BMSCs注射至CCl4诱导的雌性肝纤维化大鼠体内。组织的检查发现肝脏纤维化水平明显降低,羟脯氨酸的含量明显降低。肝功能也通过BMSCs的治疗得以明显改善。这些结果说明,注入同种异体的BMSCs对临床肝纤维化的治疗具有很大的价值。我们推测BMSCs可能通过改善移植肝脏部位的微环境而对CCl4诱导的损伤发挥保护作用。BMSCs分泌的很多细胞因子,如:肝脏生长因子具有抗凋亡的作用且在肝脏的再生过程中发挥重要作用[9,10]本实验的研究结果说明了骨髓间充质干细胞在肝纤维化防治过程中的重要作用,但其机制需进一步的研究。
[1]OdicO,Kajstura J,Chimenti S,et al.Bone marrow cell Sregenerateinfareted myocardium[J].Nature,2001,410(6829):701
[2]Poulsom R,Forbess J,Hodivala-Dilke K,et al.Bone marrow contributes to renal parenehymal turnover and regeneration[J].Pathol,2001,195(2):229
[3]Fang B,Shi M,Liao L,et al.Systemic infusion of FLK1(+)mesenchymal stem cells ameliorate carbon tetrachloride-induced liver fibrosis in mice[J].Transplantation 2004,78(1):83
[4]Sakaida I,Terai S,Yamamoto N,et al.Transplantation of bone marrow cells reduces CCl4-induced liver fibrosis in mice[J].Hepatology,2004,40(6):1304
[5]Nakamura T,Sakata R,Ueno T,et al.Inhibition of transforming growth factor beta prevents progression of liver fibrosis and enhances hepatocyte regeneration in dimethylnitrosamine-treated rats[J].Hepatology,2000,32(2):247
[6]Bruckner JV,Ramanathan R,Lee KM,et al.Mechanisms of circadian rhythmicity of carbon tetrachloride hepatotoxicity[J].J Pharmacol Exp Ther,2002,300(1):273
[7]Xiang GA,Zhang GQ,Fang CH,et al.A preliminary study of the homing capacity of allograft mesenchymal stem cells to rat liver[J].Di Yi Jun Yi Da Xue Xue Bao,2005,25(8):994
[8]Ortiz LA,Gambelli F,McBride C,et al.Mesenchymal stem cell engraftment in lung is enhanced in response to bleomycin exposure and ameliorates its fibrotic effects[J].Proc Natl Acad Sci USA,2003,100(14):8407
[9]Matsuda-Hashii Y,Takai K,Ohta H,et al.Hepatocyte growth factor plays roles in the induction and autocrine maintenance of bone marrow stromal cell IL-11,SDF-1 alpha,and stem cell factor[J].Exp Hematol,2004,32(10):955
[10]Li Y,Chen J,Chen XG,et al.Human marrow stromal cell therapy for stroke in rat:neurotrophins and functional recovery[J].Neurology,2002,59(4):514
