神经源性肺水肿27例诊疗分析
2014-08-22王颖毕筱刚
王颖 毕筱刚
神经源性肺水肿(NPE)是指在没有心、肺原发性疾病的情况下因颅脑损伤或中枢神经系统其它疾病引起的急性肺水肿,其特点是起病急、发展快、病死率高[1]。在临床诊疗过程中,因患者病情急重(颅内病变引发呼吸功能障碍、神志改变或血流动力学不稳定),在发病初期无法完善相关检查或离开重症监护室进行影像学检查,而导致难以及时明确诊断,增加治疗难度。现笔者结合自己经验分析NPE的诊断及治疗,为改善患者预后提供参考。
对象与方法
一、研究对象
我院2010年8月至2013年8月收治的重型颅脑损伤患者共254例,其中符合NPE诊断标准的有27例,发病率为10.6%[1]。27例中男18例、女9例,年龄30~70岁、中位年龄55岁,病程1~12周,中位病程4周。其中跌伤11例、交通伤9例、坠落伤和打击伤7例,合并颅内动脉瘤破裂11例。
二、 方 法
分析27例患者的临床表现、实验室及辅助检查、治疗经过、预后等,总结其特点,并重点分析1例典型病例。
结 果
一、临床表现
27例中,伤后立即出现意识障碍22例;两侧瞳孔散大7例、一侧瞳孔散大9例。27例在伤后48 h内均出现进行性呼吸困难,气道内有大量淡红或粉红色泡沫痰,可从气管插管处咳出、溢出或吸出,肺部听诊有啰音,其中有双肺广泛湿啰音4例。
二、实验室及辅助检查
入院后对所有患者采取适当的手段(包括急诊及床旁检查)及时完善相关检查并尽早明确诊断。血气分析:所有患者在吸氧状态下(供氧浓度50%~100%)的PaO2<60 mm Hg(mm Hg=0.133 kPa)。胸部X线片及胸部CT检查:26例行床边胸部X线片检查,17例出现肺野斑片状阴影,9例出现散在云絮状阴影;1例行胸部CT检查,出现双肺弥漫性渗出。颅脑CT检查:27例中有急性硬膜外血肿15例、急性蛛网膜下隙出血11例、急性硬膜下血肿9例、广泛脑挫裂伤并脑内血肿8例;颅内动脉瘤11例。
三、治疗方法
明确诊断后立即进行抢救。严密监测患者生命体征、痰液痰量变化情况、心输出量、全心舒张末期容积(GEDV)、血管外肺水及肺血管通透性指数(PVPI),动态监测血气,定时复查胸部X线片。根据患者情况采用内科保守治疗和外科手术治疗。
5例患者采用内科保守治疗,主要为20%甘露醇125 ml加呋塞米或白蛋白加呋塞米脱水减轻脑水肿,予尼莫地平预防脑血管痉挛,予尼莫地平、依必达奉营养脑神经,采用丙戊酸钠预防继发性癫痫发作,适当应用肾上腺皮质激素以及予广谱抗菌药物预防感染,疗程1~3周。
22例患者采用外科手术治疗,行急性蛛网膜下隙血肿清除术9例,行急性硬膜下血肿清除术8例,行急性硬膜外血肿清除术5例,合并颅内动脉瘤者视情情况立即或择期处理动脉瘤。术后治疗同内科保守治疗。
术后根据患者的病情在不同时期行气管插管或气管切开,予呼吸机辅助呼吸。
四、 预 后
经治疗后,13例(48%)患者好转转出ICU,在普通病房进行神经康复治疗,于住院后1.5~2个月出院,出院时一般情况均稳定。死亡14例(52%),其中死于再发脑出血9例,死于并发肺部感染5例。
五、典型病例分析
患者女,58岁,因突发昏迷后自行跌伤头部半小时于2011年12月7日送入我院急诊抢救室。患者无抽搐,无口吐白沫,呼吸次数持续下降,并呈点头样呼吸,遂予气管插管接呼吸机辅助呼吸,吸出大量血性泡沫痰。心肌酶谱及肌钙蛋白不高,吸纯氧时查血气分析提示PaO244.9 mm Hg,代谢性酸中毒明显,心电图提示窦性心律不齐、ST-T改变,但无心力衰竭,急诊胸部CT示双肺大量渗出灶(见图1A),颅脑CT检查提示蛛网膜下隙出血、脑室出血、颅内多发动脉瘤。遂立即于急诊处理头部伤口并将患者送入ICU,继续予呼吸机辅助呼吸、吸痰,予止血(巴曲亭+止血芳酸+酚磺乙胺)、降颅压减轻脑水肿(甘露醇、呋塞米、甲基泼尼松)、保护脑血管及脑神经(尼莫地平+依必达奉)以及预防感染(头孢哌酮舒巴坦)和镇静等对症支持治疗。请神经外科会诊考虑患者虽有颅内多发动脉瘤,但目前其生命体征不平稳,颅内出血量未达到手术指征,暂继续行内科保守治疗,建议待患者病情稳定后行介入手术治疗。患者于12月9日神志逐渐转清,生命体征逐渐恢复平稳,复查胸部X线片提示肺部病变好转,并于12月11日停用呼吸机辅助呼吸。12月13日复查胸部CT示双肺渗出性病变较前明显吸收,双侧少量胸腔积液(见图1B)。颅脑CT示蛛网膜下隙出血及脑室积血较前明显吸收。患者病情好转并稳定后转普通病房继续治疗并准备行介入手术治疗,但拟行手术前1日患者再次昏迷,查颅脑CT检查示颅内出血量增多,遂急行开颅手术治疗,情况无好转,于术后5 d死亡。
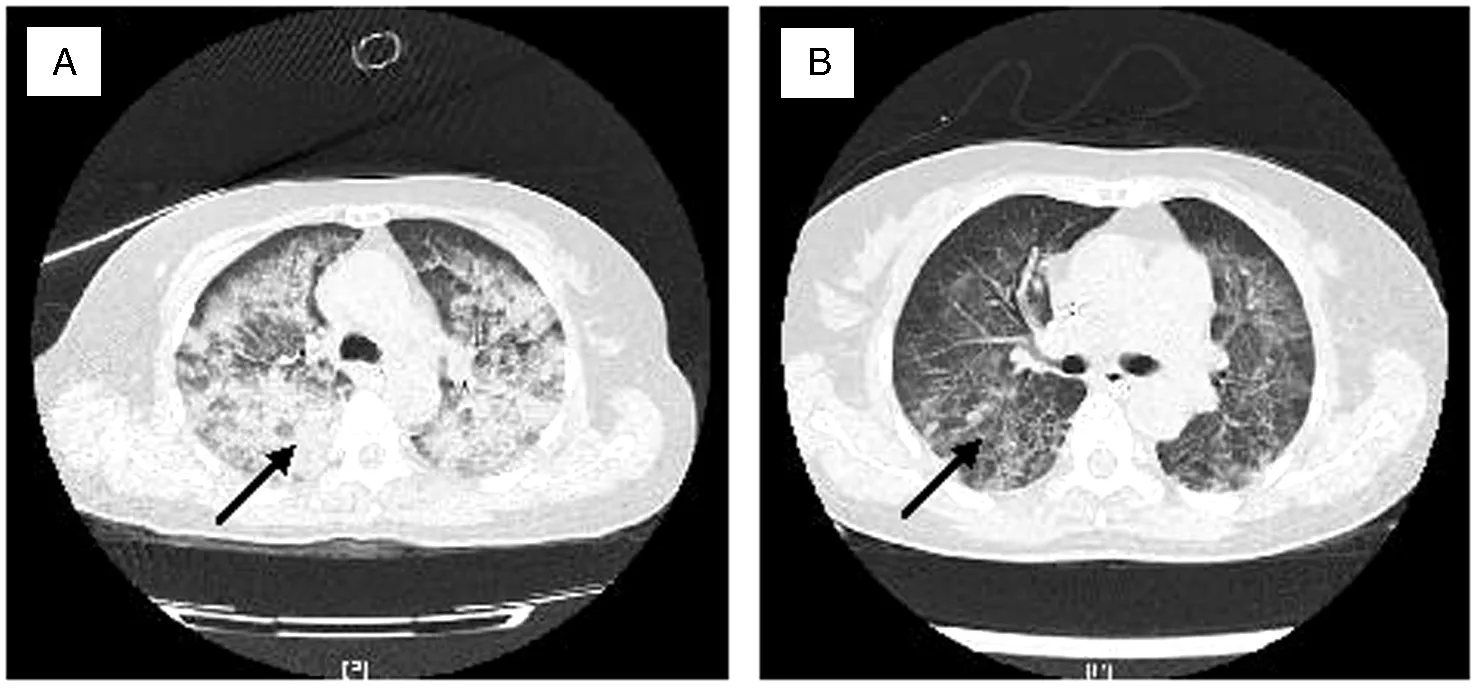
图1 1例神经源性肺水肿患者治疗前后胸部CT检查图
图1A为患者最初发病时胸部CT的表现,箭头标识处可见患者双肺大量渗出性病灶;图1B为患者治疗6 d后复查胸部CT的表现,箭头标识处可见患者原双肺大量渗出性病灶明显吸收
讨 论
NPE是重型颅脑损伤的重要并发症之一,其发病率较高(本组为10.6%),病死率亦高(本组为52%,李波等于2010年的报道病死率为50%),因此明确颅脑损伤引发肺水肿的机制,从而快速明确诊断,制定有效的治疗方案非常重要。
一、发病机制
颅脑损伤并NPE的发病机制目前尚未十分明确,多数学者认为与下列几种因素有关:①颅脑损伤后大量的凝血酶释放入血液,激活凝血系统,使血小板发生改变,肺内毛细血管网丰富,引起肺脏发生局灶性DIC 。②创伤后应激反应致中性粒细胞激活聚集,在肺内释放多种蛋白酶,损伤肺毛细血管内皮细胞,使细胞膜通透性增加,引起肺水肿[2]。③创伤后应激反应心输出量增高,高流量的动脉血冲击损伤肺毛细血管内皮细胞间的连接;血液渗入肺泡间隙[1]。④脑损伤后由于应激反应、交感神经兴奋性增高、儿茶酚胺类物质分泌增多,引起全身血管收缩,外周血管阻力增大,左心负荷加重,肺静脉压增高,肺毛细血管通透性增加[3]。国内外大量实验及临床研究表明第四种因素在NPE发病机制中起较为重要的作用[4-5]。
二、诊断与鉴别诊断要点
首先通过体格检查判断颅脑损伤患者肺内情况,昏迷患者经常出现误吸、心力衰竭或严重肺部感染导致的呼吸衰竭等,这需与NPE相鉴别。出现误吸的患者在经口气管插管时可见气道内存在胃内容物或吸痰痰液pH值呈酸性,这些可与NPE相鉴别。典型的NPE可表现为重型颅脑损伤或术后突然出现呼吸急促、发绀、咳粉红色泡沫痰,双肺闻及广泛湿啰音,胸部X线片见大片云雾状阴影,这与急性心力衰竭的发作很难鉴别,须通过心房脑钠肽(BNP)、心电图、中心静脉压(CVP)等检查进行鉴别[6]。严重肺部感染导致的呼吸衰竭可从痰量及痰液性质或胸部CT检查结果与NPE相鉴别。
三、治 疗
明确诊断NPE后,需要果断地采取抢救措施:①快速判断颅内情况,鉴别脑出血与脑梗死,明确有无手术指征,及早降颅压,与此同时积极建立通畅的呼吸通路,经口气管插管为首选,在有创机械通气的基础上清理呼吸道保证氧供,减轻呼吸肌疲劳,降低组织氧耗。镇静镇痛对治疗NPE有明显的帮助,在行机械通气的患者尤为重要,镇静镇痛状态下,患者恐惧情绪及痛觉反应减轻,治疗配合程度增加,人机抵抗程度减少,心脏负荷减轻。NPE与急性呼吸窘迫综合征(ARDS)略有不同,需考虑颅内压情况,轻度呼吸性碱中毒(即低PaCO2)有益于降颅压,一般采用呼气末正压通气(PEEP),可增加肺的通气量,改善肺内分流和通气/灌注比值。②NPE患者存在着导致肺部感染的双重危险因素,需及时预防肺部感染,在严格无菌操作、物品定期消毒、加强患者口腔、呼吸道专项护理的同时应用广谱抗生素,待病情好转后行降阶梯治疗。③肾上腺皮质激素可增加机体对缺氧的耐受性,降低毛细血管通透性,有保护肺泡Ⅱ型细胞分泌表面活性物质以及抗炎、促进肺间质水肿液吸收和维护肺功能的作用,并且可以保护脑细胞,降颅压,减轻颅内出血对脑神经血管及细胞的刺激,因而肾上腺皮质激素在NPE患者中的应用是有益的。④在治疗NPE的同时需注意保护其他器官功能,如心脏、肾脏、胃肠道等。中枢性或积极脱水降颅压后引起的容量不足所致的低血压,及NPE引起的低氧会进一步加重心肌负担,从而引起继发性心肌损伤,在某些患者中会引发不可逆的心力衰竭,因而密切监测血流动力学及适当的干预有助于保护心功能[7]。治疗NPE理想的药物应该能有效地减轻心脏前、后负荷,增加心肌收缩力,达到既能改善NPE又不影响脑灌注压的目的。因而交感神经抑制剂及血管活性药物可被运用在治疗NPE患者中。多巴酚丁胺为β 受体激动剂,选择性作用于心脏的β受体,表现出明显的正性肌力作用而较少影响心率和血压,可用于NPE患者心功能保护方面。甘露醇等脱水利尿药物有肾损伤的不良反应,因而在积极脱水降颅压的同时需监测肾功能。低血压低氧亦会导致胃肠功能障碍,肾上腺皮质激素的应用会增高应激性溃疡发病率,予以必要的抑酸、胃肠黏膜保护剂、促进胃肠动力药物及情况允许下尽早进行肠内营养对患者胃肠道功能恢复有益。⑤严密观察颅脑损伤患者的呼吸频率及痰液、痰量变化情况,动态监测血气,定时复查胸部X线片,重症患者还需监测心输出量、GEDV、血管外肺水及PVPI来进行有效的液体管理[8]。
通过本组病例的抢救,笔者认为治疗NPE应掌握以下原则:应同时兼顾颅内病变和肺水肿的治疗;保持呼吸道通畅,保障氧供是首要任务;抗感染、消除肺水肿应同步实施;加强病因治疗,防治并发症,另外,保护其他脏器功能也至关重要。早诊断早治疗对提高NPE治疗疗效,改善患者预后至关重要。
[1] Davison DL,Terek M,Chawla LS.Neurogenic pulmonary edema.Crit Care,2012 16:212.
[2] 陈金堂.高血压脑出血并发神经源性肺水肿的临床分析.中国热带医学,2009,9:1276,1196.
[3] Inamasu J,Sugimoto K,Yamada Y,et al.The role of catecholamines in the pathogenesis of neuregenic pulmonary edema associated with subarachnoid hemorrhage.Acta Neurochir(Wien),2012,154:2179-2184.
[4] Pyeron AM.Respiratory failure in the neurological patient:the diagnosis of neurogenic pulmonary edema.J Neurosci Nurs,2001,33:203.
[5] Cotter G,Kaluski E,Moshkovitz Y,et al.Pulmonary edema:new insight on pathogenesis and treatment.Curt Opin Cardiol,2001,16:159.
[6] 邱建东,游恒星,陈氡.颅脑损伤并发神经源性肺水肿的治疗体会.临床和实验医学杂志,2006,5:91.
[7] 邓莹,蒋建渝.PiCCO和FloTrac系统在血流动力学监测中的临床应用.中国微创外科杂志,2010,10:567-569.
[8] Mutoh T, Kazumata K, Kobayashi S, et al. Serial measurement of extravascular lung water and blood volume during the course of neurogenic pulmonary edema after subarachnoid hemorrhage: initial experience with 3 cases. J Neurosurg Anesthesiol,2012, 24:203-208.
