不同时期慢性HBV感染者血清IFN-λs水平的变化
2014-08-22杜以真王晓花张孝国张纵阚晓徐皖苏
杜以真 王晓花 张孝国 张纵 阚晓 徐皖苏
HBV属于嗜肝病毒家族,其全球感染超过3.5亿人,HBV慢性感染是肝硬化及肝细胞癌(肝癌)的主要原因[1]。HBV在肝细胞中复制,但并不引起细胞病变,肝脏损害是免疫介导所致。IFN-α/-β和(或) IFN-γ诱导的细胞内抗病毒反应在HBV感染的发病机制中起关键作用,并且IFN-λs在宿主对HBV免疫反应中的作用也逐渐被揭示。IFN-λs是最近被鉴定的一个IFN新家族——Ⅲ型IFN,包括IFN-λ1、2、3(即 IL-29、IL-28A和IL-28B)。目前关于慢性HBV感染患者血清IFN-λs水平的研究较少。为了解IFN-λs与慢性HBV感染转归的相互关系,我们对不同时期慢性HBV感染者,包括HBV携带者、慢性乙型病毒性肝炎(慢乙肝)患者、乙肝肝硬化患者和肝癌患者血清中IFN-λs水平进行了检测。
对象与方法
一、研究对象
2010年7月至10月在我院就诊的120例慢性HBV感染者,HBsAg均阳性,其中HBV携带者、慢乙肝患者、乙肝肝硬化患者、HBV相关肝癌患者各30例,诊断均符合2000年(西安)中华医学会传染病与寄生虫病学分会、肝病学会联合修订的《病毒性肝炎的诊断标准》。HBV携带组男20例,女10例,年龄(21.3±14.6岁)。慢乙肝组患者中,男21例,女9例,年龄(31.3 ± 14.6)岁,轻度8例,中度19例,重度3例,HBeAg均阳性。乙肝肝硬化组男22例,女8例,年龄(52.6 ± 14.1)岁,肝功能Child-Pugh B级17例,C 级13例,HBeAg阳性21例,阴性9例。HBV相关肝癌组男24例,女6例,年龄(56.5 ± 7.2岁),HBeAg阳性8例,阴性22例。同时选取20名进行健康体检的健康人作为健康对照组,其中男14例,女6例,年龄(34.0±13.5岁),HBsAg、HBeAg均阴性。所有入组者均排除丙型病毒性肝炎病毒和HIV感染,酒精性肝病,自身免疫性肝病,药物肝损害。慢性HBV感染患者和健康人肝功能、血清HBV DNA的水平见表1。
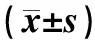
表1 慢性HBV感染患者和健康人肝功能、血清HBV DNA的水平
二、方 法
清晨采集入组者空腹肘静脉血3 ml,于当日分离血清,-70℃冻存待检。采用双抗体夹心ELISA法进行检测,分别使用美国ADL公司生产的鼠抗人IL-29、鼠抗人IL-28A、鼠抗人IL-28B ELISA试剂盒。在这个测定中,标准品与待检测的相关样本和生物素化的干扰素- λs在已包被的干扰素- λs独特表位特异性的微孔中共同孵育。孵育后,洗涤在孔内加入辣根过氧化物酶标记的链霉亲和素。洗涤后,在孔内加入TMB基质液,颜色的变化与结合的干扰素- λs水平成比例,终止液将从蓝色变为黄色,显色的强度可被450 nm的波长测定。测定的吸光强度与干扰素- λs水平成正比。将每组IFN- λs标准品吸光强度与相对水平吸光度绘制成标准曲线,通过标准曲线,计算待测样本的IFN- λs水平。
三、统计学处理
结 果
一、慢性HBV感染患者和健康人血清IFN-λ1(IL- 29)水平比较
慢乙肝、乙肝肝硬化、肝癌患者的血清IFN-λ1(IL-29)水平均明显低于健康对照组(P均<0.01);慢乙肝、乙肝肝硬化、HBV相关肝癌患者血清IFN-λ1(IL-29)水平明显低于HBV携带者(P均<0.01);HBV携带者血清IL-29水平与健康对照组比较差异无统计学意义(P>0.05),慢乙肝、乙肝肝硬化患者与HBV相关肝癌患者比较差异无统计学意义(P>0.05),见表2。
二、慢性HBV感染患者和健康人血清IFN-λ2(IL-28A)水平比较
5组研究对象血清IFN-λ2(IL-28A)水平比较差异无统计学意义(P>0.05),见表3。
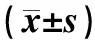
表2 慢性HBV感染患者和健康人血清IFN-λ1(IL- 29)水平比较
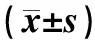
表3 慢性HBV感染患者和健康人血清IFN-λ2(IL-28A)水平比较
三、慢性HBV感染患者和健康人血清IFN-λ3(IL-28B)水平比较
HBV相关肝癌患者血清IFN-λ3(IL-28B)水平高于健康人、HBV携带者、慢性乙肝患者、肝硬化患者(P均<0.01);HBV携带者、慢乙肝、乙肝肝硬化和健康对照组间血清IL-28B水平比较差异无统计学意义(P>0.05),见表4。
讨 论
HBV感染仍然是重要的全球公共健康问题,目前,全世界超过3.5亿人感染HBV,持续的慢性感染有发展为肝硬化、肝癌的危险[1]。抗病毒是治疗慢性HBV感染的关键,IFN-α和核苷(酸)类药物是治疗慢乙肝的推荐药物[2]。有研究认为,使用IFN -α治疗可降低慢乙肝患者HBV相关肝癌的发生率[3]。虽然IFN -α已被用于临床治疗慢性HBV感染,但仅对约40%的患者有效,而且IFN-α是多向性的细胞因子,其感受器分布广泛,不良反应较多,不适用于乙肝肝硬化及肝癌患者[4]。随着核苷(酸)类似物在慢乙肝抗病毒治疗中的不断推广,核苷(酸)类似物治疗相关的耐药变异也日益增加。因此,迫切需要寻找一种疗效更好、不良反应较少的治疗方法。
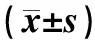
表4 慢性HBV感染患者和健康人血清IFN-λ3(IL-28B)水平比较
IFN-λs具有体外抗HCV和HBV的抗病毒特性。IFN-λs抑制HBV的分子机制与IFN-α/-β和IFN-γ都是通过阻止包裹HBV RNA的衣壳在细胞质中组装,抑制HBV复制[5]。除了抗病毒性之外,IFN-λs还具有抗细胞增殖和抑制体内肿瘤增生活性。与Ⅰ型IFN类似,IFN-λs的抗肿瘤机制包括:①通过抑制内皮细胞活性来抑制肿瘤血管生成;②通过增强T细胞、NK细胞、树突状细胞以及巨噬细胞的免疫活性间接杀伤肿瘤细胞;③增强肿瘤细胞的免疫源性来增强机体的抗肿瘤免疫反应。有研究证明了IFN-λs在鼠癌模型中有抗肿瘤活性[6],IFN-λs与Ⅰ型IFN具有共同的生物活性,不过由于IFN-λs感受器表达受限,其功能具有组织特异性。因此,IFN-λs治疗可能引起的不良反应较少,改善既往IFN治疗的耐受性。目前有关HBV感染的人体内的IFN-λs水平研究较少,因此有必要充分了解慢性HBV感染患者体内IFN-λs的表达状态,以及其抗病毒反应的调节和活动。
本研究对慢性HBV感染者,包括HBV携带者和慢乙肝、乙肝肝硬化、HBV相关性肝癌患者血清中IFN-λs水平进行检测,并与健康人作对照,结果显示人体体内IFN-λs水平并未因慢性HBV感染呈显出高表达;相反,慢乙肝、乙肝肝硬化、HBV相关肝癌患者的血清IFN-λ1(IL-29)水平均明显低于健康对照组(P均<0.01),慢乙肝、乙肝肝硬化、HBV相关肝癌患者血清IFN-λ1(IL-29)水平明显低于HBV携带者(P均<0.01)。这可能是由于HBV感染在免疫反应启动之前就已建立,与HBV不诱导干扰素-α/β的表达、却抑制IFN-α/-β产生相似[7]。慢性HBV感染也不会诱导IFN-λs的高表达,反而抑制IFN-λ1(IL-29) 产生。也正是由于IFN-λs和IFN-α/-β表达不足,使HBV免疫逃逸,造成慢性感染。也可能在HBV的免疫清除过程中IFN-λ1(IL- 29)参与了重要作用,使之消耗,在慢乙肝患者表现更为明显。因此,对应用IFN-α无效、或不耐受IFN-α治疗的慢乙肝、乙肝肝硬化、HBV性肝癌患者,IFN-λs可作为替代治疗或联合治疗药物之一,发挥其抗病毒、调节免疫、抗肿瘤作用。
有研究发现,IFN-λ在膀胱癌、血液病、乳腺癌、神经胶质瘤和肺癌组织中高表达,而且3种肿瘤相关的转录因子(甾体生成因子-1,肾母细胞瘤-1和P53)结合位点均在人IFN-λ转录起始位点上游1.0 kb以内的区域。本研究结果显示,HBV相关性肝癌患者血清中IFN-λ3(IL-28B)的水平明显高于其他人群(包括HBV携带者、慢乙肝、乙肝肝硬化患者及健康人)。由此推测,IFN-λ3(IL-28B)可能与肝癌的发生密切相关,检测慢乙肝、肝硬化患者血清的IFN-λ3(IL-28B),可能预测肝癌的发生、发展和预后。但结果尚待进一步大规模研究,并动态观察、随访肝癌患者IFN-λ3(IL- 28B)变化验证。
[1] Liang TJ, et al. Hepatitis B: the virus and disease. Hepatology,2009,49:S13-S21.
[2] 中华医学会肝病学分会、感染病学分会. 慢性乙型肝炎防治指南. 中华传染病杂志, 2005,23:421-431.
[3] Perrillo R. Benefits and risks of interferon therapy for hepatitis B. Hepatology, 2009,49:S103-S111.
[4] Moucari R, Korevaar A, Lada O, et al. High rates of HBsAg seroconversion in HBeAg-positive chronic hepatitis B patients responding to interferon: a long-term follow-up study. J Hepatol,2009,50:1084-1092.
[5] Pagliaccetti NE, Chu EN, Bolen CR, et al. Lambda and alpha interferon inhibit hepatitis B virus.Virology,2010,401:197-206.
[6] Muir AJ, Shiffman ML, Zaman A, et al. Phase 1b study of pegylated interferon lambda 1 with or without ribavirin in patients with chronic genotype 1 hepatitis C virus infection. Hepatology, 2010 ,52:822-32.
[7] Abushahba W, Balan M, Castaneda I. Antitumor activity of Type I and Type Ⅲ interferons in BNL hepatoma mode.Cancer Immunol Immunother,2010,l59:1059-1071.
[8] Yang L, Wei J, He S. Integrative genomic analyses on interferon-lambdas and their roles in cancer prediction. Int J Mol Med, 2010,25:299-304.
