有限稀释克隆法培养分离人牙周膜干细胞实验研究
2014-07-14牛巧丽尹宏斌钟良军
封 艳, 牛巧丽, 尹宏斌, 钟良军, 赵 今
(新疆医科大学第一附属医院1牙体牙髓科, 2颌面外科, 乌鲁木齐 830054; 3杭州师范大学附属医院口腔科, 杭州 310015)
从体内取得的培养组织在体外培养得到的大部分是各种混合细胞的生长,而在对体外培养细胞进行实验研究时都要求采用单一种类细胞进行,以便能够对某一种类细胞的功能、形态等的变化进行研究。因此,培养细胞的纯化就成为细胞体外实验研究的重要步骤。牙周膜组织中包含有成纤维细胞、成骨细胞、成牙骨质细胞和间充质细胞等具有异质性的复杂的细胞群,而其中只有一小部分的细胞群具有牙周膜干细胞的自我更新能力。国内外学者们一直致力于研究在牙周组织缺损处能大量出现牙周膜干细胞并促进牙周再生[1]。所以,对牙周膜干细胞的培养、分离纯化、鉴定等相关研究有着重要的理论价值和临床意义。国内外对牙周膜干细胞研究时多采用有限克隆稀释法获得牙周膜干细胞,但有关此方法具体操作的文献不多。本研究对采用有限克隆稀释法培养分离筛选人牙周膜干细胞的具体步骤、实验方法细节以及分离纯化后人牙周膜干细胞的生物学活性的鉴定等方面进行详细的阐述,探讨此方法的优势和特点。
1 材料与方法
1.1实验试剂和仪器低糖DMEM培养基、美国胎牛血清(fetal bovine serum,FBS)、胰蛋白酶(Gibco公司,美国),小鼠抗人STRO-1 单克隆抗体( R&D,美国),羊抗小鼠IgG-FITC 荧光二抗(eBioscience公司,美国),DAB 显色试剂盒(北京中杉金桥生物技术有限公司,中国),PBS液、4%多聚甲醛(HyClone 公司,美国),双抗、地塞米松、维生素C、β-磷酸甘油钠、吲哚美辛、3-异丁基-1-甲基黄嘌呤(3-isobuty-1-methylxanthine,IBMX,上海索莱宝生物科技有限公司),小鼠抗人波形蛋白(Vimentin)、小鼠抗人角蛋白(PCK)、兔抗人骨钙素、兔抗人骨桥蛋白、兔抗人Ⅰ型胶原、兔抗人Ⅲ型胶原、免疫组织化学试剂盒(武汉博士德生物工程有限公司),各型号培养板、培养瓶、冻存管、离心管(Corning Costar公司,美国),其他试剂均为国产分析纯级。CO2清洁型培养箱(Heal Force,香港),SW-CJ-2FD型高性能超净工作台(苏州),DMI400B型正置、倒置相差显微镜、Leica荧光显微镜和成像系统(Leica公司,德国)。
1.2实验方法
1.2.1 原代培养人牙周膜干细胞(hPDLSCs) 在经过新疆医科大学第一附属医院医学伦理委员会批准,并获取患者及监护人的知情同意后,从正畸科临床病人中取样。标本取自临床上12~14岁因正畸治疗需要拔除的牙周健康、无龋的新鲜前磨牙,移入离心管中,离心管中加有培养液(含100 mL /L 胎牛血清、200 mmoL /L谷胺酰胺、100 U/mL青霉素、100 μg/mL链霉素的低糖DMEM培养基)并含高浓度双抗(1 000 U/mL青霉素和1 000 μg/mL链霉素)。标本需在含高浓度双抗的培养基浸泡约30 min后进入实验室超净台,用含高浓度双抗的PBS(1 000 U/mL青霉素和1 000 μg/mL链霉素)反复冲洗,由冠向根单向刮取根中1/3的牙周膜组织,用新鲜培养液将刀片上的牙周膜组织冲至培养皿中,重复数次后,将含有牙周膜组织块和低糖DMEM培养基的培养皿放入37℃、5%CO2培养箱,前3 d组织块未完全贴壁可不换液,第6、9天可以轻柔地半量换液,约12 d,组织块周围有细胞爬出时,可以全量换液,到组织块周围爬出的细胞达到对数生长期时,含EDTA的0.25%胰蛋白酶消化传代。
1.2.2 有限克隆稀释法培养分离人牙周膜干细胞(hPDLSCs)
1.2.2.1 接种 首先在接种前先准备适应性培养基,收集的对数生长期牙周膜细胞的培养液按1 500 r/min离心10 min,经0.22 μm直径的小滤器过滤后,与新鲜配制的培养基以1∶1比例混合制成适应性培养基[2-3]。原代培养的牙周膜细胞消化时尽量吹打成单个细胞,单个细胞至少占细胞悬液的90%以上,否则获得单克隆的概率将减少。计数细胞悬液,调整细胞密度为10~15个/mL,种于96孔板,每孔加100 μL适应性培养基,接种时不断吹打混匀细胞悬液,避免细胞沉淀造成接种不匀。
1.2.2.2 标记和换液 接种24 h后在带有37℃恒温板的倒置显微镜下开始观察培养板中各孔细胞数,挑选只含1个细胞的孔做标记,继续培养。由于细胞贴壁时间长短不一,故同一块96孔板还需在接种48~72 h再挑选1次单细胞孔。在确认培养孔中的细胞数时,应特别注意观察培养孔的周边,这些位置细胞折光弱不易看清,易漏记、错记。最好由2个人合作,1个人看,1个人复查进行确认。每块96孔板观察时间尽量控制在2 h以内,时间过长会影响单细胞贴壁和分裂,还可能造成96孔板边缘的培养孔中的培养液蒸发或者污染。
接种5 d后不换液,也不做长时间观察,只需在单细胞孔加20 μL新鲜培养液,每3天加1次。当单个细胞形成50个细胞以上的细胞集落时(约在接种15 d),对单细胞孔进行每3天1次的半量换液,1 w后改为每3天1次的全量换液。
1.2.2.3 传代转种和扩大培养 在接种96孔板6 w左右,孔中形成较大的克隆,待细胞克隆面积>96孔底面积的1/2,最好达到2/3时进行转种。消化时用不含EDTA的0.25%胰蛋白酶,先将胰蛋白酶在37℃孵育箱预温,96孔板每孔加胰蛋白酶30 μL,轻轻吹打孔底,尤其是孔底周边,消化时间控制在1 min内,用新鲜培养液200 μL终止消化。将细胞悬液移至48孔板的单孔内,并加新鲜培养液至每孔600 μL体系。3 d后换液,待细胞汇合率达70%~80%时仍用不含EDTA的0.25%胰蛋白酶每孔60 μL消化后,转种到24孔板扩大培养。同样24孔板的细胞汇合率在达到70%~80%时转种到12孔板,再转种到6孔板及6 cm、10 cm培养皿内。此时从每个10 cm皿可以获得1×106数量左右的纯化人牙周膜干细胞单克隆细胞株。
1.2.3 人牙周膜干细胞的鉴定
1.2.3.1 流式细胞仪分析 将P7代牙周膜干细胞扩大培养至约1×106/mL,0.25%含EDTA胰酶消化制备成单细胞悬液, PBS洗2遍后转入1.5 mL EP管,加预冷的PBS132 μL重悬细胞,吹匀后加入预冷的95%乙醇368 μL吹打混匀, 4 ℃过夜后,每只EP管中加4 μL RNA酶,37℃孵育30 min,每管避光加入5 mL/L的碘化丙锭(PI)0.4 mL, 4 ℃染色30 min, 300目的尼龙筛网过滤样品后,流式细胞仪检测细胞周期。
1.2.3.2 免疫荧光人牙周膜干细胞特异性抗原表达 取生长良好P7代的克隆化培养的纯化的人牙周膜干细胞,按2×104/mL接种于3.5 cm培养皿,培养5 d细胞汇合率达70%时固定进行荧光染色。4%的多聚甲醛2 mL固定过夜。为去除内源性过氧化物酶,加3%过氧化氢溶液2 mL室温作用30 min,再加1%Triton 2 mL室温作用30 min,以上每一步都用PBS洗3遍,加入1 mL 5%山羊血清37℃封闭30 min。直接甩去山羊血清,然后滴加适量稀释后的鼠抗人STRO-1单克隆抗体(1∶500)以及鼠抗人CD146单克隆抗体(1∶500),阴性对照组以PBS作为一抗滴加,置于湿盒中4 ℃过夜。次日PBS洗3遍洗去一抗,避光加入1∶1 000稀释的FITC荧光标记二抗1 mL,37 ℃避光孵育1 h,吸取二抗弃之,避光加Hoechest33342复染核15 min。激光共聚焦显微镜下观察、拍照。
1.2.4 PDLSCs骨向分化能力的检测
1.2.4.1 免疫细胞化学染色 将P7代牙周膜干细胞以密度为1×104/mL接种于3.5 cm培养皿,培养24 h细胞贴壁后,加入成骨诱导剂(0.1 μmol/L地塞米松、50 mg/L维生素C、10 mmol/L β-磷酸甘油钠)培养7 d进行染色。细胞处理步骤同免疫荧光的细胞处理,在滴加一抗时有小鼠抗人波形蛋白(Vimentin)、兔抗人骨钙素(OC)、兔抗人骨桥蛋白(OPN)、兔抗人Ⅰ型胶原(COL-Ⅰ)、兔抗人Ⅲ型胶原(COL-Ⅲ) 、小鼠抗人角蛋白(PCK),抗体稀释按照1∶50比例,置于湿盒中4℃过夜。次日PBS洗3遍洗去一抗,加入通用型二抗,非避光孵育1 h,PBS洗去二抗,加DAB染色液(DAB缓冲液取1 mL加DAB浓缩液1滴混匀),立即在显微镜下观察染色程度,适中时用蒸馏水冲洗终止染色,反复冲洗几遍后,加入苏木素染液复染细胞核,室温作用5 min后蒸馏水冲洗,即可在倒置相差显微镜下观察。
1.2.4.2 茜素红钙盐染色 将P7代牙周膜干细胞以密度为2×104/mL接种于3.5 cm培养皿,培养24 h细胞贴壁后,加入成骨诱导剂进行骨诱导,对照组为不含诱导剂的常规培养基。每3天换液1次,4 w后观察并用茜素红钙盐染色法测定PDLSCs的骨向分化能力。
2 结果
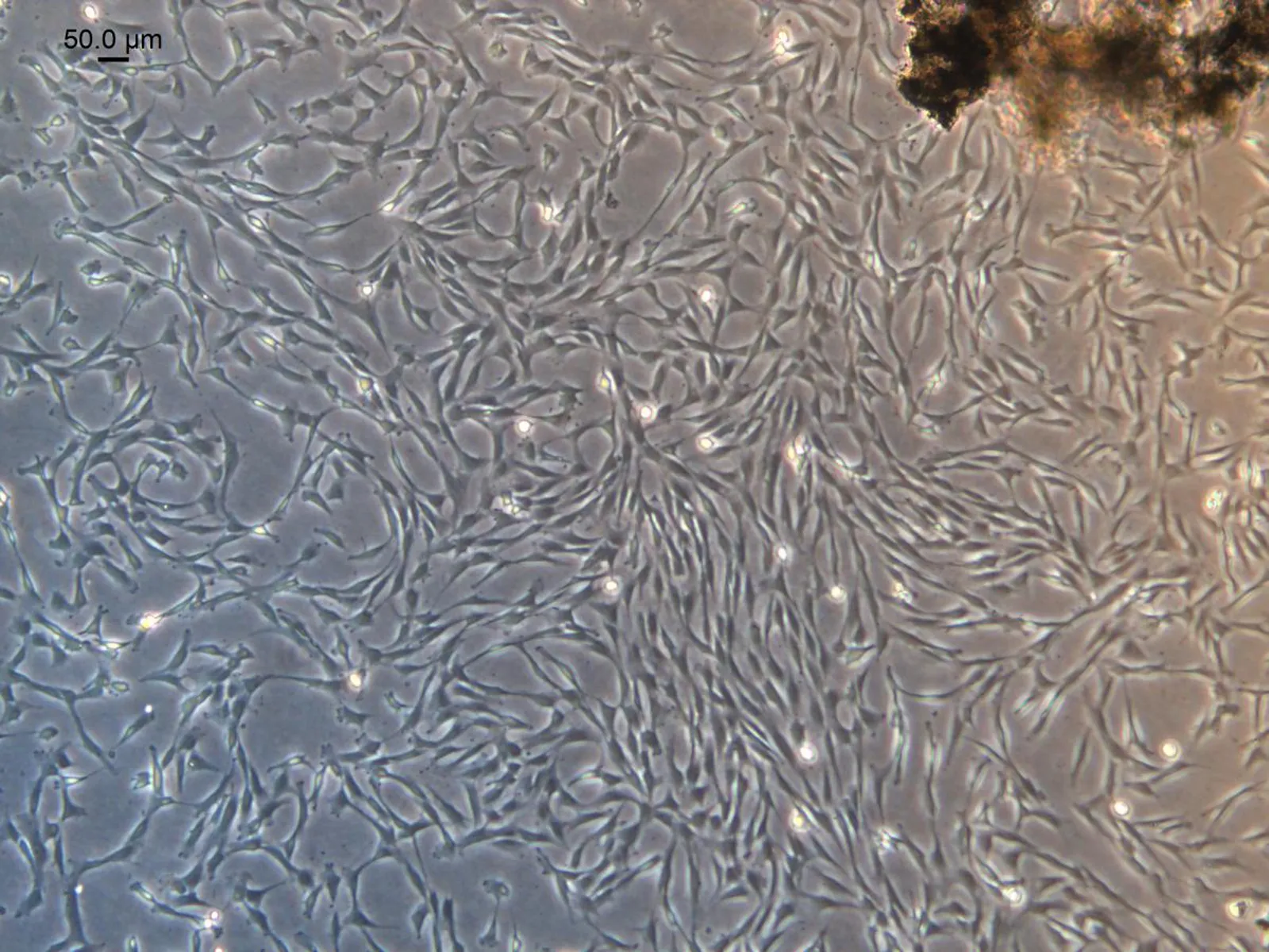
2.1PDLSCs的分离和纯化手术刀尖上为从离体牙牙根2/3处刮下的牙周膜组织块,3.5 cm培养皿里有牙周膜组织块和培养液(图1)。组织块法培养约10 d可见细胞从组织块中爬出,右上角黑褐色膜块状物为牙周膜组织块。原代培养的牙周膜细胞主要为短梭形, 1~2 个突起,少数为多边形、纺锤状或椭圆形, 细胞体积较小,核居中,胞核和胞浆都较饱满(图2)。

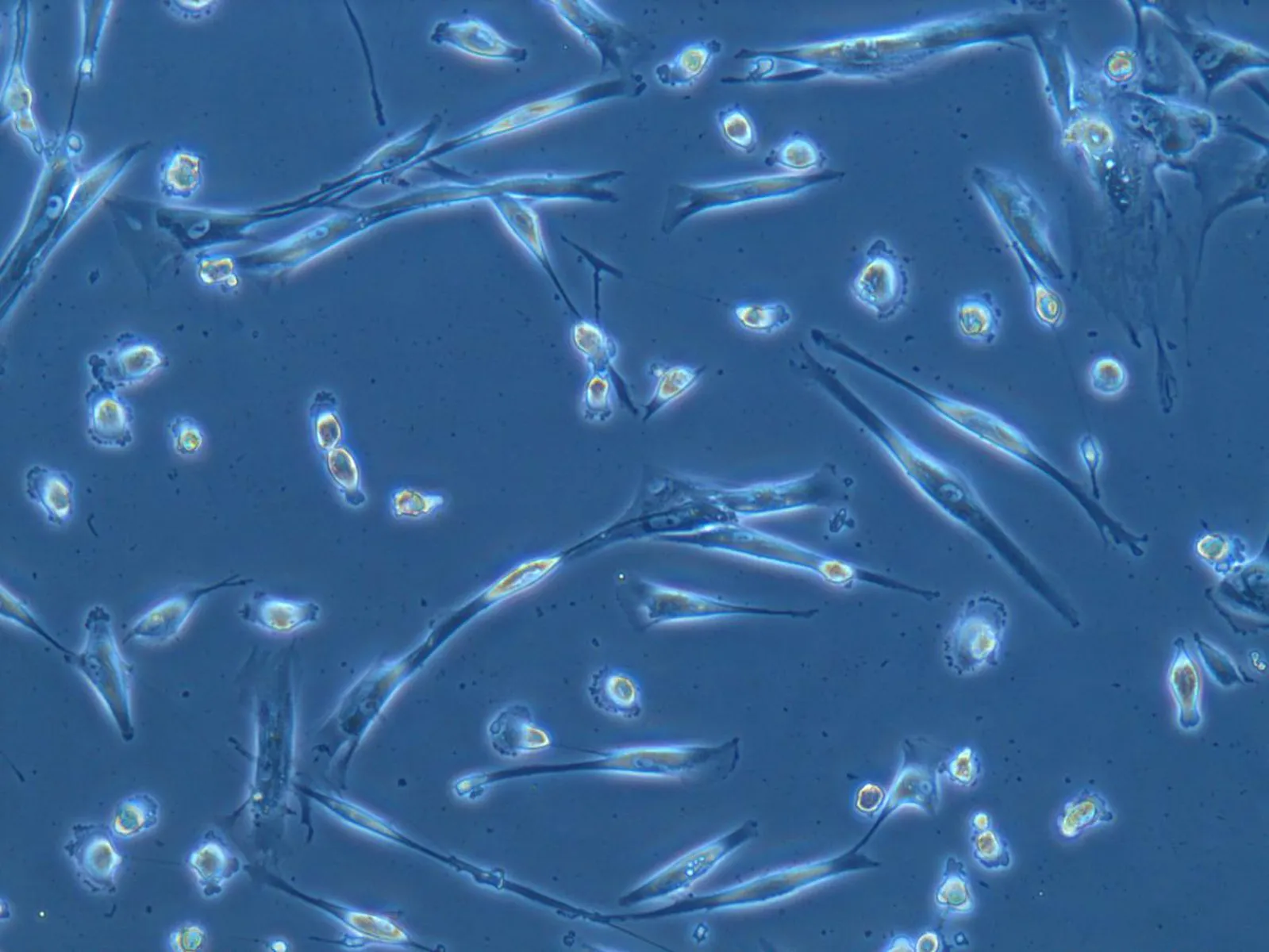
2.2克隆形成情况在含有适应性培养基的96 孔板接种细胞,培养24 h后单个细胞贴壁,可见细胞伸长并伸出较长的突起,并开始产生新的分裂(图3a)。细胞接种10~15 d后有30个左右细胞形成较小的克隆(图3b),计算细胞克隆形成率为6.13%。细胞接种35~45 d时镜下可以观察到较大克隆状生长的细胞集落,中心密集的细胞边界不清,呈圆形或不规则形,排列呈旋涡。周边的细胞呈梭形或多角形,部分细胞呈成纤维细胞状,细胞之间排列紧密(图3c)。
a: 接种24 h 96孔板单个细胞状态(100×,DIC)b: 接种约15 d 96孔板中约30个细胞的集落(50×,BF)c: 接种40 d 96 孔板中较大细胞集落(50×,PH)
2.3分离纯化人牙周膜干细胞株牙周膜干细胞在纯化培养时会出现数量较多的圆形、卵圆形的纯化的牙周膜干细胞,细胞核非常丰富和饱满,胞浆少,核浆比例高,呈幼稚生长状态,与其周围的长梭形牙周膜细胞有明显的区别。P7代纯化的牙周膜干细胞呈非对称分裂,既可以对称性性分裂成2个圆形牙周膜干细胞,也可以非对称分裂成长梭形的成体牙周膜细胞(图4)。
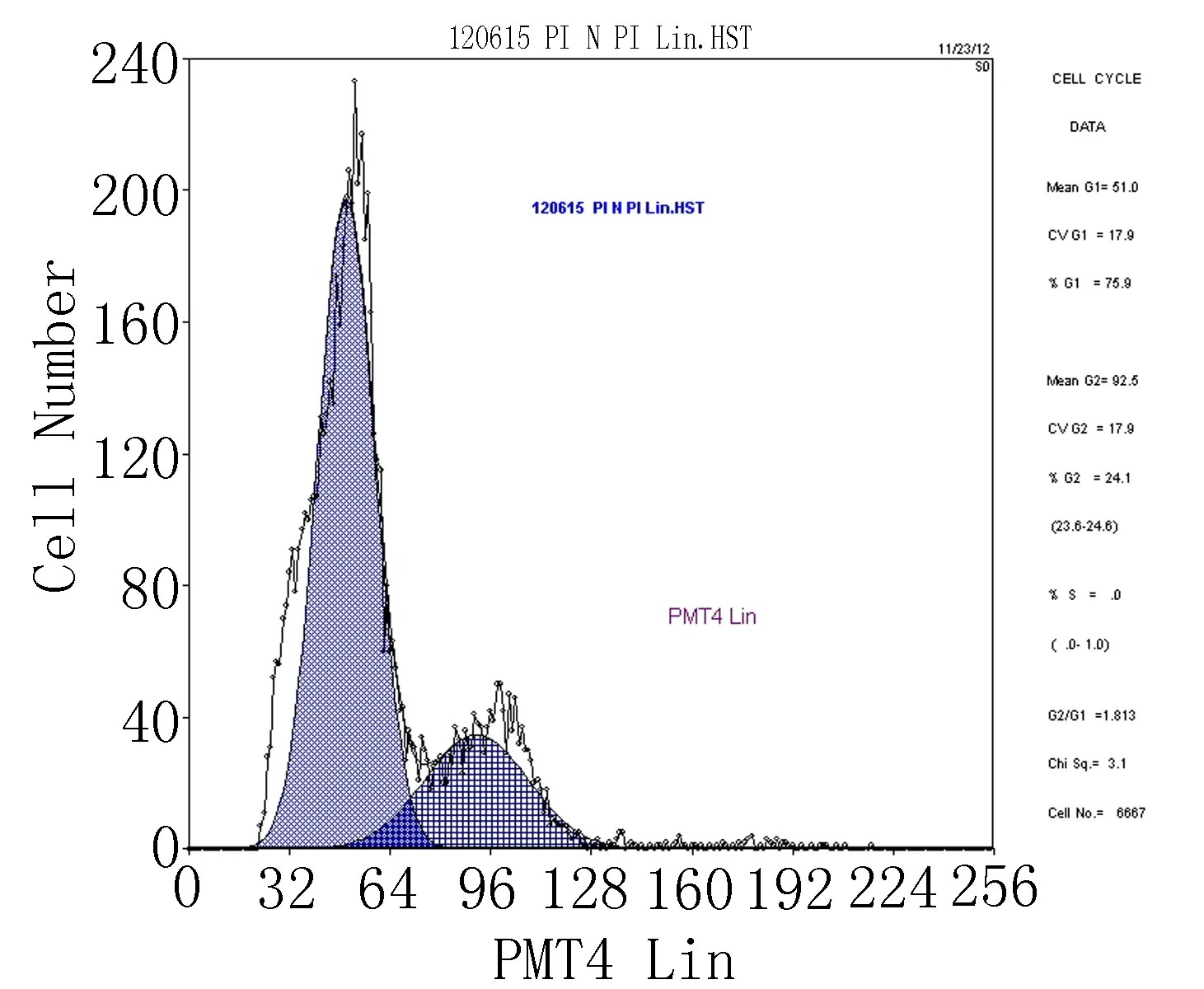
2.4流式细胞分析牙周膜干细胞的细胞周期牙周膜干细胞细胞周期绝大多数处于G0/G1期(75.9%),即静止期及DNA合成前期。G2期细胞为24.1%,S期细胞为0,大部分处于静止期或缓慢增殖期(图5)。
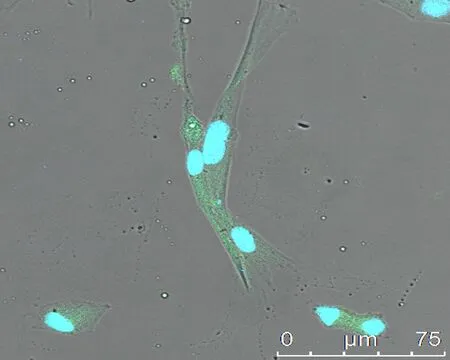
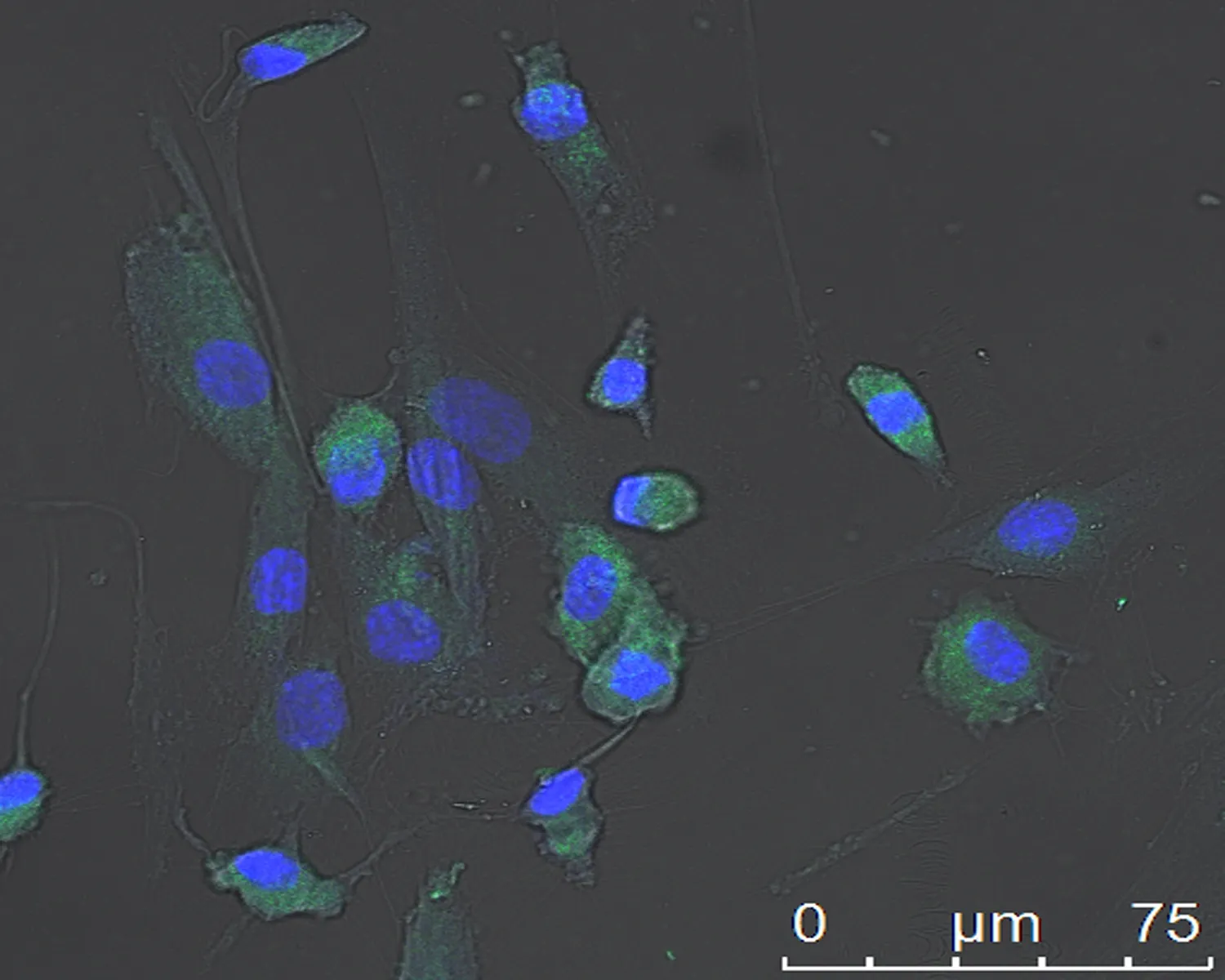
2.5免疫荧光检测牙周膜干细胞特异性蛋白表达牙周膜干细胞纯化后STRO-1、CD146免疫荧光染色均为阳性表达,激光共聚焦显微镜下显示STRO-1不仅在干细胞胞浆内表达,胞浆呈现绿色荧光,随着染色时间的延长,在干细胞胞核内也出现STRO-1的阳性表达,本是蓝染的胞核与胞核内STRO-1绿色表达重叠后呈现蓝绿色(图6)。而CD146只在胞浆中表达,胞浆呈现绿色,胞核呈Hoechest33342复染后的蓝色(图7)。
2.6牙周膜干细胞骨向诱导分化后免疫细胞化学染色牙周膜干细胞经骨诱导后,胞浆中COL-Ⅰ、OPN、COL-Ⅲ、Vimentin、BGP阳性表达,表现为胞浆呈棕黄色,胞核经苏木素复染呈蓝色(图8a~e)。PCK为阴性表达,表现为蓝色胞浆,蓝紫色胞核(图8f)。而未诱导的人牙周膜干细胞胞浆中除Vimentin为阳性表达及PCK为阴性表达外, COL-Ⅰ、COL-Ⅲ、BGP、OPN均为弱阳性表达。
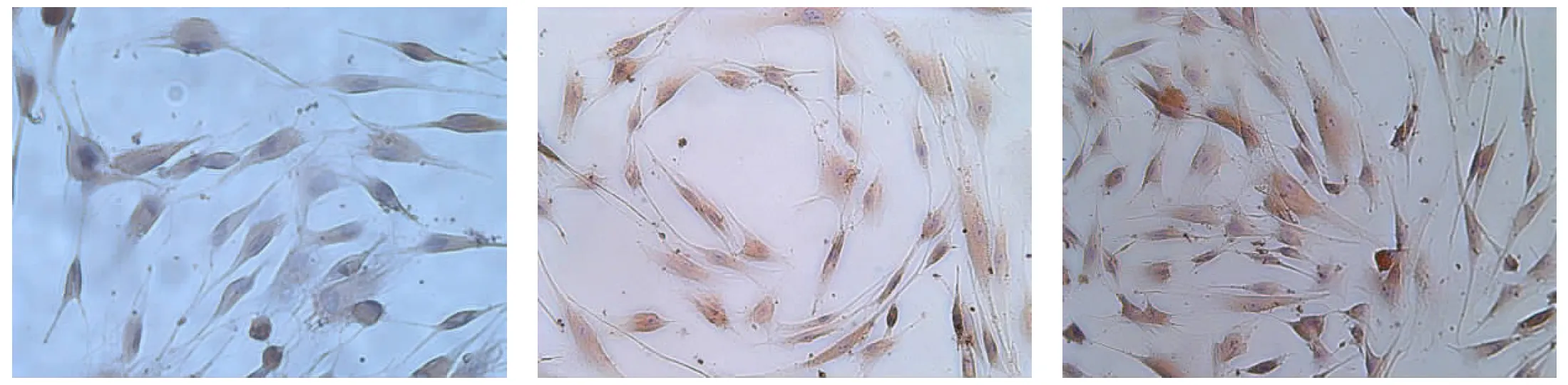
a: 兔抗人Ⅰ型胶原(COL-Ⅰ)阳性表达,胞浆呈棕黄色b: 兔抗人骨桥蛋白(OPN)阳性表达,胞浆呈棕黄色c: 兔抗人Ⅲ型胶原(COL-Ⅲ)阳性表达,胞浆呈棕黄色
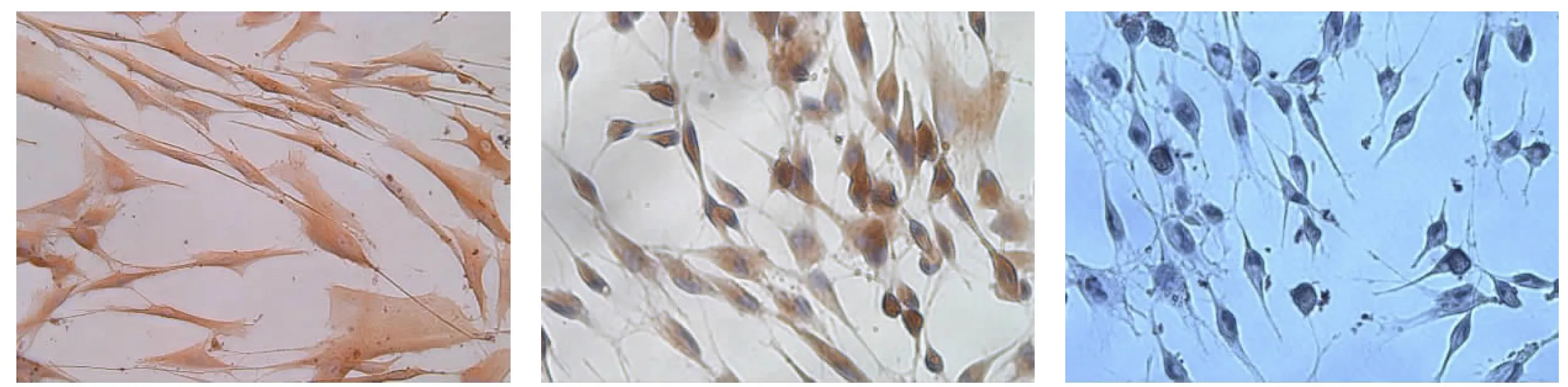
图8 骨诱导后牙周膜干细胞免疫细胞化学染色特异性蛋白的表达(200×,BF)
d: 小鼠抗人波形蛋白(Vimentin)阳性表达,胞浆呈棕黄色e: 兔抗人骨钙素(BGP)阳性表达,胞浆呈棕黄色f: 小鼠抗人角蛋白(PCK)阴性表达,呈蓝色胞浆
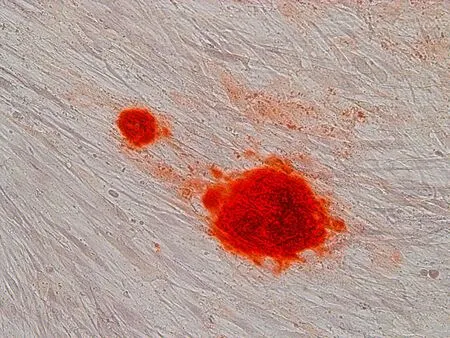
2.7茜素红钙盐染色牙周膜干细胞在成骨诱导液培养7 d后,细胞数量增多,形态变小,排列紧密,细胞的长梭形突起短缩,局部呈复层生长。12 d左右细胞密集区出现许多小的细胞堆积物,并逐渐增大。14 d茜素红染色,可见红色矿化结节(图9)。
3 讨论
通常细胞分离纯化方法分为自然纯化和人工分离纯化2种。由于无法人为地选择细胞,自然纯化的方法逐渐被淘汰。人工分离纯化细胞的方法比较多,除密度梯度离心、反复贴壁法、机械刮除法、培养基限定法以外,目前比较常用的是有限克隆稀释法、流式细胞分选方法、免疫磁珠分选法。
免疫磁珠分选法是一种十分简捷高效的细胞分离纯化的方法,具有分离纯度高、细胞处理量大、分选方式灵活及细胞分离后仍保持很好活力等优势。研究表明,免疫磁珠运用于分离牙周膜干细胞的获得率<1%[4];免疫磁珠分选法也有其弱点,价格昂贵是制约其广泛应用的主要因素,还有其他一些因素,如:标记的抗体的磁珠若选择过大,则分选细胞可能会导致细胞激活或影响后续实验;孵育时间过长会引起非特异性结合。免疫磁珠还有可能和死亡细胞非特异性结合,降低了分选效率等[5]。利用流式细胞仪分离牙周膜干细胞,方法简单易行,获得牙周膜干细胞的速度较快[6-7]。但其需特殊的器械,对细胞数量的要求也比较多,费用较高。另外由于流式细胞仪自身作用机理,分选后的细胞部分受损而死亡。
有限稀释克隆法不需要特殊设备,操作简单,实验耗费小,适合大批量的克隆纯化培养,已广泛用于异质性细胞系的克隆和培养,是目前最常用的方法。但是利用有限稀释克隆法分离的牙周膜干细胞速度慢。本研究显示,从1个单细胞扩增到1×106数量级需要80~90 d。另外在本实验过程中,接种于96孔板单细胞孔的检出率为18%~25%,平均为21%,但是能在96孔板中形成克隆并达到传代的集落只占到6.1%,其余单细胞孔的细胞不增殖或增殖缓慢,最终老化死亡。而在细胞克隆传代过程中,胰酶作用过长,细胞会死亡;胰酶作用过短,细胞未完全脱离贴壁,两者均造成消化后细胞数量过少,从而使得传代后细胞增殖缓慢,出现分化或污染。另外有限稀释克隆法步骤较为烦琐,耗时长,在此过程中容易出现细胞污染,以上因素使得最终细胞克隆率为1.2%,比张玉峰等[8]的研究结果细胞克隆率为2.3%要低。但有限稀释克隆法在实验条件简单、经费少、时间充裕的情况下不失为获得牙周膜干细胞较有效的方法,故在牙周膜干细胞分离纯化时需根据实验条件、经费、时间等因素进行选择。对于免疫磁珠分选法、流式细胞仪分选法、有限稀释克隆法对牙周膜干细胞分离纯化的纯度、回收率以及分离后细胞活性的比较将是进一步的研究内容。
成体干细胞主要以对称性分裂和非对称性分裂2种方式生长,对称性分裂形成2个相同的干细胞,非对称性分裂生成1个分化细胞,而另1个仍作为干细胞保留下来[9-10]。各种成体干细胞的体内外生长特性和表型可能不尽一致,但成体干细胞通常处于静息状态,分裂缓慢,在形态学上表现为细胞体积小,胞内细胞器稀少,细胞内RNA含量低,在组织结构中位置相对固定[11]。本研究显示,经过有限稀释克隆法富集和纯化的牙周膜干细胞,在倒置显微镜下可以观察到其作为成体干细胞这种对称分裂和非对称分裂2种生长方式;从形态学同样观察到牙周膜干细胞胞核非常丰富和饱满,而胞浆较少,整体细胞体积较牙周膜细胞小,与Vander-Kooy等[9]与Vogel[11]等的研究结论一致。
本研究认为在有限稀释克隆法分离牙周膜干细胞中应注意以下几点:(1)尽量选用原代培养的细胞,在原代培养的细胞中牙周膜干细胞比例较高,相应在稀释后得到单个牙周膜干细胞的概率也就较高。(2)在稀释后做单细胞接种时,需多接种几块96孔板。(3)在单细胞培养和形成集落的过程,以及维持干细胞状态作用中,都需要提高培养液中胎牛血清的浓度,一般提高到15%~20%的血清浓度。(4)为避免干细胞出现分化,除需提高血清浓度以及及时换液外,细胞汇合率达到70%~80%就需进行牙周膜干细胞传代,细胞汇合率80%干细胞易发生分化。
参考文献:
[1] 郭娇娇. 碱性成纤维细胞生长因子对大鼠牙脱位延迟再植的影响[D]. 河北:河北医科大学,2012.
[2] 徐斌,徐婕,刘宏伟. 人牙周膜干细胞的分离培养及体外诱导分化研究[J].口腔医学研究,2011,8(27):702-705.
[3] 张璟. 年龄因素对牙周膜干细胞增殖与分化能力的影响[D]. 西安:第四军医大学,2012.
[4] Ivanovski S, Gronthos S, Shi S, et al. Stem cells in the periodontal ligament[J].Oral Dis,2006,12(4):358-363.
[5] 董雪涛. 胶质瘤中hMena蛋白表达与恶性胶质瘤侵袭方式的研究[D]. 天津:天津医科大学,2011.
[6] 陈芳. 牙周膜干细胞的研究进展[J]. 国际口腔医学杂志,2008,35(6):672-674.
[7] 刘悦明. 牙周膜干细胞的研究进展[J]. 临床口腔医学杂志,2010, 26(9):570-572.
[8] 张玉峰,程祥荣,施斌,等 诱导成体人牙周韧带干细胞向软骨细胞分化的实验研究[J] .中华口腔医学杂志,2006,41(4):216-219.
[9] Vander-Kooy D, Weiss S. Why stem cell[J] .Science, 2000,287(5457):1439-1441.
[10] 王春亮,刘瑞莲. 干细胞移植与运动性颅脑损伤的修复[J] .中国组织工程研究与临床康复,2010,14(40):7560-7563.
[11] Vogel G. Cell biology. Nobel laureates lobby for stem cell[J]. Science, 2001,291(5509):1683-1684.
