少数民族活体肾移植受者人群的糖尿病患病情况及相关危险因素分析
2014-07-14热依汉西里甫米克热衣艾孜买提古丽巴努尔胡西塔尔
王 郁, 姚 华, 热依汉·西里甫, 米克热衣·艾孜买提, 古丽巴努尔·胡西塔尔 , 丁 一
(新疆医科大学1公共卫生学院, 乌鲁木齐 830011, 2第一附属医院, 3第一附属医院肾病科, 乌鲁木齐 830054)
近年来,肾脏移植后糖尿病(post-transplant diabetes mellitus,PTDM)作为肾移植受者(KTR)的一种常见慢性并发症越来越受到关注。PTDM是术前无糖尿病、术后排除急性糖代谢紊乱后,达到了糖尿病诊断标准、持续高血糖状态或血糖正常但正在使用胰岛素或口服降糖药物者[1]。现有证据表明PTDM是致移植肾失功及KTR死亡的主要因素,严重威胁KTR的生活质量及长期生存率[2]。鉴于在少数民族活体肾移植受者中进行PTDM的调查较少,本研究收集并整理2004年7月-2013年6月在新疆医科大学第一附属医院接受活体肾移植手术的少数民族患者116例的相关资料,结合文献探讨PTDM的患病率,分析其可调节、不可调节的危险因素,以期早发现高危人群并进行定期随访监测,为PTDM的早期干预提供依据。
1 资料与方法
1.1研究对象选择标准:2004年7月-2013年6月在新疆医科大学第一附属医院接受活体肾移植手术的少数民族患者。排除标准:(1)术前病史资料不详细;(2)随访资料不完整;(3)术后肾移植存活时间不足1 a;(4)术前患有糖尿病;(5)多器官移植受者或2次及以上肾移植受者。
1.2方法
1.2.1 设计 对所收集资料进行回顾性调查,采用的调查形式包括查阅住院病史(包括再入院病史)、门诊病史、随访记录等。
1.2.2 PTDM诊断标准 按照世界卫生组织制订的糖尿病诊断标准来确定,即肾移植后患者有糖尿病的症状,血糖≥11.1 mmol/L,空腹血糖≥7.0 mmol/L;或者肾移植后患者无糖尿病的症状,空腹血糖≥6.0 mmol/L,餐后2 h血糖≥7.8 mmol/L,同时患者进行75 g 葡萄糖口服糖耐量的试验,2 h血糖≥11.1 mmol/L,即可准确诊断。研究中缺乏餐后2 h血糖资料和OGTT试验资料,在收集临床资料中以FPG异常为依据判定PTDM,或FPG正常但正在使用胰岛素或口服降糖药物者。
1.2.3 免疫抑制剂治疗方案 选用目前国内外最常用的以钙调神经素抑制剂(CNI)为基础的三联免疫抑制方案,即环孢素A(cyclocporin A,CsA)或他克莫司(FK506)+辅助药物之一,如硫唑嘌呤(AZA)、霉酚酸酯或骁悉 (MMF)+糖皮质激素。

2 结果
2.1PTDM患病情况共收集病例122例,排除6例,116例受者列入本研究。其中男性97例,女性19例,平均年龄(43.23±13.16)岁。116例术前无糖尿病患者,至随访终点(2014年7月),平均随访(5.75±3.67) a。按照诊断标准,有16例(13.8%)发生PTDM(PTDM组),均为术后1 a内新发PTDM。未发生PTDM100例为N-PTDM组。
2.2PTDM危险因素的单因素分析
2.2.1 人口学基础资料 PTDM组术前平均年龄为(51.15±8.23)岁,较N-PTDM组年龄(42.12±13.05)岁要更大,差异有统计学意义(P<0.05)。PTDM组男性所占比例(93.75%)与N-PTDM组(84.00%)比较差异无统计学意义(P>0.05)。PTDM组术前体质指数(BMI)为(28.21±5.16)kg/m2,N-PTDM为(22.84±3.55 )kg/m2,差异有统计学意义(P<0.01)。两组术前有吸烟史(12.50% vs 17.00%)、一级亲属糖尿病家族史(18.75% vs 21.00%)比较,差异无统计学意义(P>0.05)。因此性别、吸烟史、糖尿病家族史等因素不是PTDM发生的危险因素,见表1。
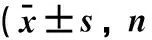
表1 PTDM组与N-PTDM组临床特点比较(%)]
注:与PTDM组相比,*P<0.05,**P<0.01。
2.2.2 两组术前各危险因素比较 PTDM组HCV感染率高于N-PTDM组,差异有统计学意义(P<0.05),而两组HBV、CMV感染率差异无统计学意义(P>0.05);PTDM组与N-PTDM组的术前空腹血糖受损率(FPG)(18.75%vs11.00%)、术前总胆固醇(TC)异常率(6.70%vs12.00%)相比,差异均无统计学意义(P>0.05)。两组术前甘油三酯(TG)异常率相比,PTDM组的异常率为56.26%,高于N-PTDM组患者的17.00%,差异有统计学意义(P<0.05)。
2.2.3 两组术后各危险因素比较 免疫抑制剂方案环孢A或他克莫司+霉酚酸酯+强的松(CsA或FK506+MMF+Pred)的选择中,PTDM组有8例使用CsA,8例使用FK506;N-PTDM组有63例使用CsA,37例使用FK506,两组使用环孢素A或FK506为基础方案所占的比例差异无统计学意义(P>0.05)。两组术后使用CsA+MMF+Pred者71例 (PTDM组8例,N-PTDM组63例),PTDM患病率为11.27%;术后使用FK506+MMF+Pred者45例 (PTDM组8例,N-PTDM组37例),PTDM患病率为17.78%;FK506与CsA对PTDM的影响差异有统计学意义(P<0.05)。两组急性排斥反应发生率分别为43.75%、18.00%,差异具有统计学意义(P<0.01),见表2、3。
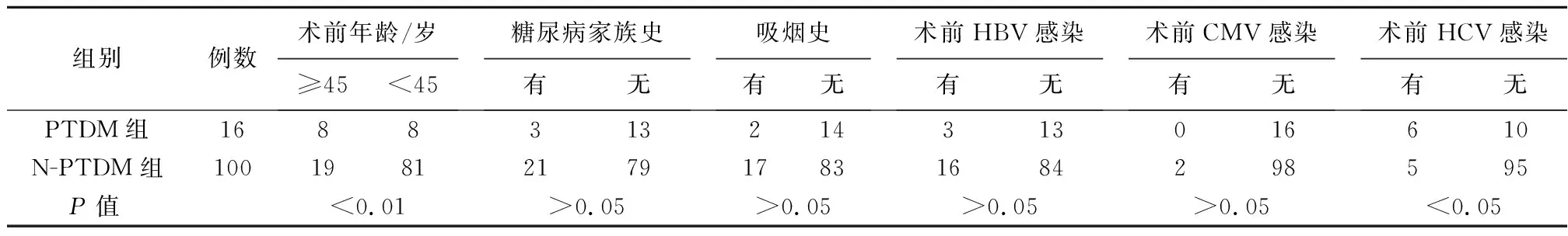
表2 PTDM危险因素的单因素分析
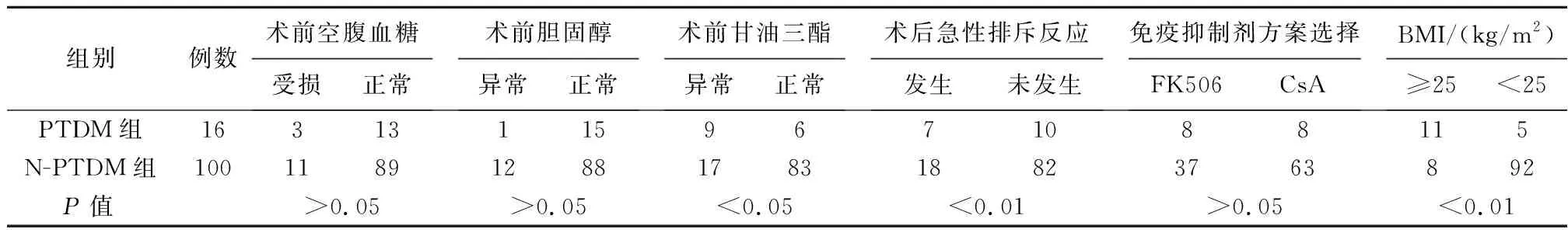
表3 PTDM危险因素的单因素分析
3 讨论
3.1PTDM患病情况Montori等[3]报道PTDM的患病率为2%~50%。这和采用的PTDM诊断标准不统一、选择研究对象标准不同、免疫抑制方案使用不同及术后随访的时间不同有一定关系。PTDM的发生与多种因素相关。Pham等[4]的meta分析中指出,与PTDM发生明确有关的不可调节的危险因素中有种族和尸体移植。鉴于地域特点,本研究选取的研究对象为少数民族活体肾移植受者,均衡了种族、民族和尸体移植等不可变危险因素,这些对PTDM患病率的调查结果有一定影响,今后可以开展相关配对研究。国内,中山大学第一附属医院近期对887例肾移植患者进行的回顾性研究显示,术后3个月及1 a、3 a的PTDM累积患病率分别为10.4%、11.4%、13.4%[5]。本研究结果中PTDM集中发生在1 a内的3个月,患病率为13.8%,与文献[5]报道的结果相似。随着术后存活时间的延长,肾移植术后糖尿病的发病率呈现逐年增加趋势。PTDM的发生给KTR自身和社会都会带来巨大的经济和医疗负担,患者所付出健康的代价也是用金钱无法衡量的。
3.2PTDM危险因素
3.2.1 可调节危险因素 术前体质指数(BMI)偏大、甘油三酯异常、术后急性排斥反应的发生、CSA和FK506的应用均为PTDM的可调性危险因素,都可能促使PTDM的发生和发展。因此需要及时对可调性危险因素进行干预,对移植前后的KTR进行管理和治疗,从而减少患者发生PTDM及其并发症的风险。本研究PTDM集中发生在移植术后3个月,这主要与肾移植后第1年使用免疫抑制剂和糖皮质激素剂量相对较大有一定关系。环孢素A与FK506均同属CNI,作用和机制也很相似。有动物和临床研究已经证实了环孢素A对胰岛β细胞有毒性作用,虽然可显著降低AR发生率,但PTDM的发生率并未随之降低[6]。联合用药能最大限度地抑制排斥反应,并尽可能减少药物的不良反应,做到优势互补。有研究提示PTDM的发生与环孢素A浓度呈正相关,建议将环孢素A的峰浓度调至指南推荐的治疗窗内,可显著降低PTDM发生率[7]。应用FK506后PTDM发生率是环孢素A的1.6倍,且具有剂量依赖效应,同时环孢素A转换为FK506是PTDM的危险因素,提示FK506是PTDM发生的危险因素[8]。因此还需要对CsA和FK506的血药浓度与PTDM的发生关系做进一步研究。需要特别指出的是,BMI作为PTDM的危险因素,对肾移植患者体质量的控制须引起足够重视。
3.2.2 不可调节危险因素 术前年龄、HCV感染等是PTDM的不可调性危险因素。本研究通过选取对象,排除了种族、民族的危险因素。本研究显示,术前年龄≥45岁的PTDM发生率较高,是PTDM重要的危险因素。
3.2.3 其他 有相关报道尸体供肾受者PTDM发病风险更高[9]。本研究均为活体供肾受者,其使用免疫抑制剂的用量往往较尸体供肾受者的低。以空腹血糖作为PTDM的诊断筛查将会漏诊大量负荷后高血糖的患者,OGTT应是肾移植术后糖代谢评估更为精确的指标[10]。本研究对于术前基础疾病、术前血压水平等因素未进行证实。
本研究提示,在少数民族活体肾移植患者中PTDM有较高的发生率,同时存在众多可调节和不可调节的危险因素,这为临床防治PTDM提供了新的依据。术前对患者进行相关危险因素的筛查,包括完整详细的病史、体格检查、FPG、血脂、病毒标志物的检测,如果能进一步接受OGTT试验则是更完善的;肾移植术后,需要对高危患者尽可能给予个体化治疗,采用糖代谢影响较小的免疫抑制剂使用方案。肾移植后糖代谢异常不容忽视,需要内分泌、肾移植、健康管理等学科的共同努力,积极地对PTDM进行早期预防、早期诊断、早期治疗,改善KTR的生活质量,延长其生命。
参考文献:
[1] 王育璠,彭永德.肾移植后糖尿病的研究进展[J].国际内分泌代谢杂志,2008,28(5):351-357.
[2] 陈敏灵,于明香.肾移植术后空腹血糖、血脂变化规律与影响因素分析[D].上海:复旦大学,2010.
[3] Montori VM,Velosa JA,Basu A,et al. Posttransplantation diabetes: Asystematic review of the literature[J].Diabetes Care,2002,25: 583-592.
[4] Pham PT,Pham PM,Pham SV. et al.New onset diabetes after transplantation(NODAT):an overview[J].Diabetes Metab Syndr Obes,2011,175-186.
[5] Xu Y,Liang JX,Liu B,et al.Prevalence and long-term glucose metabolism evolution of post.transplant diabetes mellitus in Chinese renal recipients[J].Diabetes Res Clin Pract,2011,92:11-18.
[6] 陈敏灵,张尧,于明香,等. 肾移植术后糖尿病的发病及其危险因素分析[J].中华内分泌代谢杂志,2013,29(9):750-754.
[7] Mathew JT,Rao M,Job V,et al.Post-transplant hyperglycaemia:a study of risk factorsp[J].Nephrol Dial Transplant,2003,18:164-171.
[8] Gnatta D,Keitel E,Heineck I,et al.Use of tacrolimus and the development of post-transplant diabetes mellitus:a Brazilian single-center,observational study[J].Transplant Proc,2010,42:475-478.
[9] Hamer RA,Chow CL,Ong AC,et al.Polycystic kidney disease is a risk factor for new-onset diabetes after transplantation[J].Transplantation,2007,83(1):36-40.
[10] 陈雄. 肾移植术后糖尿病流行病学调查及其与维生素D受体基因多态性关系研究[D].广州:中山大学,2007.
