一株植物乳杆菌高密度培养的研究
2014-07-13闫天文满朝新刘泳麟柴云雷任欢庞心怡赵玥明姜毓君
闫天文,满朝新,刘泳麟,柴云雷,任欢,庞心怡,赵玥明,姜毓君,
(东北农业大学 a.食品学院;b.国家乳业工程技术研究中心,哈尔滨150030)
0 引 言
随着人们生活水平的提高,益生菌食品的消费量逐年上升,益生菌添加到食品中的主要方式是直接添加菌体或以益生菌制剂的方式添加。益生菌制剂制备的关键技术对乳酸菌进行高密度培养[1-2]。限制乳酸菌高密度培养的主要因素是底物消耗和酸的积累。国外一些研究者对限制乳酸菌高密度培养的底物、缓冲盐、生长因子等做了大量研究[3-6]。植物乳杆菌属于乳酸杆菌属,有很强的发酵碳水化合物的能力,耐胆盐,免疫调节,拮抗致病菌和抗突变等益生性质[7]。本研究采用的植物乳杆菌NDC 75017分离自内蒙古传统发酵乳制品中,具有许多益生功能[8-11]。实验对影响菌体生长的营养条件和环境条件进行了研究,提高了菌体活菌数和生物量,为乳酸菌发酵剂的制备奠定了基础。
1 实 验
1.1 材料与试剂
植物乳杆菌NDC 75017分离自内蒙古通辽地区传统发酵乳制品中。
MRS液体培养基:蛋白胨5 g,牛肉膏5 g,酵母粉5 g,胰蛋白胨10 g,Tween-80 1 mL,葡萄糖20 g,磷酸氢二钾 2 g,柠檬酸氢二铵2 g,乙酸钠5 g,硫酸镁0.5 g,硫酸锰 0.25 g,蒸馏水定容至1 000 mL,调pH值至5.8。121℃灭菌15 min,用于菌体的活化。
MRS固体培养基:MRS液体培养基添加2%的琼脂,121℃灭菌15 min,用于菌体计数。
增殖培养基:按照实验设计配方配制,121℃灭菌15 min,用于菌体增殖培养。
1.2 主要仪器与设备
BCN1360型生物洁净工作台,GL-21M高速冷冻离心机,灭菌锅,DHP-9082型电热恒温培养箱,精密天平与精密pH计,紫外分光光度计DU800。
1.3 方法
1.3.1 菌株的活化
从-80℃取出菌株复苏纯化,按2%的接种量接种至MRS液体培养基中,30℃活化培养两代。
1.3.2 碳源、氮源、缓冲盐、生长因子及培养条件的筛选
将活化好的种子液按2%的比例分别接种至不同种类的碳源、氮源、缓冲盐及不同的培养条件下(不同温度、pH值)的培养基中。
1.3.3 活菌计数
每隔2 h取样,将发酵液进行10倍梯度稀释,取10-7~10-9三个梯度进行平板涂布,30℃培养48 h计数。
1.3.4 菌体密度的测定
每隔2 h取样,发酵液的菌体密度用紫外分光光度计在波长600 nm下测定。如果菌液过浓则稀释一定倍数使光密度在0.2~1.2之间,菌体密度值为测定值乘以稀释倍数[12]。
1.3.5 菌体干重的测定
每隔2 h取样,发酵液在4 000 r/min条件下离心10 mim。将得到的菌泥用质量分数为0.85%的生理盐水洗涤三遍,70℃烘箱烘干至恒重[12]。
1.3.6 pH值的测定
每隔2 h取样,用精密pH计测定不同发酵时间点的pH值。
1.3.7 葡萄糖质量浓度的测定
采用葡萄糖测定试剂盒 (葡萄糖氧化酶-过氧化氢酶法,上海荣盛生物药业),每隔2 h取样测定菌体在生长过程中葡萄糖质量浓度的变化。
1.4 实验设计
1.4.1 Plackett-Burman实验设计
根据单因素实验筛选得到的对植物乳杆菌NDC 75017生长有显著影响的因素:葡萄糖、牛肉膏、酵母粉、胰蛋白胨、柠檬酸氢二铵、乙酸铵、乙酸钠、Tween 80、硫酸镁和硫酸锰10个因素进行实验设计。每个实验因素取2个水平,高水平(+1)为低水平(-1)的1.5倍,以植物乳杆菌的菌体浓度为响应值[13]。
1.4.2 最陡爬坡实验设计
根据Plackett-Burman实验设计筛选得到的影响菌体浓度的显著影响因素确定最陡爬坡试验的方向和梯度,确定试验因素的中心点。
1.4.3 Box-Behnken Design实验设计
根据1.4.1和1.4.2确定的试验因素和中心点,采用Design-Expert软件进行3因素3水平的响应面设计,将得到的试验数据进行二次多项回归拟合,得到一个响应变量与自变量之间的模型。根据建立的模型计算得到植物乳杆菌NDC 75017最佳增殖培养基配方。
1.4.4 验证试验
将活化好的种子液按2%的比例分别接种至普通MRS培养基和1.4.3响应面设计的增值培养基中,30℃ 静置培养。每隔2 h取样测定发酵液的活菌数及干重。
1.5 统计分析
实验过程每组实验做3个平行。采用Design Expert 17.0设计软件进行响应面设计分析;采用SPSS 17.0统计软件进行显著性差异分析;数据计算、绘图采用Microsoft Excel 2003软件。
2 结果与分析
2.1 植物乳杆菌NDC 75017的生长曲线
植物乳杆菌NDC 75017的生长曲线如图 1所示。由图1可以看出,菌体生长至12 h时达到稳定期,此时活菌数最高达到6.48×1010mL-1;菌体整个生长过程中,发酵液中的pH值从5.8下降到3.4,葡糖的质量浓度从16.6 g/L下降到1.2 g/L。另外,从图中可以明显看出,当菌体生长到18 h时活菌数迅速下降,可能原因是由于营养物质如碳源的消耗和pH值的下降(主要是菌体代谢葡萄糖产生乳酸造成的)造成菌体活力下降,并出现菌体自溶现象[5]。

图1 植物乳杆菌NDC 75017的生长曲线
2.2 碳源、氮源、缓冲盐、生长因子及培养条的筛选
由图2~图5可以看出,对植物乳杆菌NDC 75017有明显促进作用的碳源为葡萄糖,氮源为酵母粉、牛肉膏和胰蛋白胨,缓冲盐为柠檬酸氢二铵和乙酸铵,生长因子为硫酸锰、硫酸镁和Tween 80。有研究者研究证明复合氮源比单一氮源更有利于乳酸菌的生长。本实验选用酵母粉、牛肉膏和胰蛋白胨为植物乳杆菌NDC75017生长的复合氮源[12]。
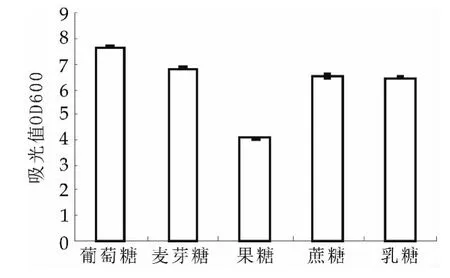
图2 碳源对L.p NDC 75017生长的影响
2.3 Plackett-Burman实验设计
实验设计筛选因素编码及水平如表1和表2所示。由表1和表2可以看出,每个实验设计方案下植物乳杆菌NDC 75017活菌数的变化。表3是根据表2中的实验结果对实验过程选取的每个实验因素效应大小进行分析的结果。
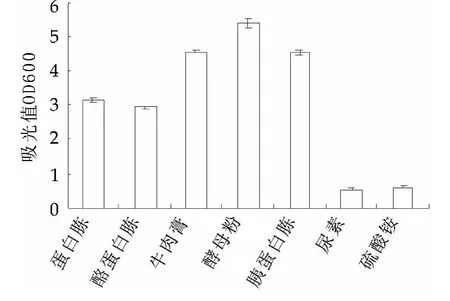
图3 氮源对L.p NDC75017生长的影响

图4 缓冲盐对L.p NDC75017生长的影响

图5 生长因子对L.p NDC 75017生长的影响

表1 Plackett-Burman实验设计筛选各因素及水平
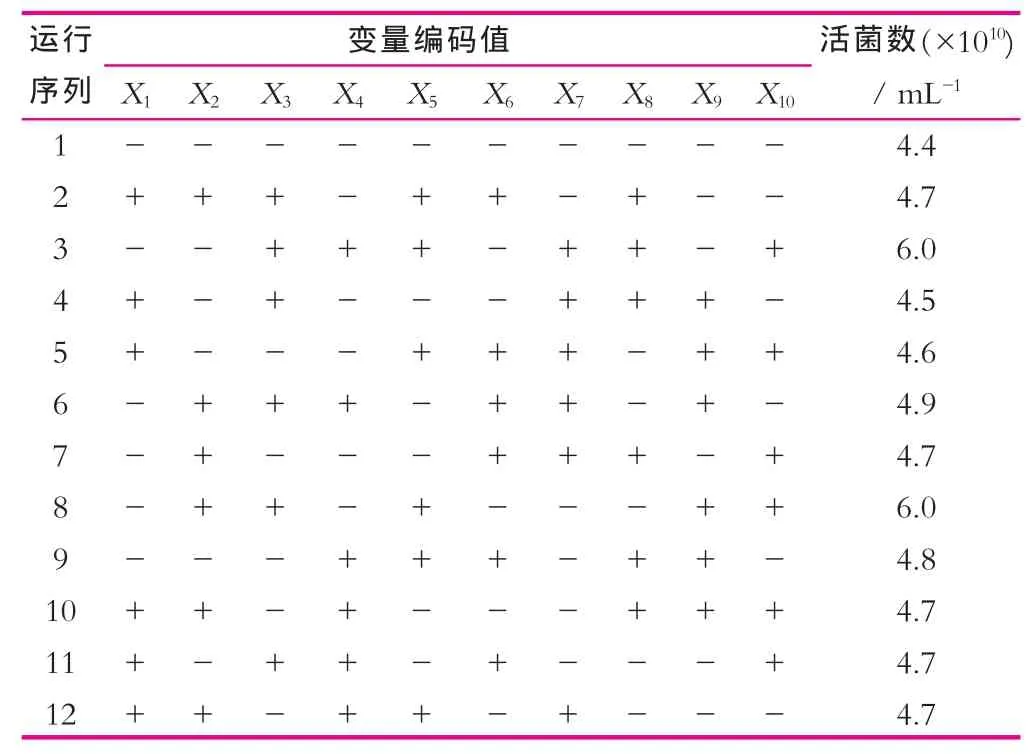
表2 Plackett-Burman实验设计各因素对NDC 75017细胞活菌数的影响

表3 Plackett-Burman实验设计方差分析表
由表3可以看出,X1(葡萄糖)、X6(乙酸铵)2个因素的效应为负,表明因素X1(葡萄糖)、X6(乙酸铵)对菌体浓度的影响为负效应,即随着培养基中葡萄糖、乙酸铵含量的增加,活菌数呈下降趋势;其余因素的效应为正,均为正效应。其中葡萄糖、柠檬酸氢二铵、乙酸铵和硫酸锰的P值均小于0.05,表明这三个因素对活菌数的影响显著。而柠檬酸氢二铵、乙酸铵在菌体生长过程中均起到缓冲盐的作用,为了后续实验设计方便,这里只选取柠檬酸氢二铵作为培养基中的缓冲盐。故采用葡萄糖、柠檬酸氢二铵和硫酸锰这3个因素为主要研究对象做后续研究,利用最陡爬坡实验确定三个因素的最佳浓度范围。
2.4 最陡爬坡实验设计
根据2.3实验结果筛选得到的显著影响因素的效应大小确定最陡爬坡试验的方向和梯度(见表4)并进行实验,根据实验结果确定响应面实验设计因素的中心点。
由表4可以看出,随着葡萄糖质量浓度降低,柠檬酸氢二铵和硫酸锰浓度的升高,活菌数呈现先上升后下降的变化趋势,活菌最高的响应值区域在第四组实验。故响应面设计因素的中心点为葡萄糖15 g/L,柠檬酸氢二铵3.5 g/L,硫酸锰0.4 g/L。

表4 最陡爬坡实验设计及结果
2.5 Box-Behnken Design响应面设计
根据2.3和2.4实验筛选得到的对菌体生长有显著影响的因素葡萄糖、柠檬酸氢二铵、硫酸锰和由最陡爬坡实验确定的试验因素中心点,采用Design Expert 17.0软件进行3因素3水平的响应面设计。表5是以葡萄糖、柠檬酸氢二铵、硫酸锰3个因素为自变量,植物乳杆菌NDC75017活菌数为响应值,设计3因素3水平Box-Behnken实验方案。表6是根据表5设计方案得到的实验结果。响应面设计实验结果如图6所示。

表5 Box-Behnken Design因素

表6 Box-Behnken试验设计及结果
根据表6的实验结果,通过Design-Expert 17.0软件处理确定回归方程:Y=6.65+0.39X1+0.013X2+0.19X3+0.11X1X2-0.100X1X3+0.0073X2X3-0.77X12-0.43X22-0.44X32,
式中:Y为植物乳杆菌NDC 75017菌体浓度的预测响应值;X1为葡萄糖的编码值;X2为柠檬酸氢二铵的编码值;X3为硫酸锰的编码值。回归方程方差分析如表7所示。
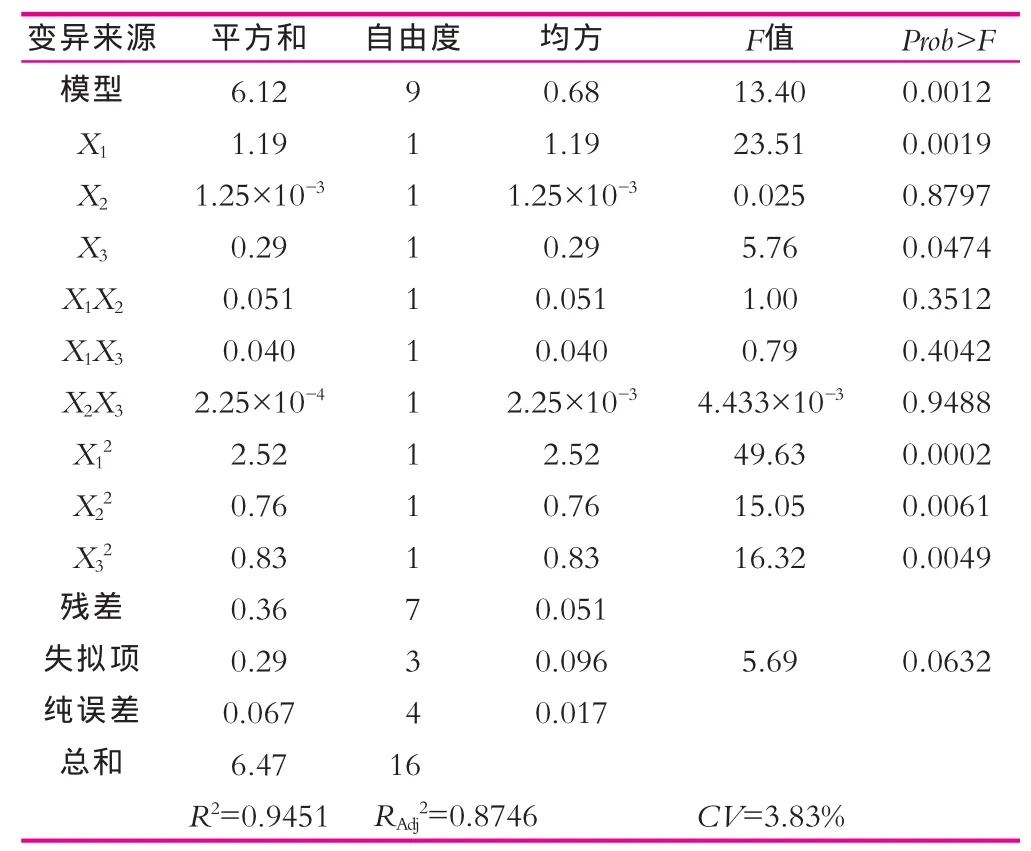
表7 响应面二次方模型方差分析
由表7可以看出,经Design-Expert 17.0软件分析,所建立的模型Prob>F值为0.0012小于0.01表明建立的模型影响极显著;模型失拟项Prob>F为0.0632,大于0.05,即失拟项不显著,说明本试验建立的模型在整个回归区域的拟合度较好,接近真实的响应曲面情况,模型建立合理;CV(变异系数)表示模型的精确度,本研究模型中CV=3.83%,较低,说明模型精确度高,结果可信。模型的决定系数R2=94.51%,矫正系数RAdj2=87.46%,表明预测值与实际值之间具有高度相关性,能解释87.46%的响应值变化,故可以利用此模型代替真实试验点对植物乳杆菌NDC 75017的菌体浓度进行预测。
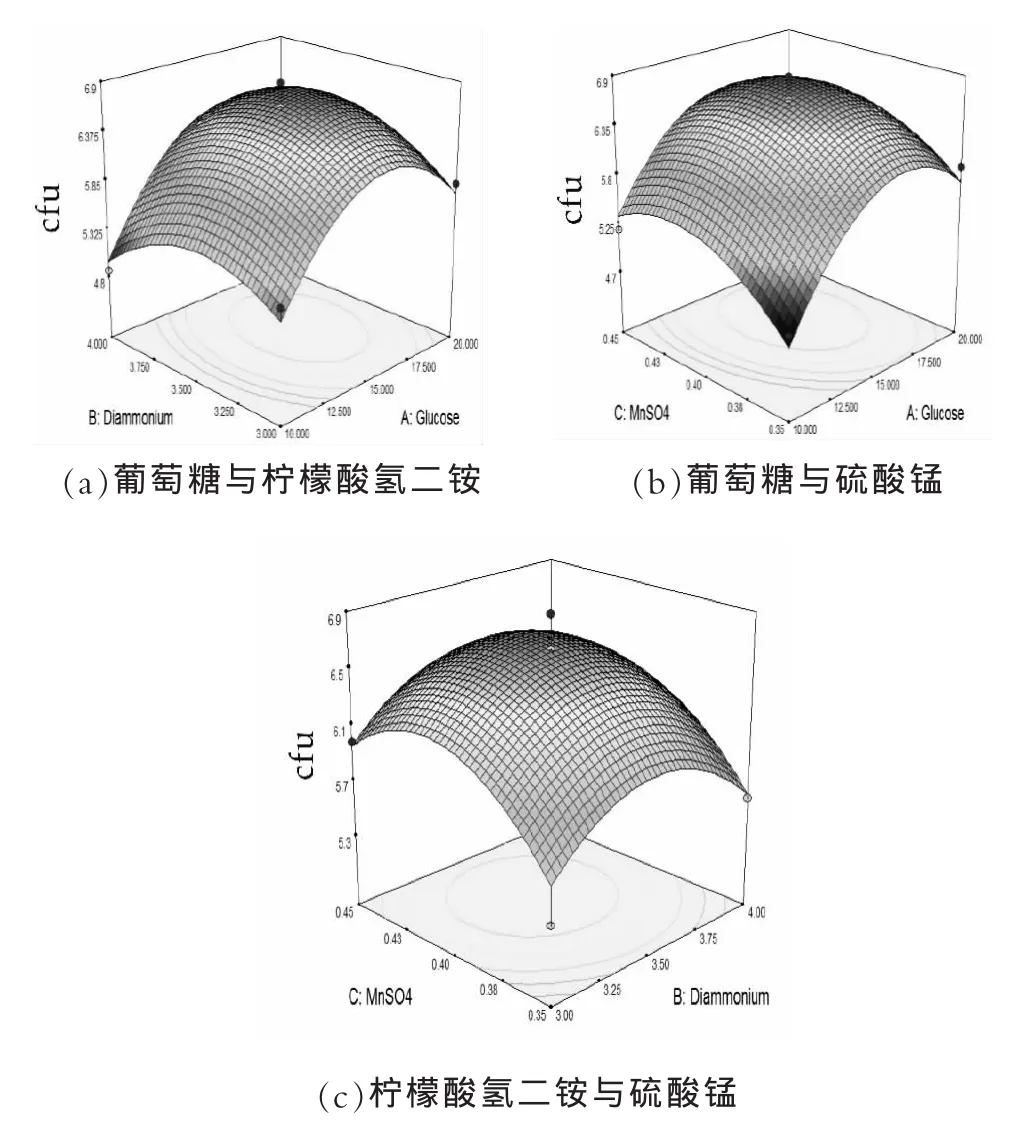
图6 响应面立体图
从响应面分析可知,回归模型存在最大值。根据Design-Expert 17.0软件得到的回归方程可计算得到Y的最大估计值为6.72×1010mL-1,此时葡萄糖16.31 g/L、柠檬酸氢二铵3.52 g/L,硫酸锰0.41 g/L。
2.5 优化条件的验证
图7为优化前后细胞生物量的变化,经优化后细胞干重由原来的3.31 g/L提高到3.93 g/L,细胞干重提高了原来的1.2倍。图8为优化前后细胞活菌数的变化,经优化后,最大活菌数由原来的3.15×1010mL-1提高到6.48×1010mL-1,活菌数提高了2.1倍。且活菌数与响应面预测的最大活菌数6.72×1010mL-1接近。说明回归方程能够真实的反映筛选因素对植物乳杆菌NDC 75017生长的影响,对于培养基的优化研究具有指导意义。

图7 优化前后细胞干重的变化
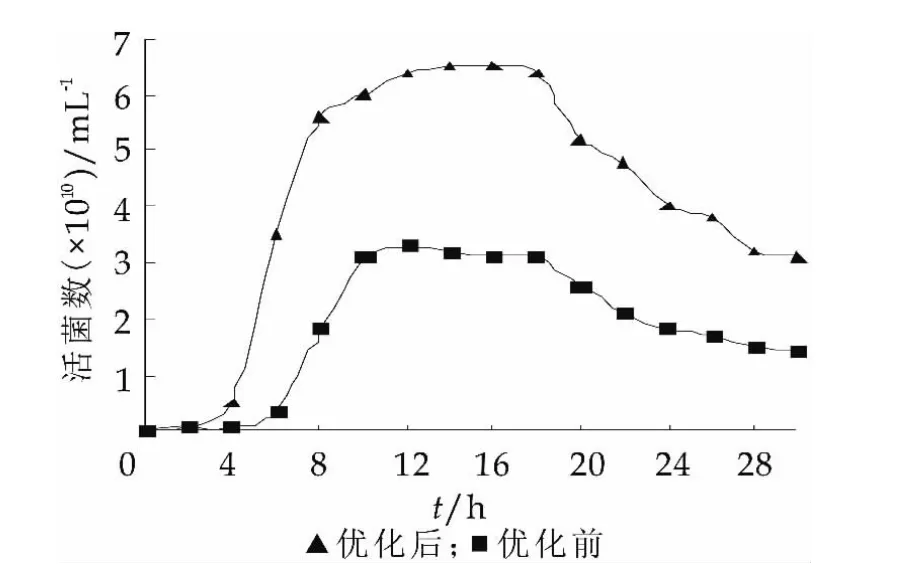
图8 优化前后细胞活菌数的变化
3 结 论
实验通过Plackett-Burman法、最陡爬坡试验和Box-Behnken设计对植物乳杆菌培养基成分进行优化。确定了植物乳杆菌增值的培养基配方为:葡萄糖16.31 g/L,酵母粉7.5 g/L,胰蛋白胨15 g/L,牛肉膏7.5 g/L,柠檬酸氢二铵3.52 g/L,乙酸铵5 g/L,乙酸钠5 g/L,Tween80 1.5 mL/L,硫酸镁0.87 g/L,硫酸锰0.41 g/L。最大活菌数由原来的3.15×1010mL-1提高到6.48×1010mL-1,活菌数提高了2.1倍;细胞干重由原来的3.31 g/L提高到3.93 g/L,细胞干重提高了原来的1.2倍。在增殖培养基的基础上对植物乳杆菌NDC 75017利用发酵罐进行高密度培养并制备高活性乳酸菌发酵剂将是后续研究。
[1]REZA M.The starter culture characteristics of probiotic microorganismsin fermented milks[J].Wiley-VCH Verlag GmbH.2012,12:1-11.
[2]ATHANASIOS A K,HARRIS P.Whey valorisation:A complete and novel technology development for dairy industry starter culture production[J].Bioresource Technology,2009,100:3734-3739.
[3]CHRISTOPHE L,SELCUK Y.Fermentation technologies for the production of probiotics with viability and functionality [J].Current Opinion in Biotechnology,2007,18:176-183.
[4]WICHITTRA B,KENJI S.Single step lactic acid production from cassava starch by lactobacillus plantarum SW14 in conventional continuous and continuous with high cell density [J].APCBEE Procadia,2012(2):97-103.
[5]XIONG T,HUANG X H.High-density cultivation of Lactobacillus plantarum NCU116 in an ammonium and glucose fed-batch system[J].African Journal of Biotechnology,2011,10(38):7518-7525.
[6]RIESENBERG D,GUTHKE R.High-cell-density cultivation of microorganisms[J].Appl Microbiol Biotechnol,,1999,51:422-430.
[7]郭本恒,益生菌 [M].北京:化学工业出版社,2004:415-422.
[8]YAN T,MAN C,SHAN Y,et al.Production and sensory evaluation of high γ-aminobutyric acid-enriched fermented milk by lactobacillus plantarum[J].Journal of Dairy Science,2013:96(suppl.1):310-311.
[9]姜毓君,单艺,满朝新,等.一种具有高产γ-氨基丁酸能力的菌株[P].专利申请号:201110439694.5.
[10]王今雨,满朝新,杨相宜,等.植物乳杆菌NDC75017降胆固醇作用的研究[J].食品科学,2013,34(3):243-247.
[11]刘颖,满朝新,吕学娜,等.植物乳杆菌NDC75017作用Caco-2细胞后对IL6表达的影响[J].微生物学报,2012,52(10):1237-1243.
[12]VINODH A E,MELANIE H.Biomass production and small-scale testing of freeze-dried Lactic acid bacteria starter strains for cassava fermentations[J].Food Control,2011,22:389-395.
[13]NADIA A S,MAHMOUD M B.Polyglutamic acid(PGA)production by Bacillussp.SAB-26:application of Plackett-Burman experimental design to evaluate culture requirements[J].Biotechnological products and process engineering,2005,69:259-267.
