乳铁蛋白热稳定性研究
2014-07-13闫序东王彩云云战友
闫序东,王彩云,云战友
(内蒙古伊利实业集团股份有限公司技术中心,呼和浩特010110)
0 引 言
乳铁蛋白(LF)对热敏感,容易变性失活。关于乳铁蛋白的热稳定性,已有一些研究报道。HIROAKI等[1]研究了在酸性条件下牛乳铁蛋白的热稳定性,发现脱铁乳铁蛋白在酸性条件下非常稳定。CELIA等[2]研究了热对LF抑菌活性的影响,发现85℃保温10 min的热处理强度未降低LF的抑菌活性。LUIS等[3]研究发现72℃保温20 s或135℃保温8 s的热处理条件几乎不影响LF的铁结合能力,然而两种温度下更长的时间则会降低铁结合能力。MARIE等[4]研究了不同铁饱和度的LF在巴杀和UHT后的结构和抑菌活性变化,发现UHT造成LF的完全变性和抑菌性丧失,而巴杀对LF的抑菌活性没有影响。
通过文献报道可知,乳铁蛋白对热敏感,在其生产及应用过程中应注意保护其活性,以免失去功效。但以往的研究结果存在一些分歧甚至矛盾,因此有必要研究LF在乳制品加工常用热处理条件下的热稳定性,评价LF在实际加工过程中的结构和生物活性变化。
1 实 验
1.1 材料与设备
乳铁蛋白,E.coli K99,ANS试剂,DTNB; 磷酸二氢钠、SDS、丙烯酰胺等均为国产分析纯试剂。
UHT设备,水浴恒温振荡器,荧光分光光度计,电泳仪,TV-1810紫外-可见分光光度计。
1.2 方法
1.2.1 热处理
以蒸馏水溶解乳铁蛋白,配制为40 g/L(质量浓度)的乳铁蛋白溶液,进行不同强度的热处理,热处理条件分别为:63 ℃/30 min,72 ℃/15 s,85 ℃/15 s,85℃/10 min,95 ℃/5 min和 138 ℃/4 s,138 ℃/4 s的受热条件以UHT设备处理,其他受热条件在水浴锅中处理。热处理后将乳铁蛋白溶液冷冻备用。
1.2.2 浓度测定
采用还原SDS-PAGE和非还原SDS-PAGE分别测定热处理前后的乳铁蛋白质量浓度变化。非还原SDS-PAGE与还原SDS-PAGE相比未加β-巯基乙醇。分离胶质量分数15%,浓缩胶质量分数5%,上样量3.3 μg,恒压120V。
1.2.3 表面疏水性测定
ANS方法[5],以0.01 mol/L,pH 7.0的磷酸盐缓冲溶液将乳铁蛋白配制成0.01~0.4 mg/mL的浓度,取不同浓度的蛋白溶液3 mL,加入40 μL的ANS溶液(以浓度为0.1 mol/L pH 7.0的磷酸盐缓冲溶液配制的浓度为8 mmol/L的ANS溶液),以荧光分光光度计在380 nm激发波长、480 nm发射波长,狭缝均为5 nm的条件下测定荧光值,以荧光值对蛋白质浓度做出曲线并外推至蛋白浓度为0,曲线初始部分的斜率即为蛋白质分子的表面疏水性指数。
1.2.4 游离巯基测定
参考BEVERIDGE的方法[6],将LF蛋白样品进行适度稀释,取稀释样品1 mL加入2.0 mL Tris-甘氨酸缓冲溶液(pH8.0)和0.02 mL的Ellman试剂(采用Tris一甘氨酸缓冲溶液(pH8.0)配制的浓度为4 g/L DTNB,25℃保温5 min,412 nm下测定吸光度值。以不加样品,而加Ellman试剂为空白,以不加Ellman试剂,而加样品溶液测其混浊度,巯基量的计算:
-SH(μmol/g)=(75.53×A412×D)/C,
式中:A412=加DTNB时样品的吸光度-不加DTNB时样品的吸光度;D为稀释倍数;C为样品固形物质量分数。
1.2.5 铁结合能力测定
参考卢蓉蓉方法[7],配制质量分数为2%的LF溶液,取0.9 mL此溶液,与0.1 mL新鲜配制浓度为0.1 mol/L的NaHCO3溶液混合,并与1.0 mL浓度为0.6 mmol/L的Fe(NH4)2(SO4)2·6H2O的(含0.01 mol/L的HCl)溶液混合。在25℃下反应10 min,于465 nm处测定吸光值A。因为质量分数为1%铁饱和的LF(Fe-LF)的A465为0.57,因此铁结合能力=A/0.57×100%。
1.2.6 抑菌性测定
将E.coli K99活化两代,第一代活化16 h,第二代活化1 h,再稀释10倍备用。将热处理后的40 mg/mL乳铁蛋白溶液融化进行测试,8.5 mL缓冲蛋白胨水中加入0.5 mL乳铁蛋白溶液和1 mL菌液,于37℃,65 r/min水浴振荡摇床中培养,每2 h测定一次600 nm下的OD值,培养至第24 h时进行平板计数。
2 结果与讨论
2.1 浓度
热处理前后LF的还原和非还原电泳结果如图1所示。
由图1可以看出,非还原电泳可以很好的反映乳铁蛋白受热损失的情况。63℃(30 min)的热处理后,LF形成了少量的聚集体,这种聚集体不能进入分离胶,但可以进入浓缩胶。72℃(15 s)的热处理条带与未热处理的LF几乎相同,这种热处理条件对LF造成的损害是最小的。85℃(15 s)热处理后LF也形成了少量不能进入分离胶的聚集体,但聚集体的数量少于63℃(30 min)的。 而85 ℃(10 min)和95 ℃(5 min)热处理后,LF除形成了不能进入分离胶的聚集体外,还形成了更大的不能进入浓缩胶的聚集体,95℃(5 min)对LF造成的损失明显高于85℃(10 min)。UHT后LF几乎全部形成了很大的聚集体,这种聚集体全部不能进入浓缩胶,而且形成这种聚集体的作用不能被β-巯基乙醇所破坏,因此还原电泳图中UHT条带与非还原电泳中相似。UHT外的其他热处理形成的LF聚集物都能被β-巯基乙醇还原为单体蛋白。

图1 热处理前后LF的SDS-PAGE
2.2 表面疏水性
热处理前后LF的表面疏水性如图2所示。

图2 热处理前后LF的表面疏水性
蛋白质的表面疏水性对于蛋白质的溶解性、乳化起泡能力具有十分重要的作用。由图2可以看出,热处理对于LF的表面疏水性影响很大,热处理有助于LF表面疏水性的增大,说明热处理后LF结构发生变化使更多原本折叠埋藏在分子内部的疏水区域暴露到分子表面。
2.3 游离巯基
热处理前后LF的游离巯基数量如图3所示。

图3 热处理前后LF的游离巯基数量
天然未变性的LF分子内有17个二硫键,但没有游离的巯基。由图3可以看出,85℃(10 min)的热处理后LF游离巯基数量略有上升,95℃(5 min)和UHT后,游离巯基数量增加很多,其他热处理条件下,LF的游离巯基数量与未加热前近似。这表明比较强烈的热处理打断了LF分子内的二硫键从而释放出游离的巯基,因为二硫键对于维持蛋白质的二级和三级结构非常重要,因此可以判断二硫键的破坏必然伴随着LF分子结构的巨大改变。
2.4 铁结合能力
热处理前后LF的铁结合能力如图4所示。
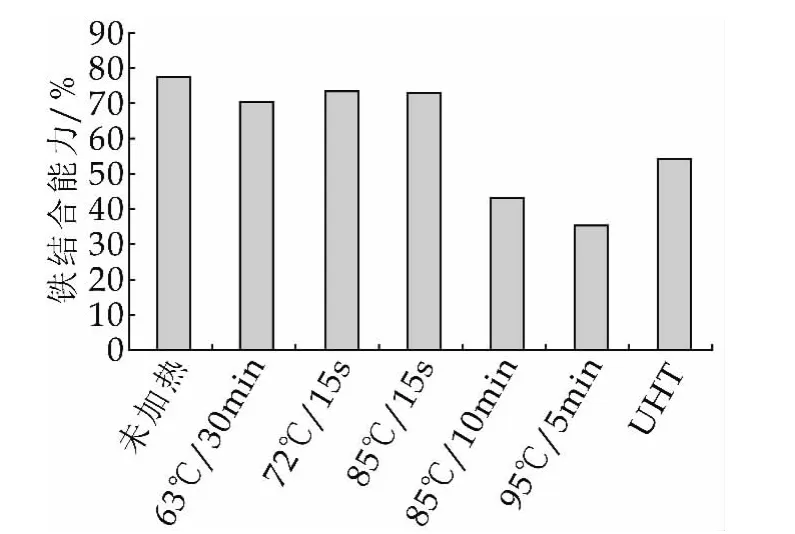
图4 热处理前后LF的铁结合能力
由图4可以看出,温度85 ℃(10 min)、95 ℃(5 min)和UHT处理后,LF的铁结合能力受到明显损害,其他热处理条件下铁结合能力下降不大。图4中显示的UHT处理后铁结合能力反而高于95℃(5 min)是因为UHT处理后LF溶液浑浊度增加很多,因此对于铁结合能力的检测结果干扰较大。
2.5 抑菌性
热处理前后LF对大肠杆菌K99抑制作用的OD曲线如图5所示,平板计数得到抑菌率如图6所示。
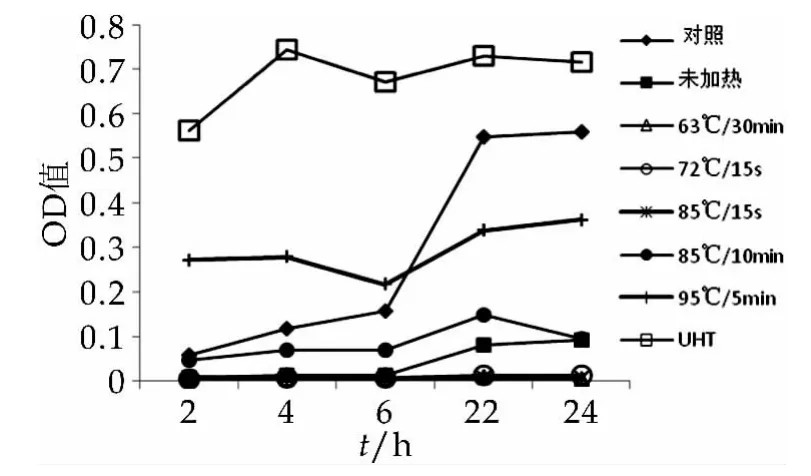
图5 热处理前后LF对大肠杆菌K99抑制作用的OD曲线
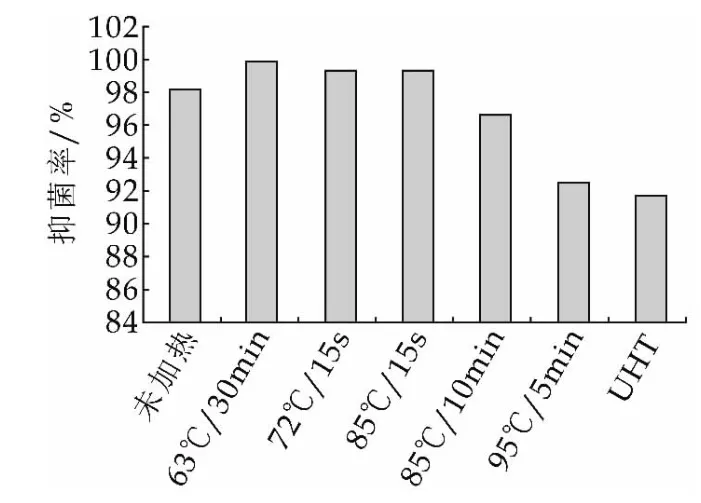
图6 热处理前后LF对大肠杆菌K99抑制作用的24 h抑菌率
由图5和图6可以看出,常规的乳制品巴杀操作对乳铁蛋白抑菌活性的影响不大,而85℃(10 min)及更强的热处理强度会降低乳铁蛋白的抑菌活性。
3 结束语
乳铁蛋白是热敏性物质,乳制品加工中的各种常规热处理都会或多或少造成乳铁蛋白结构或生物活性的改变,乳铁蛋白所遭受的热处理强度越高,则变性和失活的程度也越高。特别是乳铁蛋白在遭受UHT等强热处理后,其特征电泳条带损失很大,自由巯基和表面疏水性变化也指示乳铁蛋白结构发生了显著改变,同时铁结合能力和抑菌活性这两大乳铁蛋白主要的生物活性也降低很多。但巴氏杀菌对乳铁蛋白结构及生物活性的影响较小。因此在乳铁蛋白生产和应用过程中,应该尽量减少乳铁蛋白受到强度较高的热处理,以保证乳铁蛋白的优良生物活性得到较好保留。
[1]HIROAKI A,HITOSHI S,HIROSHI M,et al.Heat Stability of Bovine Lactoferrin at Acidic pH[J].J.Dairy Sci.,1991,74(1):65-71.
[2]CELIA C,CARMEN R,EDUARDO C,et al.Effect of Heat Treatment on the Antibacterial Activity of Bovine Lactoferrin Against Three Food Borne Pathogens[J].International Journal of Dairy Technology,2010,63(2):209-215.
[3]LUIS M,LOURDES S,DENIS R H,et al.Thermal Denaturation of Human Lactoferrin and Its Effect on the Ability To Bind Iron[J].J.A-gric.Food Chem,1998,46:3964-3970.
[4]MARIE A P,ULLA S,ALUGUPALU R K,et al.Thermal Behavior of Bovine Lactoferrin in Water and Its Relation to Bacterial Interaction and Antibacterial Activity[J].J.Dairy Sci.,1993,76:3711-3720.
[5]AKIO K,SHURYO N.Hydrophobicity Determined by a Fluorescence Probe Method and Its Correlation with Surface Properties of Proteins[J].Biochimica et Biophysica Acta,1980,624:13-20.
[6]BEVERIDGE T,TOMA S J,NAKAI S.Determination of SH-And SS-groups in Some Food Proteins Using Ellman’s Reagent[J].Journal of Food Science,1974,39:49-51.
[7]卢蓉蓉.乳铁蛋白的分离、纯化及其生物活性功能[D].无锡:江南大学,2003.
