肾移植受者使用不同剂量依维莫司联合钙调磷酸酶抑制剂的临床疗效及安全性荟萃分析
2014-07-07毛棉蒋刚蒋学华
毛棉 蒋刚 蒋学华
肾移植是终末期肾病的标准治疗方案,为受者带来较透析治疗更好的生存质量、更高的生存率和更低的治疗费用[1-2]。肾移植受者需要终身服用免疫抑制剂,临床推荐的维持治疗方案需联合使用钙调磷酸抑制剂(calcineurin inhibitor,CNI)和抗增殖药物,包含(或不包含)糖皮质激素。但是,含CNI的免疫抑制方案会导致肾损害、糖尿病、高血压、血脂异常、胃肠道反应以及痤疮等不良反应,特别是慢性移植肾肾病可能导致移植肾失功或移植失败[3]。依维莫司是一种雷帕霉素靶蛋白抑制剂,能预防器官移植后的排斥反应,特别是可以预防有轻至中度排斥反应风险的成年肾移植受者出现排斥反应。与CNI 肾毒性不同,依维莫司具有肾脏保护的优势[4]。因此,依维莫司联合CNI 的免疫抑制方案,可以降低免疫抑制剂的用量,从而达到低肾毒性并减轻患者经济负担。目前,尚无肾移植术后不同浓度依维莫司联合CNI 对于免疫抑制的有效性和安全性的评价。本文采用循证医学的方法进行系统评价,以期为临床合理、安全使用依维莫司联合CNI 提供循证依据。
1 资料和方法
1.1 文献纳入及排除标准
(1)纳入标准:①临床随机对照试验(randomized controlled trial,RCT),语种限定为英文和中文;②试验对象为肾移植受者;③采用不同剂量依维莫司联合CNI 或其他药物的免疫抑制方案。
(2)排除标准:①试验设计非RCT;②涉及其他器官联合移植的受者;③胃肠道功能障碍影响药物吸收的受者;④移植术前5 年有恶性肿瘤史的受者;⑤孕妇及儿童受者;⑥数据不完整。
1.2 文献检索与数据提取
计算机检索Cochrane 图书馆、EMBASE、SCI、PubMed、中国生物医学文献数据库、中国期刊全文数据库、维普数据库和万方数据库。检索方式采用MeSH 主题词与自由词联合搜索,中文检索词为依维莫司、肾移植、随检对照试验,英文检索词为everolimus,renal transplantation,randomized controlled trial,检索时间为建库至2014 年1 月。对于同一RCT 的不同随访时间报道均纳入本研究。
1.3 质量评价
根据Cochrane 系统评价手册对纳入文献进行方法学评价。评价内容包括:分配方案隐藏、随机序列产生、盲法、结果数据的完整性、选择性报道研究结果和其他偏倚。对每项评价条目根据偏倚度大小进行标记,分别为低风险、未知风险和高风险。
1.4 考察疗效指标及安全性指标
疗效指标包括活检证实的急性排斥反应、移植物失功、受者死亡情况、肌酐清除率以及血清肌酐水平。安全性指标包括治疗中断率、贫血、白细胞减少、血小板减少、感染、腹泻、便秘、糖尿病、高胆固醇血症、高甘油三酯血症、外周水肿、高血压以及肿瘤的发生情况。
1.5 统计学方法
采用RevMan 5.0 软件进行荟萃分析。通过χ2检验法进行异质性检验,若P≤0.10,采用随机效应模型;若P >0.10,采用固定效应模型。同时观察I2,若I2>0,无论P 值大小,均需采用2 种效应模型进行效应量合并。对分类变量采用相对危险度(relative risk,RR)及95%CI表示合并效应量,连续变量采用加权均数差(mean difference,MD)及95%CI 表示合并效应量,必要时进行敏感性分析。P <0.05 为差异具有统计学意义。
2 结 果
2.1 检索结果
根据检索策略,共检索到857 篇文献,初步纳入47 篇。进一步阅读全文后,最终纳入7 项RCT 共7 篇报道[5-11],包含受者1 932 例受者,见表1。根据依维莫司使用剂量的区别,分为低剂量和高剂量依维莫司组。7 项RCT 的质量评价见表2。
2.2 疗效指标的荟萃分析结果
2.2.1 活检证实的急性排斥反应
纳入的7 项RCT 均报道了不同剂量依维莫司组间发生急性排斥反应的情况,各研究间无统计学异质性(Q=4.74,P >0.10),故采用固定效应模型进行合并分析。荟萃分析显示:肾移植术后低剂量和高剂量依维莫司组急性排斥反应发生率分别为19.3%和18.9%,差异无统计学意义(RR =1.02,95%CI:0.85 ~1.22,P >0.05)。
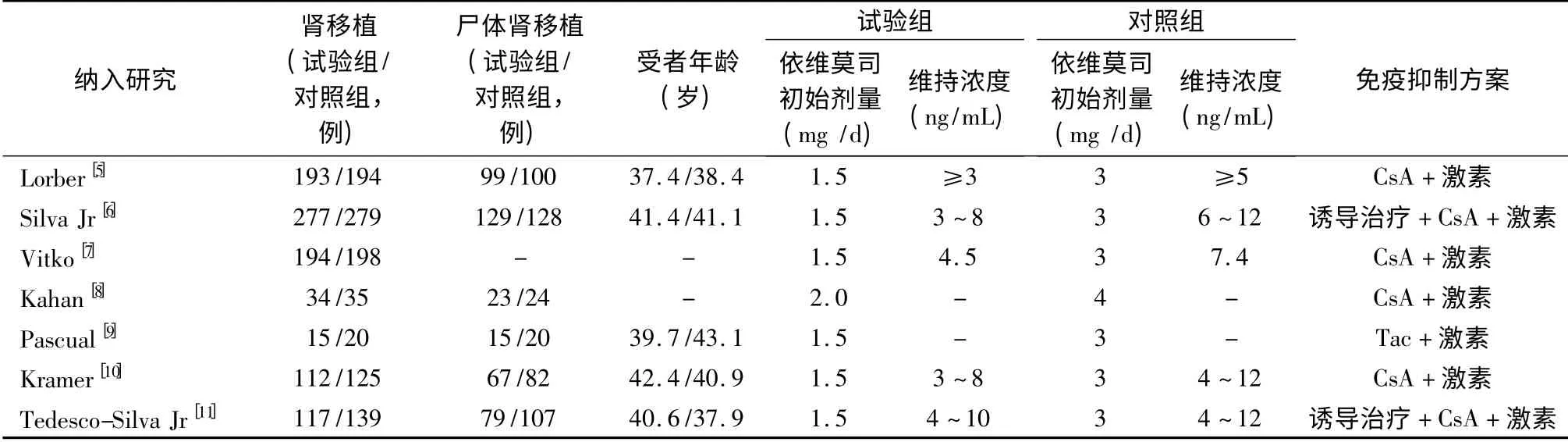
表1 7 项临床随机对照试验资料
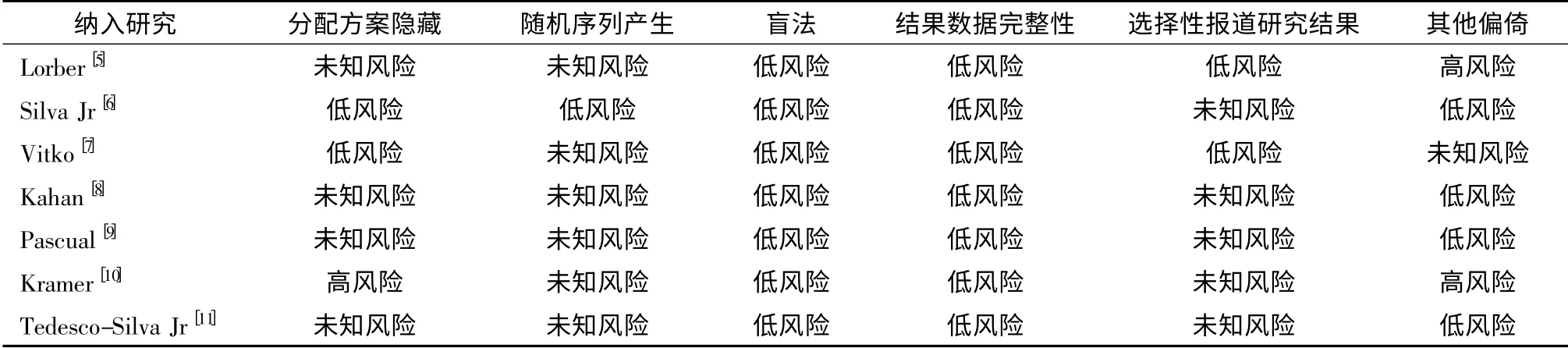
表2 7 项临床随机对照试验的质量评价
2.2.2 移植物失功
纳入的7 项RCT 均报道了不同剂量依维莫司组间移植物失功发生情况,各研究间无统计学异质性(Q=11.25,P >0.10),故采用固定效应模型来进行合并分析。荟萃分析显示:随访期内低剂量和高剂量依维莫司组移植物失功的发生率分别为6.2%和7.5%,差异无统计学意义(RR=0.81,95%CI:0.58 ~1.13,P >0.05)。
2.2.3 受者死亡情况
纳入的7 项RCT 均报道了不同剂量依维莫司组间受者死亡情况,各研究间无统计学异质性(Q=4.09,P >0.10),故采用固定效应模型来进行合并分析。荟萃分析显示:随访期内低剂量与高剂量依维莫司组的受者死亡率分别是3.9%和4.9%,差异无统计学意义(RR=0.79,95%CI:0.53 ~1.20,P >0.05)。
2.2.4 肌酐清除率
纳入的7 项RCT 中有4 项研究[6,7,10-11]报道了不同剂量依维莫司组间肌酐清除率差异,各研究间无统计学异质性(Q =1.70,P >0.10),故采用固定效应模型合并效应量。荟萃分析显示:低剂量依维莫司组肌酐清除率更高,差异具有统计学意义(MD=2.76,95%CI:0.38 ~5.15,P <0.05)。
2.2.5 血清肌酐水平
纳入的7 项RCT 中有4 项研究[6,7,10-11]报道了不同剂量依维莫司组间血清肌酐水平的差异,各研究间存在统计学异质性(Q =7.14,P =0.07),故采用随机效应模型进行效应量合并。荟萃分析显示:低剂量和高剂量依维莫司组的血清肌酐水平差异无统计学意义(MD= -3.14,95%CI:-15.62 ~9.34,P >0.05)。
2.3 安全性指标的荟萃分析结果
对纳入RCT 的安全性指标进行荟萃分析,结果显示低剂量比高剂量依维莫司组治疗中断率和贫血的发生率更低,差异具有统计学意义(RR 值=0.86和0.81,95%CI:0.75 ~0.98 和0.70 ~0.93,P 均<0.05)。白细胞减少、血小板减少、感染、腹泻、便秘、糖尿病、高胆固醇血症、高甘油三酯血症、外周水肿、高血压和肿瘤的发生率两组差异均无统计学意义(P 均>0.05),详见表3。

表3 不同剂量依维莫司组间安全性指标的荟萃分析
3 讨 论
肾移植术后受者的免疫抑制方案中常包含CNI,其效果明确,但CNI 不良反应众多,特别是肾毒性较大,易导致慢性移植肾肾病。为此,临床上常在使用CNI 的基础上联合肾毒性较低的依维莫司,以降低免疫抑制剂的用量。依维莫司可以抑制急性和慢性同种异体移植排斥反应,可与胞浆内他克莫司结合蛋白-12 形成复合物,可逆地抑制雷帕霉素靶蛋白复合物[12]。依维莫司还可抑制白细胞介素介导的T 细胞、B 细胞的增殖与分化,同时介导包括纤维母细胞、平滑肌细胞和内皮细胞在内的其他细胞的增殖与分化[13]。依维莫司口服吸收迅速,达到血药浓度峰值的时间为1.3 ~1.8 h,7 d后达到稳态血药浓度,其稳态峰、谷浓度以及血药浓度-时间曲线下面积均与剂量相关。对于成年人,依维莫司的药代动学与年龄、体质量及性别无关。但是对于儿童,需要根据体质指数调整剂量[14]。服药后,76% ~83%的依维莫司分布于红细胞并与血浆蛋白结合。依维莫司在小肠和肝脏可转化为11 种代谢产物,在血中的主要代谢产物是羟基依维莫司、二羟基依维莫司、二甲基依维莫司和开环的依维莫司。大约98%的依维莫司代谢产物经胆汁分泌,只有2%经尿液排出。根据群体药代动力学,依维莫司表观清除率为8.8 L/h,平均消除半衰期为5 ~24 h[15]。在肾移植受者所用的剂量范围内,依维莫司血药浓度与所服剂量成正比,与血药浓度-时间曲线下面积成线性关系[16-17]。因此,血药浓度可以作为依维莫司总暴露量的替代标记。本研究荟萃分析显示:在与CNI 联用时,低剂量依维莫司组对比高剂量依维莫司组发生活检证实的急性排斥反应、移植物失功、受者死亡、血清肌酐水平差异均无统计学意义,而使用低剂量依维莫司的受者肌酐清除率更高,差异具有统计学意义。并且,低剂量依维莫司可降低治疗中断率和贫血的发生率,提高受者依从性。受者使用CNI 的同时,联合高或低剂量依维莫司发生白细胞减少、血小板减少、感染、腹泻、便秘、糖尿病、高胆固醇血症、高甘油三酯血症、外周水肿、高血压和肿瘤的风险相似。
本研究纳入的7 项RCT,总体质量较高,但是各研究间仍存在差异,如Kahan 等[8]研究中,低剂量和高剂量组依维莫司的初始用量与其他研究不同,且每个研究中依维莫司的血药浓度波动范围也不尽相同,都有可能产生异质性。因此,尚需更多高质量的RCT 以减少偏倚对于结果的影响。7 项RCT 中Lorber 等[5]研究和Vitko 等[7]研究随访时间最长,均为3 年。Kahan 等[8]研究和Pascual 等[9]研究随访时间最短,均为6 个月。不同随访时间亦可能对结果产生影响,因此需要更长随访时间的RCT 提供更多证据。
总之,本文荟萃分析显示低剂量依维莫司联合CNI 安全性更高,有效性与高剂量依维莫司组相似。在联合CNI 的方案中,减少依维莫司用量,有效控制血药浓度,可以降低不良反应的发生,提高受者依从性,减轻受者的经济负担。
1 Laupacis A,Keown P,Pus N,et al. A study of the quality of life and cost-utility of renal transplantation[J]. Kidney Int,1996,50(1):235-242.
2 Neipp M,Jackobs S,Klempnauer J. Renal transplantation today[J]. Langenbecks Arch Surg,2009,394(1):1-16.
3 Marcen R. Immunosuppressive drugs in kidney transplantation:impact on patient survival,and incidence of cardiovascular disease,malignancy and infection[J]. Drugs,2009,69(16):2227-2243.
4 Chapman TM,Perry CM. Everolimus[J]. Drugs,2004,64(8):861-872.
5 Lorber MI,Mulgaonkar S,Butt KMH,et al. Everolimus versus mycophenolate mofetil in the prevention of rejection in de novo renal transplant recipients:A 3-year randomized,multicenter,phase Ⅲstudy[J]. Transplantation,2005,80(2):244-252.
6 Silva Jr HT,Cibrik D,Johnston T,et al. Everolimus plus reducedexposure CsA versus mycophenolic acid plus standard-exposure CsA in renal-transplant recipients[J]. American Journal of Transplantation,2010,10(6):1401-1413.
7 Vitko S,Margreiter R,Weimar W,et al. Three-year efficacy and safety results from a study of everolimus versus mycophenolate mofetil in de novo renal transplant patients[J]. American Journal of Transplantation,2005,5(10):2521-2530.
8 Kahan BD,Kaplan B,Lorber MI,et al. Rad in de novo renal transplantation:Comparison of three doses on the incidence and severity of acute rejection[J]. Transplantation,2001,71(10):1400-1406.
9 Pascual J,Del Castillo D,Cabello M,et al. Interaction between everolimus and tacrolimus in renal transplant recipients: A pharmacokinetic controlled trial[J]. Transplantation,2010,89(8):994-1000.
10 Kramer BK,Neumayer HH, Stahl R, et al. Graft function,cardiovascular risk factors,and sex hormones in renal transplant recipients on an immunosuppressive regimen of everolimus,reduced dose of cyclosporine, and basiliximab [J]. Transplantation Proceedings,2005,37(3):1601-1604.
11 Tedesco-Silva Jr H,Vitko S,Pascual J,et al. 12-Month safety and efficacy of everolimus with reduced exposure cyclosporine in de novo renal transplant recipients[J]. Transplant International,2006,20(1):27-36.
12 Calne RY,Collier DS,Lim S,et al. Rapamycin for immunosuppression in organ allografting[J]. Lancet,1989,2(8656):227.
13 Struijk GH,Minnee RC,Koch SD,et al. Maintenance immunosuppressive therapy with everolimus preserves humoral immune responses[J]. Kidney Int,2010,78(9):934-940.
14 Kirchner GI,Meier-Wiedenbach I,Manns MP. Clinical pharmacokinetics of everolimus[J]. Clin Pharmacokinet,2004,43(2):83-95.
15 Kovarik JM,Kahan BD,Kaplan B,et al. Longitudinal assessment of everolimus in de novo renal transplant recipients over the first posttransplant year:pharmacokinetics,exposure-response relationships,and influence on cyclosporine[J]. Clin Pharmacol Ther,2001,69(1):48-56.
16 Budde K,Fritsche L,Waiser J,et al. Pharmacokinetics of the immunosuppressant everolimus in maintenance renal transplant patients[J]. Eur J Med Res,2005,10(4):169-174.
17 Kovarik JM,Sabia HD,Figueiredo J,et al. Influence of hepatic impairment on everolimus pharmacokinetics:implications for dose adjustment[J]. Clin Pharmacol Ther,2001,70(5):425-430.
