猪到食蟹猴异种小肠移植后受体凝血功能变化的研究
2014-07-07姚丹华李幼生王剑毛琦郭明晓张少一孔文成任乐乐黎介寿
姚丹华 李幼生 王剑 毛琦 郭明晓 张少一 孔文成 任乐乐 黎介寿
超急性异种排斥反应(hyperacute xenograft rejection,HAXR)是决定异种器官在移植后早期能否存活的关键因素[1]。HAXR 是由异种天然抗体介导的体液免疫反应,通常发生在移植器官再灌注后数分钟到24 h 内。异种天然抗体通过识别异种器官血管内皮细胞表面的异种抗原,引起补体系统的链式激活,从而导致血管内皮细胞损伤。内皮细胞大量损伤时,其表达的抗凝物质如组织因子途径抑制物、抗凝血酶、活化蛋白C、活化蛋白S 等明显减少;而组织因子、凝血酶等促凝物质增加,导致血小板、纤维蛋白等物质在血管内聚集,引起血栓形成[2]。同时,由于血管内皮细胞的破坏,血液渗出到组织间隙,引起器官间质出血。因此,HAXR 的典型病理表现为血管内皮细胞大量破坏,血管内大量抗体、补体沉积,血管内血栓形成及组织间质广泛出血[2-3]。实时检测器官移植受体凝血功能的变化,可以从一定程度上了解HAXR 的发生情况。我们通过建立猪到食蟹猴异位节段小肠移植模型,采用常规凝血功能检测方法和血栓弹力图(thrombelastogram,TEG)检测受体在移植后不同时间点的凝血功能,研究HAXR过程中受体凝血功能变化,现报道如下。
1 材料与方法
1.1 实验动物和主要试剂
供体为3 只雄性白色杂种猪,5 ~6 周龄,体质量15 ~18 kg(购自南京军区南京总医院比较医学科)。术前12 h 禁食,自由饮水。受体为5 只食蟹猴,雌雄不限,3 ~4 周龄,体质量为2.8 ~3.7 kg(购自汉南新正源生物科技有限公司)。术前8 h 禁食,自由饮水。
主要试剂为活化部分凝血活酶时间(activated partial thromboplastin time,APTT)检测试剂盒以及凝血酶原时间(prothrombin time,PT)检测试剂盒(均为美国Heamoscope 公司)。
1.2 手术方式
常规消毒、麻醉后,获取供体末端回肠约50 cm的小肠,保留支配相关肠管的肠系膜前动、静脉分支,分别与受体肾下腹主动脉、肾下下腔静脉行端侧吻合。保留移植小肠两端肠管呈结扎状态,不与受体肠管吻合。
1.3 凝血功能检测
分别采集受体移植前以及移植小肠再灌注后15,30,60,120 min 各时间点的血液标本。经颈外静脉取血约2.5 mL,装入枸橼酸钠抗凝采血管,立即行常规凝血功能检测和TEG 检测。
1.4 移植小肠存活情况的判断
由两位经验丰富的临床医师连续观察移植小肠的存活情况,计算受体移植小肠的存活时间。同时发现肠黏膜散在出血点、无肉眼可见正常黏膜、肠壁及肠系膜血管搏动消失时,可诊断为移植小肠丢失。当判定为移植小肠丢失时,静脉注射氯化钾6 g,处死受体。本研究符合动物实验相关伦理要求。
2 结 果
2.1 受体凝血功能的变化
本研究共行猪到食蟹猴异种小肠移植术5 例。血管吻合成功率为100%,移植小肠中位存活时间为165 min (55 ~245 min)。受体移植前以及移植小肠再灌注后15,30,60,120 min 凝血功能监测显示,受体纤维蛋白原(fibrinogen,Fib)水平、血小板(platelet,Plt)计数以及抗凝血酶Ⅲ(antithrombinⅢ,AT Ⅲ)活性在移植小肠再灌注后,呈逐渐下降趋势,详见表1。Fib 术前初始值为(1.81 ±0.24)g/L,再灌注后120 min 降至最低,为(0.76±0.17)g/L;Plt术前初始值为(340 ±81)×109,再灌注后120 min降至最低,为(155 ±7)×109;AT Ⅲ术前初始值为(100 ±19)%,再灌注后30 min 降至最低,为(54 ±16)%。受体PT、APTT、D-二聚体以及国际标准化比值(international normalized ratio,INR)在移植小肠再灌注后,呈现逐渐升高的趋势。PT 术前初始值为(11 ±2)s,再灌注后30 min 升至最高,为(20 ±5)s;APPT 术前初始值为(21 ±3)s,再灌注后30 min 升至最高(88 ±29)s;D-二聚体术前初始值为(0.09 ±0.07)mg/L,再灌注后60 min 升至最高,为(0.70 ±0.49)mg/L;INR 初始值为1.0 ± 0. 2,再灌注后30 min 升至最高,为1.7 ±0.3。
受体TEG 指标中,R 值、K 值及LY30 呈逐渐升高的趋势,最大振幅(maximun amplitude,MA)数值呈现逐渐下降的趋势(表2)。R 值术前初始值为(6.9 ±1.3)min,再灌注后120 min 升至最高,为(16.8 ±2.7)min;K 值术前初始值为(2 ±1)min,再灌注后120 min 升至最高,为(15 ±5)min;LY30术前初始值为(4±2)%,再灌注后60 min 升至最高,为(31 ±7)%;MA 数值术前初始为(63 ±5)mm,再灌注后60 min 降至最低,为(25 ±16)mm。TEG 曲线提示,移植前受体凝血功能正常,移植小肠再灌注15,30 min 后,受体凝血功能呈现高凝状态,合并纤溶亢进;移植小肠再灌注后60,120 min,受体凝血功能表现为消耗性低凝状态(图1)。
表2 受体食蟹猴移植前及移植后各时间点血栓弹力图指标
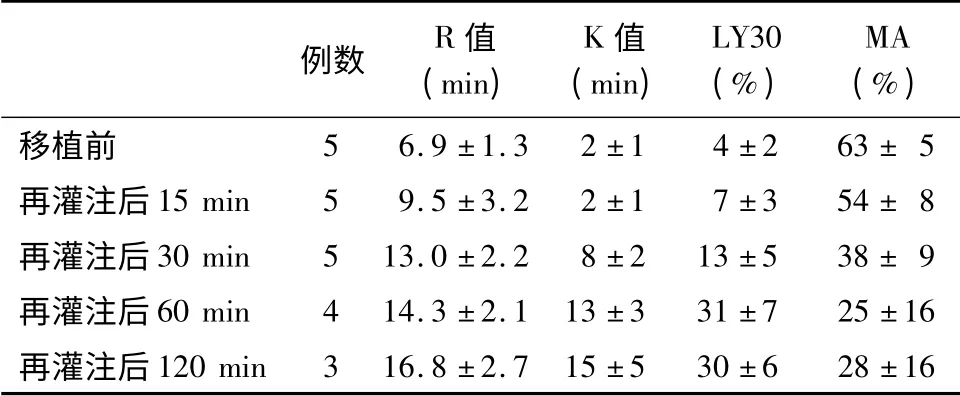
表2 受体食蟹猴移植前及移植后各时间点血栓弹力图指标
注:MA.最大振幅
例数 R 值(min)K 值(min)LY30(%)MA(%)63 ± 5再灌注后15 min 5 9.5 ±3.2 2 ±1 7 ±3 54 ± 8再灌注后30 min 5 13.0 ±2.2 8 ±2 13 ±5 38 ± 9再灌注后60 min 4 14.3 ±2.1 13 ±3 31 ±7 25 ±16再灌注后120 min 3 16.8 ±2.7 15 ±5 30 ±6移植前 5 6.9 ±1.3 2 ±1 4 ±2 28 ±16
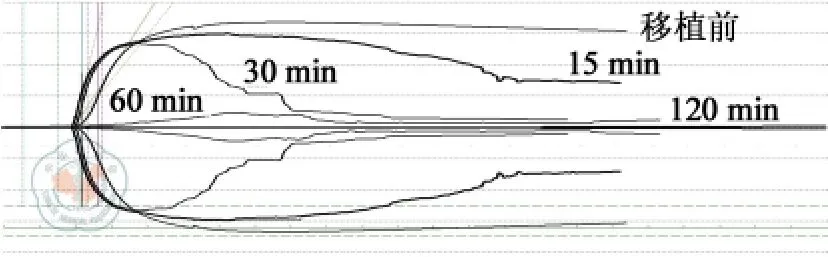
图1 1 例受体食蟹猴血栓弹力图曲线的变化趋势
2.2 移植小肠的病理表现
本研究中,所有受体再灌注后15 min,均发现典型的HAXR 病理表现。主要表现为移植小肠黏膜充血、水肿、散在出血点以及间质出血表现(图2)。供体正常小肠黏膜为淡粉红色,无出血点,黏膜皱襞清晰可见(图3a)。移植小肠再灌注后15 min,肠黏膜呈深粉红色,伴轻微水肿(图3b);再灌注后30 min,肠黏膜水肿较前加重,并伴有瘀血及点状出血(图3c);再灌注后120 min,肠黏膜水肿严重,出血连成片,伴肠腔内渗血(图3d)。再灌注后120 min,移植小肠大体观可见水肿,浆膜层点状出血,肠系膜大量出血点伴水肿(图4)。

表1 受体食蟹猴移植前及移植后各时间点常规凝血指标(¯x±s)
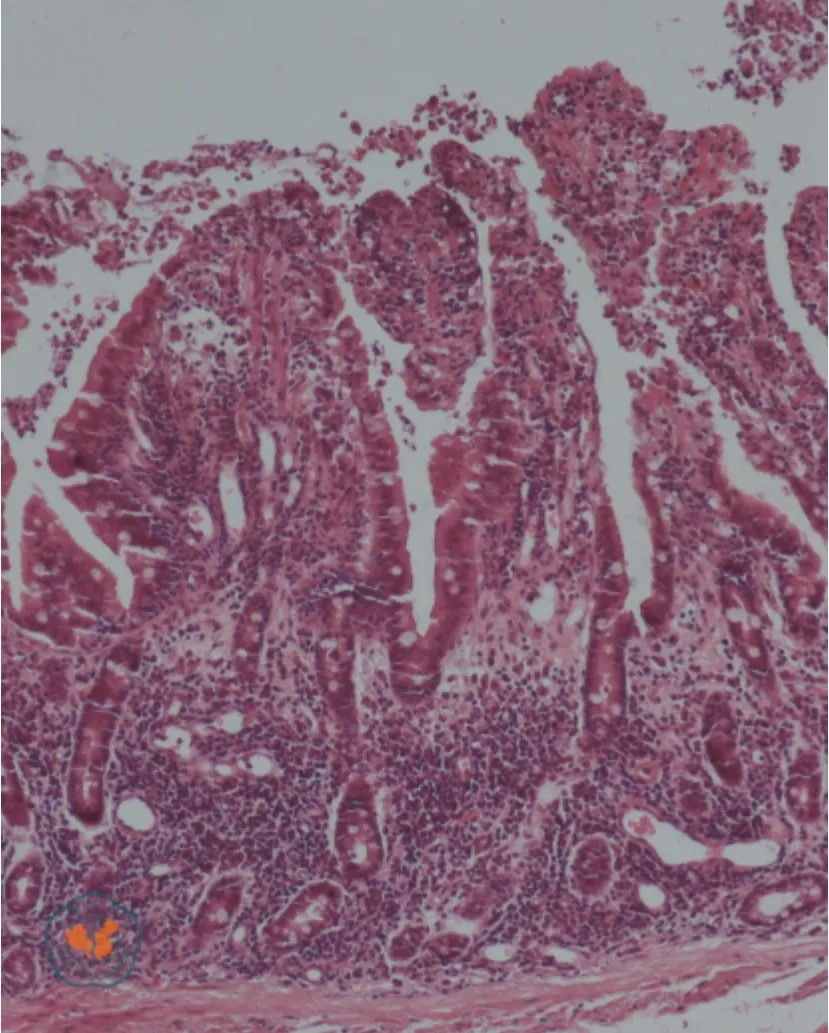
图2 受体食蟹猴移植小肠术后发生超急性排斥反应的病理表现(HE ×100)
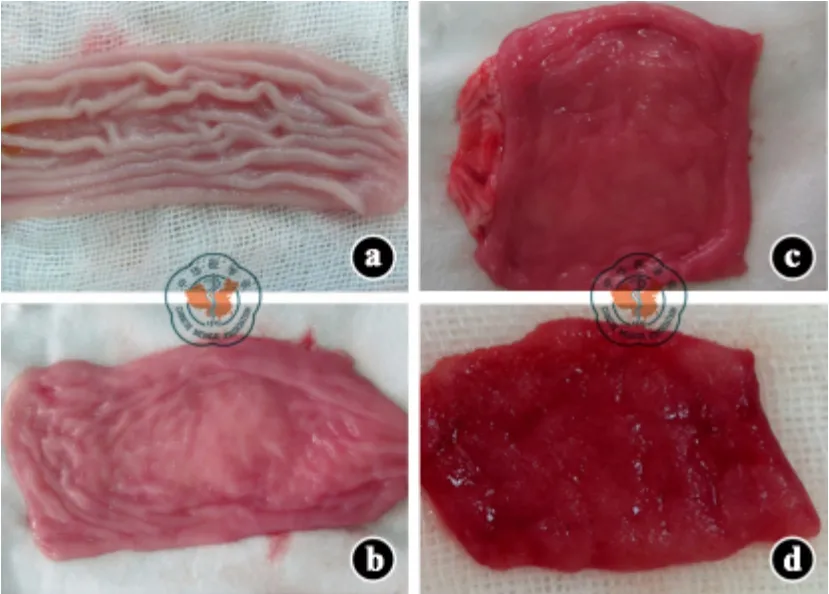
图3 受体食蟹猴移植前及移植后各时间点移植小肠肠黏膜病理表现
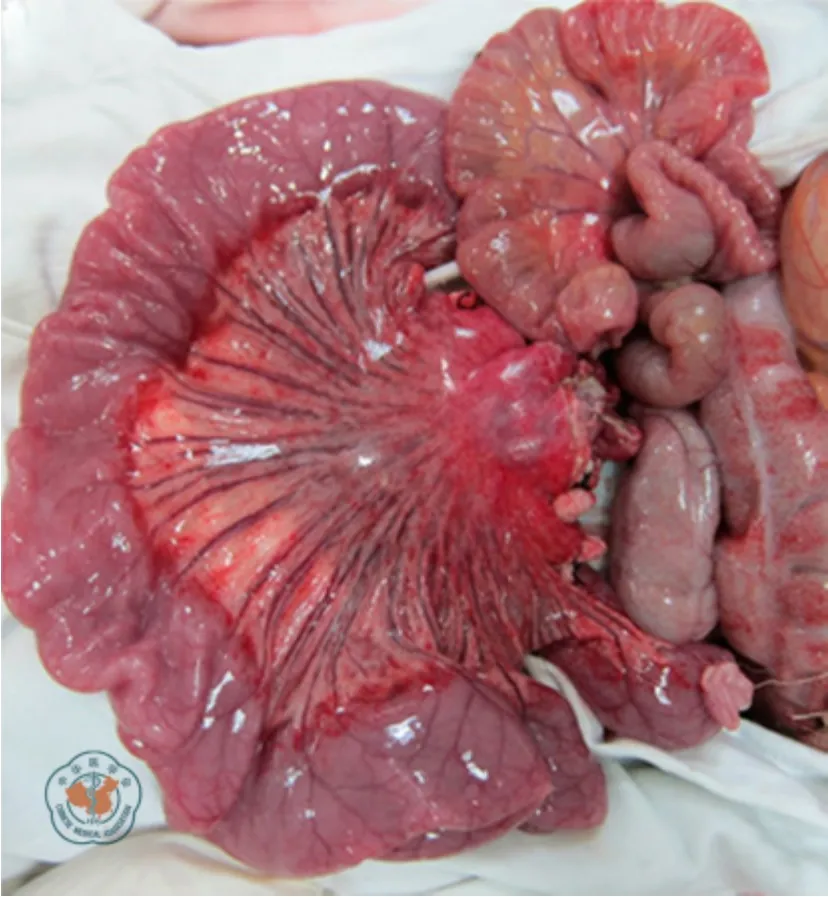
图4 受体食蟹猴移植肠再灌注后120 min 大体观
3 讨 论
异种器官移植有望成为解决目前供器官严重短缺困难的有效手段之一[4]。但是,由于异种器官细胞表面存在天然抗原,可导致异种器官移植后早期即出现以内皮细胞破坏、血管内血栓、间质出血为特征的HAXR[5]。目前,尚没有较好的血清学指标来反映异种器官移植术后排斥反应的发生情况,大多只能根据移植器官组织病理改变来判断排斥反应的发生情况。但是,对于某些特殊器官,难以通过反复活检获得足够的组织标本,加大了诊断排斥反应的难度。虽然在异种小肠移植动物实验中,我们可以反复多次获取小肠组织标本,但是从病理学角度判断移植小肠的存活情况存在一定的滞后性,无法实时监测移植小肠排斥反应发生情况。由于HAXR引起的血管内血栓和移植器官间质出血是最终导致异种移植物丢失的原因,故检测或调节凝血指标有助于判断和干预HAXR。Mohiuddin 等[6]将转基因猪(GTKO/hCD46)的心脏异位移植于狒狒体内,移植心脏存活时间达146 d;而将GTKO/hCD46 转基因猪的基础上再表达人血栓调节蛋白的3 系转基因猪的心脏移植于狒狒体内,移植心脏的存活时间可超过1 年[7]。事实证明,凝血功能的调节可以有效减少HAXR 的发生,并延长移植物的存活时间。研究异种移植受体在移植后凝血功能的变化,可能有助于指导抗凝治疗,延长移植物存活期[8]。
本研究采用常规方法检测食蟹猴受体各项凝血指标,同时还采用TEG 评估凝血酶、血小板及纤维蛋白功能以及纤维蛋白溶解情况,观察受体不同时间点全方面的凝血状态。与传统凝血项目检测相比,TEG 将凝血动力学过程描记为曲线,从而清楚地反映全血凝血过程,包括从凝血开始至血凝块降解的全过程,涵盖凝血级联反应与血小板相互作用的综合结果,反映参与凝血过程所有物质的综合状态[9-10]。TEG 中的R 值反应凝血因子功能,K 值反应血凝块形成速率,MA 反映纤维蛋白和血小板血凝块最大强度,LY30 值反映纤维蛋白降解速率。本研究中,移植小肠再灌注后15 min,TEG 曲线显示R 值及K 值减小,LY30 增高,提示受体凝血因子大量活化,纤维蛋白和血小板开始聚集,同时出现继发性纤溶亢进,受体此时处于弥散性血管内凝血的高凝期。移植小肠再灌注后60,120 min,TEG 曲线提示受体处于消耗性低凝状态。Spiezia 等[8]使用TEG 技术监测猪到食蟹猴异种肾移植后受体的凝血功能,通过及时发现受体消耗性凝血功能障碍,及时对症治疗,成功延长了受体的生存时间。可见TEG 可以实时、全面评估凝血状态,在指导异种器官移植抗HAXR 治疗方面,前景广阔,意义重大。
总之,本研究发现受体凝血功能随HAXR 的发生而出现逐渐恶化的趋势,因此,我们认为凝血功能可以在一定程度上反映HAXR 的发生情况。采用常规凝血指标结合TEG 来监测凝血功能,从而进行抗凝、止血干预,可能会有利于延长异种移植小肠存活时间。
1 Vaughan HA,Loveland BE,Sandrin MS. Gal alpha(1,3)Gal is the major xenoepitope expressed on pig endothelial cells recognized by naturally occurring cytotoxic human antibodies[J]. Transplantation,1994,58(8):879-882.
2 Pierson RN,Dorling A,Ayares D,et al. Current status of xenotransplantation and prospects for clinical application[J].Xenotransplantation,2009,16(5):263-280.
3 Yazaki S,Iwamoto M,Onishi A,et al. Production of cloned pigs expressing human thrombomodulin in endothelial cells[J].Xenotransplantation,2012,19(2):82-91.
4 Yamada K,Scalea J. Current progress in xenogeneic tolerance[J].Curr Opin Organ Transplant,2012,17(2):168-173.
5 Dai Y,Vaught TD,Boone J,et al. Targeted disruption of the alpha 1,3-galactosyltransferase gene in cloned pigs[J]. Nat Biotechno,2002,20(3):251-251.
6 Mohiuddin MM,Singh AK,Corcoran PC,et al. Role of anti-CD40 antibody-mediated costimulation blockade on non-Gal antibody production and heterotopic cardiac xenograft survival in a GTKO.hCD46Tg pig-to-baboon model[J]. Xenotransplantation,2013,21(1):35-45.
7 Mohiuddin MM, Singh AK, Corcoran PC, et al. One-year heterotopic cardiac xenograft survival in a pig to baboon model[J].Am J Transplantation,2014,14(2):488-499.
8 Spiezia L,Boldrin M,Radu C,et al. Thromboelastographic evaluation of coagulative profiles in pig-to-monkey kidney xenotransplantation[J]. Xenotransplantation,2013,20(2):89-99.
9 Gonzalez E,Pieracci FM,Moore EE,et al. Coagulation abnormalities in the trauma patient:the role of point-of-care thromboelastography[J]. Semi Thromb Hemost,2010,36(7):723-737.
10 Kashuk JL,Moore EE,Sawyer M,et al. Postinjury coagulopathy management:goal directed resuscitation via POC thrombelastography[J]. Ann Surg,2010,251(4):604-614.
