一种新型诊断和治疗肝移植术后缺血型胆道病变模式的研究
2014-07-07张英才刘剑戎许世磊杨卿任杰郑荣琴杨扬陈规划
张英才 刘剑戎 许世磊 杨卿 任杰 郑荣琴 杨扬 陈规划
随着器官保存液、免疫抑制剂、外科手术技术和围手术期管理技术的改善,肝移植术后感染和排斥反应等常见并发症逐渐减少,术后受者和移植肝的生存率显著提高。但胆道并发症的发生率却未能明显下降,成为影响移植肝长期存活的重要因素。移植肝缺血型胆道病变(ischemic-type biliary lesions,ITBLs)已成为肝移植术后最难处理的胆道并发症之一。ITBLs 是指非手术吻合造成的胆管树破坏、狭窄或梗阻,不伴动脉血栓形成。由于不同的研究对其定义可能存在不同,ITBLs 发生率为5% ~15%[1-6],甚至有报道其发生率高达26%[7-8],ITBLs 已成为再次肝移植的主要原因之一。目前传统诊断ITBLs 的方法主要依靠介入影像学方法,例如磁共振胰胆管造影(magnetic resonance cholangiopancreatography,MRCP)、经内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP)以及经皮肝穿刺胆道造影(percutaneous transhepatic cholangiodrainage,PTCD)等。这些方法在诊断和治疗ITBLs 方面存在严重的滞后性,治疗效果较差,很多出现ITBLs 的受者只能求助于再次肝移植。因此寻找一种早期预测和诊断ITBLs 的方法具有重要的意义。中山大学附属第三医院肝脏移植中心从2007 年2 月起采用早期诊断与干预模式(early diagnosis and intervention model,EDIM)诊断和治疗肝移植术后ITBLs,现报道如下。
1 资料与方法
1.1 研究对象
选取2003 年10 月至2012 年6 月我中心行原位肝移植术后出现ITBLs 的受者(所有的入选受者均接受尸体供肝)。入选标准:(1)经ERCP 或PTCD 检查明确诊断为ITBLs;(2)受者依从性好,可规律随访,病历资料完整。排除标准:(1)供、受者血型不相合;(2)术后出现肝动脉血栓形成;(3)原发疾病为原发性硬化性胆管炎。共纳入80 例受者。2003 年10 月至2007 年1 月接受传统模式诊疗的受者作为传统模式组,2007 年2 月至2012 年6 月接受EDIM 诊疗的受者作为EDIM 组。其中,传统模式组37 例(男性32 例,女性5 例),中位年龄49. 7 岁(26 ~70)岁;EDIM 组43 例(男性37 例,女性6 例),中位年龄46.6 岁(29 ~62)岁。所有受者接受常规随访,截至2013 年12 月,传统模式组和EDIM 组受者中位随访时间分别为76.2 个月(13 ~118 个月)和53.4 个月(18 ~80 个月)。研究对象均签署知情同意书,研究内容经本院伦理审查委员会审批通过。
1.2 传统模式组和EDIM 组的ITBLs 诊断及治疗模式
传统模式组受者出现胆道酶学改变(如总胆红素、谷氨酰转肽酶升高),同时出现发热、黄疸及腹痛等症状时,首先给予熊去氧胆酸、腺苷蛋氨酸及前列腺素E1 等药物处理,效果不佳时则行MRCP、ERCP 或PTCD 等检查。明确诊断为ITBLs 后,根据情况行介入(包括PTCD、ERCP 和肝动脉支架植入术)或手术等治疗,以上治疗无效者则行再次肝移植。
EDIM 组受者预防性给予上述药物治疗。术后1 个月内每周接受1 次胆道超声造影(contrastenhanced ultrasound,CEUS)检查。1 个月后,根据肝功能情况调整CEUS 检查次数。生化检查发现胆道酶学异常,同时CEUS 发现肝门胆管壁在动脉期为低增强或无增强,甚至出现肝内胆管扩张、肝门胆管狭窄及管壁增厚等改变时,提示移植肝出现ITBLs。行人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,HUMSCs)移植,以改善胆道供血和修复胆道上皮,同时行PTCD、ERCP 或MRCP明确诊断并引流胆汁。如果介入治疗效果欠佳,根据情况行局部肝切除和(或)肝肠吻合术,以上治疗无效者则行再次肝移植。
1.3 胆道CEUS 检查
采用Acuson Sequoia 512 型超声诊断仪(美国西门子公司),4V1 凸阵探头,频率1.0 ~4.0 MHz。成像技术采用对比脉冲序列,机械指数0. 15 ~0.21。造影剂采用SoneVue(意大利Bracco 公司)联合5 mL 生理盐水配制成六氟化硫微泡悬浮液,肘部浅静脉注射造影剂1.5 mL/次,可重复多次注射。
1.4 HUMSCs 制备和移植
选取中山大学附属第三医院产科出生的正常足月健康婴儿脐带组织,浸泡于DMEM 培养基中,超净环境下去除多余组织,剪碎为1 mm ×1 mm ×1 mm 的组织块。将组织块移至0.1%Ⅰ型胶原酶中,加入少许DMEM 培养液,在37 ℃恒温振荡仪内消化,直至Wharton 胶全部消化。将含细胞的消化液吸入无菌离心管,以30 倍体积DMEM 培养液反复吹打稀释,300 × g 离心5 min,弃上清液。用含10%胎牛血清的DMEM 培养液重悬浮后转移至普通培养瓶中常规培养。细胞贴壁后,第3 天首次换液,弃去未贴壁细胞,以后每3 或4 天换液1 次,第2 次换液起使用原培养基和MesenPro 减血清培养基(1 ∶1 比例混合)培养。常规消化、传代。
EDIM 组受者在CEUS 初步诊断胆道供血不佳,怀疑出现ITBLs 时,即开始应用HUMSCs 移植。具体方法为:分别在初步诊断0,1,2,4,8,12 周后,经外周静脉输注1 ×106个/kg 剂量的HUMSCs。
1.5 统计学方法
采用SPSS 15.0 统计软件对数据进行分析。计量资料以均数±标准差(¯x ±s)表示。采用t 检验比较两组受者初诊为ITBLs 的时间、采取介入治疗的时间及移植肝丢失时间。采用Kaplan-Meier 曲线和Log-Rank 法分析两组受者移植肝生存率。P <0.05为差异有统计学意义。
2 结 果
2.1 传统模式组和EDIM 组受者ITBLs 诊断情况
ITBLs 受者CEUS 检查可见肝门部胆管壁在动脉期为低增强或无增强,提示胆道血供欠佳;彩色B 超检查可见肝内胆管不均匀扩张、肝门部胆管狭窄及管壁增厚等声像(图1)。非ITBLs 受者CEUS检查可见胆总管壁在动脉期增强明显(高于肝实质),在门静脉期和延迟期持续处于等或低增强,提示胆道血供良好;彩色B 超检查可见胆管腔轮廓清晰(图2)。
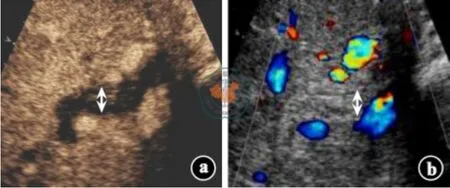
图1 缺血型胆道病变受者移植肝胆道影像学检查
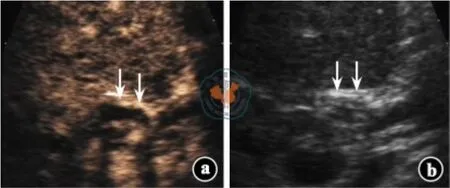
图2 非缺血型胆道病变受者移植肝胆道影像学检查
传统模式组受者从肝移植术后到确诊ITBLs 的平均时间为(56±31)d,EDIM 组受者为(24 ±19)d,两组比较差异有统计学差异(t =5.136,P <0.05)。传统模式组从确认ITBLs 到采用介入治疗的平均时间为(105 ±42)d,而EDIM 组仅为(58 ±20)d,两组比较差异有统计学差异(t=7.035,P <0.05)。
2.2 传统模式组和EDIM 组受者ITBLs 治疗效果及随访结果
传统模式组37 例受者中,18 例经药物和介入治疗后病情好转,肝功能长期稳定;2 例介入治疗效果不佳,行肝段切除+胆肠吻合后病情好转;11 例经介入或手术治疗无效后行再次肝移植(1 例术中出血较多,术后多器官功能衰竭死亡;1 例移植术后发生移植物抗宿主病死亡);6 例经介入或手术治疗无效,但未及时行再次肝移植而死亡。EDIM 组43 例受者中,25 例经药物、HUMSCs 移植和介入治疗后病情好转,肝功能长期稳定;3 例在上述治疗效果不佳后行肝段切除+胆肠吻合后病情好转;9 例经介入和手术等治疗无效后行再次肝移植(1 例术后发生严重感染死亡);6 例经介入或手术治疗无效,但未及时行再次肝移植而死亡。
所有受者均接受常规随访,截至2013 年12 月,传统模式组和EDIM 组受者中位随访时间分别为76.2 个月(13 ~118 个月)和53. 4 个月(18 ~80 个月)。传统模式组和EDIM 组死亡受者分别为8 例和7 例。传统模式组移植肝1,3 年生存率分别89.2%,54.1%,EDIM 组移植肝1,3 年生存率分别95.3%,81.3%,传统模式组受者移植肝1,3 年生存率均低于EDIM 组(χ2=4.219,P <0.05),见图3。传统模式组和EDIM 组移植肝丢失的时间分别为(25 ±9)个月和(33 ±10)个月,传统模式组出现移植肝丢失时间早于EDIM 组(t = - 2. 085,P <0.05)。

图3 传统模式组和早期诊断与干预模式组移植肝生存时间比较
3 讨 论
ITBLs 的诊断和治疗一直都是肝移植术后的一大挑战,目前肝移植术后诊断ITBLs 主要依靠MRCP、ERCP 及PTCD 等胆道造影检查[4-5,9-11]。其中,无创性的MRCP 逐渐成为诊断ITBLs 的首选方法,其灵敏度和特异度均较高[12-14]。Boraschi 等[12]报道,MRCP 诊断肝移植术后胆道并发症的灵敏度为93%,特异度为92%,阳性预测值为86%,阴性预测值为96%,效果较佳。MRCP 可发现胆管树扭曲变形、肝内胆管扩张、胆泥形成、胆管壁破坏等改变。但出现这些形态学改变的患者基本已处于疾病的进展期,失去了治疗的最佳时机。ERCP 和PTCD是目前公认诊断ITBLs 的金标准,但这两种方法均为有创性检查,引起胰腺炎或出血的发生率为1% ~7%[15-16]。因此,以上方法均不能用于早期监测和诊断肝移植术后ITBLs,寻找一种无创的、早期诊断ITBLs 的方法显得尤为重要。
CEUS 将具有与人体组织不同声学特性的超声对比剂注入人体,增强血流及组织的回声对比。动物实验和临床试验均证实超声对比剂的注入可弥补彩色多普勒超声在显示深部血管、低速微弱的血流信号方面的不足,可使超声成像的信噪比显著提高,并可检查微末级小血管的血流信号。CEUS 所用的对比剂与CT、MRI 不同,它无法穿过微血管内皮间隙,因此可以对组织微循环显示的更为清楚可靠[17]。因此,CEUS 在诊断肝移植术后肝动脉和门静脉并发症方面显示出巨大的价值,极大地减少了血管造影等有创性检查方法的应用[18-21]。但目前关于CEUS 在诊断肝移植术后胆道并发症,特别是ITBLs 方面的研究极少。事实上,ITBLs 本质上也是一种血管源性并发症。胆管基本完全依靠肝动脉在胆管周围形成的血管丛供血,ITBLs 的病理基础之一即为胆管周围血管丛损伤造成胆管微循环改变引起的胆管上皮坏死、纤维化和狭窄[8,22-24]。利用CEUS 监测肝移植术后胆管周围血管丛微循环的改变情况可能成为早期诊断ITBLs 的一种有效方法。
我们发现,ITBLs 与非ITBLs 受者在CEUS 检查时的肝门部胆管增强表现有显著差异。CEUS 动脉期,ITBLs 患者肝门部胆管壁对比剂注入少,呈无或低增强;非ITBLs 患者该部位对比剂注入多,呈高或等增强。这种CEUS 表现的不同反映了ITBLs 胆管周围血管丛受损、胆管灌注水平下降的病理改变,有助于在胆管出现形态学改变之前早期诊断ITBLs[25]。此外,CEUS 还可发现肝内胆管扩张、肝门部胆管狭窄、管壁增厚等变化。因此,结合CEUS和胆道酶学结果,我们可以在胆道功能学改变阶段实现ITBLs 的早期诊断。
除了早期诊断ITBLs,我们对治疗模式也进行了一些探索。传统治疗模式上存在严重的滞后性,从肝移植术后到确诊ITBLs 再行介入或手术干预的时间一般需要3 ~5 个月,此时已有很多受者出现不可逆性胆管损伤。Hertl 等[26]以猪作为实验对象,发现用含疏水性胆盐的盐水灌注的肝脏移植术后肝内胆管损伤明显加重。Hoekstra 等[27]采用转基因小鼠模型证实肝内胆汁淤积和胆盐潴留是引发移植肝损伤的关键机制。在人体肝移植术后也发现胆管损伤与毒性胆汁形成有关,其特点是胆汁中胆盐/磷脂的比例较高[28]。胆汁淤积还容易引起细菌生长、导致胆道感染的发生率升高。受以上研究启示,我们认为早期预防胆汁淤积并采用介入手段保持胆汁引流通畅,对胆管上皮具有重要的保护意义。因此,我们在肝移植术后即给予受者口服熊去氧胆酸和腺苷蛋氨酸预防胆汁淤积和胆结石形成,同时静脉滴注前列腺素E1 以改善胆管微循环,减轻胆管上皮细胞的损伤。每周1 次胆道CEUS 检查显著缩短了ITBLs 的初诊时间。
另外,由于组织器官发生炎症时会释放一些细胞黏附因子和趋化因子,可与干细胞的有关受体相互作用,从而对间充质干细胞产生趋化性。间充质干细胞的这种向病灶趋化迁移能力对治疗一些急性组织损伤具有重要意义。研究表明,间充质干细胞可减轻肝移植免疫性损伤,有效延长移植物和受体生存期,并参与移植肝的组织修复;其具体机制尚不清楚,可能涉及间充质干细胞的趋化性、分泌的肝细胞生长因子及其转分化作用[29-32]。受这些研究启发,我们对肝移植术后出现ITBLs 的受者应用HUMSCs 移植治疗,在初步的临床研究中发现,HUMSCs 移植可使部分ITBLs 受者保持长期的肝功能稳定,推迟或避免了再次肝移植手术。
与传统诊治模式比较,早期诊断和干预ITBLs的新型模式可以减轻胆管的损伤,降低胆道感染的发生率,延长术后移植肝的存活时间,延迟移植肝丢失时间,提高ITBLs 的整体治疗效果。
1 Sawyer RG,Punch JD. Incidence and management of biliary complications after 291 liver transplants following the introduction of transcystic stenting[J]. Transplantation,1998,6(9):1201-1207.
2 Turrion VS,Alvira LG,Jimenez M,et al. Management of the biliary complications associated with liver transplantation:13 years of experience[J]. Transplant Proc,1999,31(6):2392-2393.
3 Rizk RS,McVicar JP,Emond MJ,et al. Endoscopic management of biliary strictures in liver transplant recipients:effect on patient and graft survival[J]. Gastrointest Endosc,1998,47(2):128-135.
4 Ward EM,Kiely MJ,Maus TP,et al. Hilar biliary strictures after liver transplantation:cholangiography and percutaneous treatment[J]. Radiology,1990,177(1):259-263.
5 Campbell WL,Sheng R,Zajko AB,et al. Intrahepatic biliary strictures after liver transplantation[J]. Radiology,1994,191(3):735-740.
6 Feller RB,Waugh RC,Selby WS,et al. Biliary strictures after liver transplantation:clinical picture,correlates and outcomes[J]. J Gastroenterol Hepatol,1996,11(1):21-25.
7 Otto G,Roeren T,Golling M,et al. Ischemic type lesions of the bile ducts after liver transplantation:2 years results[J]. Zentralbl Chir,1995,120(6):450-454.
8 Sanchez-Urdazpal L,Gores GJ,Ward EM,et al. Ischemic-type biliary complications after orthotopic liver transplantation[J].Hepatology,1992,16(1):49-53.
9 Sanchez-Urdazpal L,Gores GJ,Ward EM,et al. Diagnostic features and clinical outcome of ischemic-type biliary complications after liver transplantation[J]. Hepatology,1993,17(4):605-609.
10 Guichelaar MM,Benson JT,Malinchoc M,et al. Risk factors for and clinical course of non-anastomotic biliary strictures after liver transplantation[J]. Am J Transplant,2003,3(7):885-890.
11 Kok T,Van der Sluis A,Klein JP, et al. Ultrasound and cholangiography for the diagnosis of biliary complications after orthotopic liver transplantation:a comparative study[J]. J Clin Ultrasound,1996,24(3):103-115.
12 Boraschi P,Braccini G,Gigoni R,et al. Detection of biliary complications after orthotopic liver transplantation with MR cholangiography[J].Magn Reson Imaging,2001,19(8):1097-1105.
13 Boraschi P,Donati F,Gigoni R,et al. Ischemic-type biliary lesions in liver transplant recipients:evaluation with magnetic resonance cholangiography[J]. Transplant Proc,2004,36(9):2744-2747.
14 Ward J,Sheridan MB,Guthrie JA,et al. Bile duct strictures after hepatobiliary surgery:assessment with MR cholangiography[J].Radiology,2004,231(1):101-108.
15 Boraschi P,Donati F. Complications of orthotopic liver transplantation:imaging findings[J]. Abdom Imaging,2004,29(2):189-202.
16 Sherman S,Lehman GA. ERCP-and endoscopic sphincterotomyinduced pancreatitis[J]. Pancreas,1991,6(3):350-367.
17 Leen E,McArdle CS. Ultrasound contrast agents in liver imaging[J]. Clin Radiol,1996,51(Suppl 1):S35-S39.
18 Sidhu PS,Shaw AS,Ellis SM,et al. Microbubble ultrasound contrast in the assessment of hepatic artery patency following liver transplantation: role in reducing frequency of hepatic artery arteriography[J]. Eur Radiol,2004,14(1):21-30.
19 Herold C,Reck T,Ott R,et al. Contrast-enhanced ultrasound improves hepatic vessel visualization after orthotopic liver transplantation[J]. Abdom Imaging,2001,26(6):597-600.
20 Worthy SA,Olliff JF,Olliff SP,et al. Color flow Doppler ultrasound diagnosis of a pseudoaneurysm of the hepatic artery following liver transplantation[J]. J Clin Ultrasound,1994,22(7):461-465.
21 Schlosser T,Pohl C,Kuntz-Hehner S,et al. Echoscintigraphy:a new imaging modality for the reduction of color blooming and acoustic shadowing in contrast sonography[J]. Ultrasound Med Biol,2003,29(7):985-991.
22 Takasaki S,Hano H. Three-dimensional observations of the human hepatic artery (Arterial system in the liver)[J]. J Hepatol,2001,34(3):455-466.
23 Qian YB,Liu CL,Lo CM,et al. Risk factors for biliary complications after liver transplantation[J]. Arch Surg,2004,139(10):1101-1105.
24 Doppman JL,Girton M,Kahn R. Proximal versus peripheral hepatic artery embolization experimental study in monkeys[J]. Radiology,1978,128(2):577-588.
25 Ren J,Lu MD,Zheng RQ,et al. Evaluation of the microcirculatory disturbance of biliary ischemia after liver transplantation with contrastenhanced ultrasound:preliminary experience[J]. Liver Transpl,2009,15(12):1703-1708.
26 Hertl M,Hertl MC,Kluth D,et al. Hydrophilic bile salts protect bile duct epithelium during cold preservation:a scanning electron microscopy study[J]. Liver Transpl,2000,6(2):207-212.
27 Hoekstra H,Porte RJ,Tian Y,et al. Bile salt toxicity aggravates cold ischemic injury of bile ducts after liver transplantation in Mdr2 + /-mice[J]. Hepatology,2006,43(5):1022-1031.
28 Geuken E,Visser D,Kuipers F,et al. Rapid increase of bile salt secretion is associated with bile duct injury after human liver transplantation[J]. J Hepatol,2004,41(6):1017-1025.
29 Jiang H,Qu L,Li Y,et al. Bone marrow mesenchymal stem cells reduce intestinal ischemia/reperfusion injuries in rats[J]. J Surg Res,2011,168(1):127-134.
30 Li Y,Zhang D,Zhang Y,et al. Augmentation of neovascularization in murine hindlimb ischemia by combined therapy with simvastatin and bone marrow-derived mesenchymal stem cells transplantation[J]. J Biomed Sci,2010,17:75.
31 Cao H,Qian H,Xu W,et al. Mesenchymal stem cells derived from human umbilical cord ameliorate ischemia/reperfusion-induced acute renal failure in rats[J]. Biotechnol Lett,2010,32(5):725-732.
32 Xu J,Deng X,Demetriou AA,et al. Factors released from cholestatic rat livers possibly involved in inducing bone marrow hepatic stem cell priming[J]. Stem Cells Dev,2008,17(1):143-155.
