造纸白泥的分解和碳酸盐化特性
2014-07-05何兰兰于敦喜曾宪鹏吕为智吴建群徐明厚
何兰兰,于敦喜,曾宪鹏,吕为智,吴建群,徐明厚
(华中科技大学煤燃烧国家重点实验室,湖北 武汉 430074)
造纸白泥的分解和碳酸盐化特性
何兰兰,于敦喜,曾宪鹏,吕为智,吴建群,徐明厚
(华中科技大学煤燃烧国家重点实验室,湖北 武汉 430074)
造纸白泥作为一种碱性工业废弃物占据了大量的土地资源,其资源化利用是一个有待解决的问题。白泥用于工业烟气中CO2的回收是一种有效的资源化利用方式,然而其中还存在一些机理问题有待研究。本文利用热重分析(TGA)技术对造纸白泥和天然石灰石的煅烧分解特性和碳酸盐化特性进行了对比研究。结果表明,在相同煅烧条件下,白泥的分解速率较石灰石快得多,因此完全煅烧所需时间更短。经过相同的煅烧过程后(850℃,纯N2,15min),白泥煅烧产物的碳酸盐化转化率低于石灰石煅烧产物,可能原因在于白泥煅烧产物较石灰石煅烧产物具有更低的比表面积。碳酸盐化温度(600~700℃)对白泥和石灰石煅烧产物碳酸盐化的影响规律相似,升高温度对快速碳酸盐化阶段的反应速率没有明显影响,但是延长了快速反应阶段的持续时间,提高了碳酸盐化转化率。
白泥;二氧化碳捕集;吸附剂;废物处理;分解特性;碳酸盐化特性
全世界每年由造纸行业产生数以亿吨的碱回收白泥,国外大型造纸厂多以木浆造纸为主,碱回收白泥一般是返回石灰窑煅烧生产生石灰,在厂内循环使用。而我国造纸厂以草浆造纸为主,碱回收白泥中元素Si含量较高,易与碱性物质发生反应,因此不利于草浆造纸白泥的回收利用。目前,我国草浆造纸白泥主要直接堆放或填埋,不仅占用大量土地,使土壤变碱性,还浪费资源[1]。因此,对造纸白泥进行资源化利用是一项极具挑战性的课题。
造纸白泥的主要成分为CaCO3,可用于工业烟气中CO2的循环吸收。国内李英杰等[2-3]对造纸白泥捕集CO2的特性进行了初步研究,而国外相关研究却鲜见报道。相对于天然石灰石,造纸白泥本身是需要处理和资源化利用的废弃物,价格低廉、无需开采;同时,其粒径小,无需粉碎处理。另外,根据白泥的产生过程(Na2CO3+CaO+H2O—→CaCO3+2NaOH),其性质类似轻质碳酸钙,由Ca2+和在溶液中沉淀产生,煅烧后获得的CaO以中孔结构为主,表现出更好的煅烧/碳酸盐化循环特性[4-5]。李英杰等[2-3]的实验表明,白泥虽然在最初15次循环内CO2的捕集容量不及天然石灰石,但是在15次循环以后,白泥的CO2捕集容量却高于石灰石,并且在经历100次循环后仍然保持20%的碳酸盐化转化率,而石灰石的碳酸盐化转化率则降至7.5%。特别是经过水洗预处理之后的白泥,经历100次循环后,碳酸盐化转化率仍可保持在36%,是天然石灰石的4.8倍。由此可见,在CO2的捕集方面,造纸白泥较天然石灰石具有更好的循环稳定性,是具有良好前景的CO2吸附剂。
李英杰等[2-3]的研究中,白泥煅烧和碳酸盐化分别采用15min和40min,但未提供反应时间选取的依据。一方面,该时间相对于流化床内物料的停留时间(2~3min)过长[6],另一方面也延长了白泥经历高温的时间,会促进其烧结而导致性能的降低[7-8]。此外,对白泥煅烧和碳酸盐化随时间的变化,以及白泥在流化床的反应时间尺度上能否实现充分分解或者碳酸盐化反应还鲜见报道。本文针对一种草浆造纸白泥,利用热重(TGA)分析技术研究了白泥在钙基吸附剂的典型再生温度窗口(850~950℃)、N2气氛下的等温煅烧特性,以及在高浓度CO2(80%)气氛、950℃条件下的煅烧特性,并将煅烧产物,在典型电厂烟气CO2浓度(15%)、不同温度(600~700℃)下进行了吸附CO2的实验研究,将白泥的分解特性和煅烧产物的碳酸盐化特性与天然石灰石的进行对比研究,得到了有意义的结果。
1 实 验
1.1 实验材料
实验以某造纸厂的草浆造纸碱回收白泥和天然石灰石作为原材料。由X射线荧光光谱(XRF)分析的白泥和石灰石的化学成分如表1所示,白泥中CaO含量低于石灰石,但仍高达78.19%,相对于石灰石,白泥中含有较多的Si、Na、K等杂质。白泥和石灰石的X射线衍射(XRD)分析如图1所示,可以看出白泥中的晶体矿物主要是CaCO3,石灰石除了CaCO3以外,还含有少量的MgCa(CO3)2。它们中CaCO3的绝对含量,根据N2气氛下煅烧的失重曲线确定。以10℃/min的升温速率升温至500℃、850℃,分别保持10min、20min,认为样品在500~850℃区间内的失重量是由CaCO3的分解引起的,由此确定白泥和石灰石中CaCO3的质量分数分别是81.2%、95.5%。实验采用的白泥和石灰石颗粒粒径均小于100μm。
1.2 实验过程

表1 白泥和石灰石的化学成分(质量分数) 单位:%
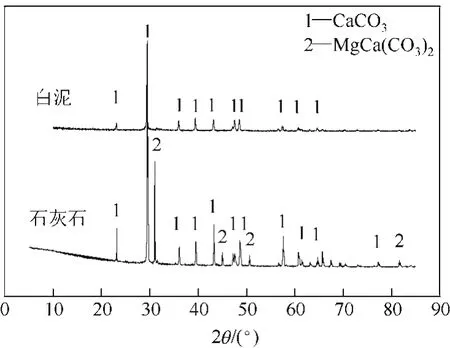
图1 白泥和石灰石的XRD分析
白泥及石灰石的煅烧和碳酸盐化实验均在热重台架中进行。采用石灰石煅烧/碳酸盐化循环捕集CO2的典型煅烧温度区间(850~950℃),将白泥和石灰石在N2气氛中进行煅烧实验。考虑到实际钙基吸附剂再生过程通常需要在高浓度CO2中进行以得到高纯度的CO2便于后续压缩和存储[6],本研究也在950℃、80%CO2(N2平衡)气氛下对白泥和石灰石分别进行了煅烧实验,在所有工况下,煅烧时间均设置为60min,样品质量均取0.5g。碳酸盐化实验中,首先将白泥或石灰石(0.5g)在850℃、N2气氛中煅烧15min(根据煅烧实验,15min内白泥和石灰石都能完全分解),然后,将反应器降温至预先设定的温度(600℃、650℃、700℃),将气氛切换至15%CO2(N2平衡),进行碳酸盐化实验,碳酸盐化反应持续的时间均设置为60min。实验过程中样品质量的变化被在线纪录,用于后续分析。对白泥/石灰石原样及850℃、N2气氛下煅烧15min的煅烧产物进行了比孔容和比表面积分析(N2吸附法),比孔容和比表面积分别通过BJH、BET模型计算。
2 结果与讨论
2.1 白泥和石灰石的煅烧分解特性
白泥和石灰石煅烧的失重曲线和所含CaCO3的分解率曲线分别如图2~图5所示。由于样品已预先烘干,且根据XRF结果,白泥和石灰石中Mg含量都很低,XRD显示白泥中不存在Ca(OH)2,可以忽略MgCO3和Ca(OH)2的分解,故样品失重可以认为全是CaCO3分解造成的。CaCO3分解率由式(1)计算。

式中,m0是样品的初始质量,g;m是热重记录的实时质量,g;x是CaCO3在样品中的质量分数,%;44和100分别是CO2和CaCO3的摩尔质量,g/mol。
对比图2~图5,白泥和石灰石在850~950℃的温度区间、N2气氛下分解特性基本一致,都是随着温度升高,分解速率加快。在相同的温度下,白泥的分解速率较石灰石快,石灰石在N2气氛中、分解温度为850℃、900℃、950℃时,发生完全分解对应的时间分别是1026s、888s、645s,相同条件下白泥中CaCO3发生完全分解所用的时间为640s、580s、395s,如图6所示。

图2 石灰石煅烧失重曲线

图3 石灰石中CaCO3的分解率曲线

图4 白泥煅烧失重曲线

图5 白泥中CaCO3的分解率曲线
分解温度为950℃时,高浓度CO2(80%)气氛下石灰石的分解速率较纯N2气氛显著下降(图2、图3),石灰石完全分解所用的时间由645s上升至1500s(图7)。而分解温度为950℃时,高浓度CO2(80%)气氛对白泥中CaCO3分解的抑制作用比对石灰石分解的抑制作用弱,白泥中CaCO3在80%CO2气氛下分解也相当迅速(图4、图5),实现最大分解率所用的时间仅由N2气氛下的395s上升至580s(图7)。在80% CO2气氛中煅烧时,白泥失重曲线在开始阶段(60~150s)有一段较N2气氛中煅烧异常的平缓阶段,如图4所示,为此进行了重复试验,但是都得到相似的实验现象,推测可能是由于白泥中的碱金属杂质与CO2反应使质量增加,对CaCO3分解导致的质量减少有一定的补偿效果,从而使失重曲线出现一段较平缓的区域,证据是在此条件下由失重量计算的CaCO3的分解率也是偏小的,只有92%左右,如图5所示。
实验表明在相同的条件下,白泥较石灰石具有更高的分解速率,有两种可能原因。一是白泥中碳酸钙的形成过程,类似于轻质碳酸钙的生产过程,都是Ca2+和在溶液中沉淀产生的。已有研究表明,轻质碳酸钙具有比天然石灰石大得多的比表面积[4-5],本文比表面积测试也显示,石灰石和白泥的比表面积分别是0.29m2/g、7.51m2/g(表2),试验结果与早期关于轻质碳酸钙和石灰石的分解特性的研究[9]结论一致,即相同条件下,轻质碳酸钙的分解速率比石灰石快得多。原因之二是白泥中的杂质促进了CaCO3的分解[10],与石灰石相比,白泥中Na、K、Si等杂质的含量高(表1),可能对CaCO3的分解具有促进作用。
较快的分解速率意味着白泥中CaCO3完全分解需要的煅烧时间短,而研究表明,煅烧时间过长,烧结现象明显加剧,导致碳酸盐化效率降低,尤其是在CO2存在的气氛下煅烧,这种现象更加明显[7-8]。另外考虑到工程实际,分解速率快也便于设计结构更加紧凑的反应器[6]。

图6 不同温度下CaCO3完全分解的时间
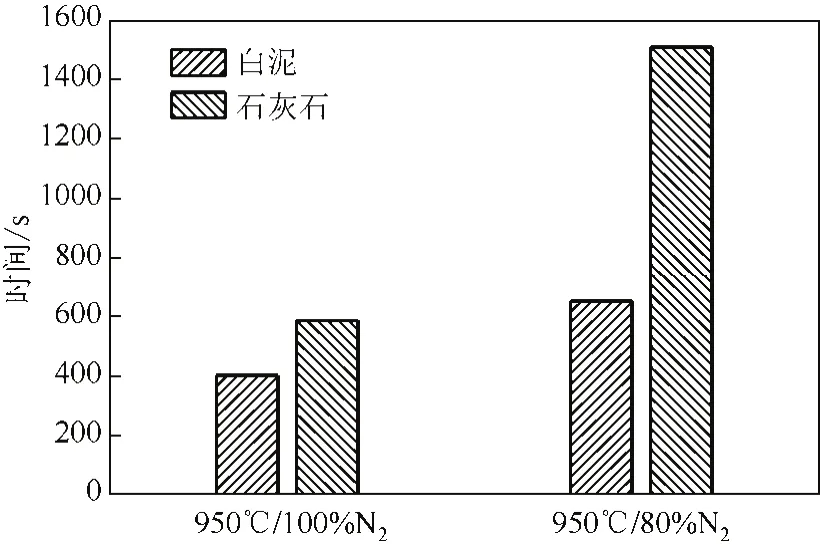
图7 不同气氛下CaCO3完全分解的时间

表2 白泥/石灰石及煅烧产物的比表面积和比孔体积分析
2.2 白泥和石灰石煅烧产物的碳酸盐化特性
CaO和CO2之间的气固反应,由两个阶段组成,即表面化学反应控制的快速反应阶段和CaCO3产物层扩散控制的慢速反应阶段[11-12]。CaO碳酸盐化反应应用于捕集CO2时,一般认为只有快速反应阶段具有实际意义,因为吸附剂通常只在炉内停留几分钟[6],但是为了更全面地研究白泥及石灰石煅烧产物碳酸盐化的动力学特性,本实验采用了足够长的碳酸盐化时间(60min)。碳酸盐化转化率根据公式(2)计算。

式中,m是热重实时记录的质量,g;mcal是白泥/石灰石样品煅烧至恒重时的质量,g;m0是白泥/石灰石的质量,g;44和100分别是CO2和CaCO3的摩尔质量,g/mol。
从碳酸盐化转化率曲线(图8)可以看出,白泥/石灰石煅烧产物的碳酸盐化特性十分相似,都是由两个阶段组成,即经历一个快速的反应阶段后,突然进入扩散控制阶段。碳酸盐化反应基本都是在快速反应阶段实现的,即使采用了60min的碳酸盐化反应时间,扩散阶段的碳酸盐化转化率所占比例仍然较低。图8显示,在不同温度条件下,白泥煅烧产物的快速碳酸盐化阶段在反应开始大约500s后基本就结束了,而石灰石则持续到1000s左右。考虑到在实际流化床条件下,传质传热进行得更迅速,碳酸盐化的反应速率可能会进一步提高。相同条件下(煅烧和碳酸盐化条件都相同),白泥煅烧产物的碳酸盐化转化率比石灰石煅烧产物低,可能原因是,白泥含有较多杂质(表1),因此在煅烧过程中经历了严重的烧结导致比表面积减少。比表面积和比孔体积分析(表2)提供了直接证据,石灰石煅烧产物的比表面积为17.13m2/g,较石灰石原样高得多,CaCO3分解释放CO2的过程中产生孔隙,使石灰石煅烧产物的比表面积和比孔体积增加。但是,白泥煅烧产物的BET比表面积(2.47m2/g)比白泥原样(7.51m2/g)有较大幅度的降低,很明显是由于样品的烧结引起的。
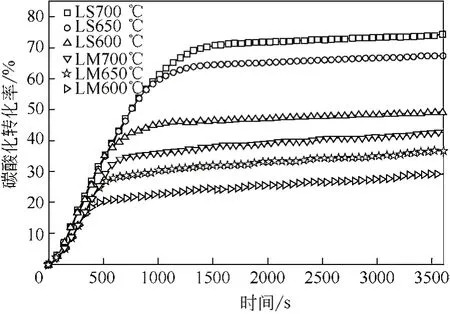
图8 温度对白泥/石灰石煅烧产物碳酸盐化转化率的影响
在温度600~700℃区间内,温度对白泥/石灰石煅烧产物碳酸盐化特性的影响规律是一致的,即碳酸盐化最终转化率随着温度升高呈现上升的趋势,但温度升高对于快速反应阶段的反应速率没有明显的影响,文献[12]也观察到类似的现象,原因在于快速反应阶段的反应速率对温度的依赖性不大。但是图8表明在较高温度下,相同样品快速碳酸盐化阶段能持续更长的时间。本质上讲,快速反应阶段到慢速反应阶段的转变是当CaCO3产物层达到一个临界厚度时发生的[13],较高的反应温度促进了向颗粒内部扩散和O2-向颗粒外部扩散[14],相当于增加了临界产物层的厚度,使快速阶段到慢速阶段转变时有更高的碳酸盐化转化率,而转变时间推迟。
本实验结果显示,白泥经历一次煅烧后,煅烧产物的碳酸盐化转化率比石灰石煅烧产物低,与前期李英杰等[2-3]的研究结论一致。但是李英杰等发现,白泥在煅烧/碳酸盐化循环中CO2捕集能力随循环次数增加衰减速度较石灰石慢得多,经历100次循环,白泥煅烧产物的碳酸盐化转化率仍然能够保持20%左右,而天然石灰石煅烧产物的碳酸盐化转化率则减少至7.5%左右。根据比孔容分析发现白泥煅烧产物的平均孔径更大(如表2所示),在循环煅烧/碳酸化过程中不易发生空隙阻塞和烧结[4-5],这可能是李英杰等的研究中白泥的循环特性比石灰石好的原因。
3 结 论
(1)在相同的煅烧温度下(850~950℃),白泥分解速率比石灰石快,可以减少高温煅烧时间。
(2)高浓度CO2气氛下白泥分解速率也比石灰石快得多,CO2煅烧气氛对白泥分解的抑制作用较石灰石弱。
(3)在600~700℃温度区间内,白泥与石灰石的煅烧产物表现出相似的碳酸盐化规律。碳酸盐化过程由快速反应阶段和慢速扩散阶段组成。一次煅烧/碳酸盐化循环中,白泥的碳酸盐化转化率低于石灰石。
(4)在600~700℃温度区间内,碳酸盐化温度几乎不影响碳酸盐化快速反应阶段的反应速率,但是能够延长快速反应阶段的持续时间,对于白泥和石灰石煅烧产物,升高反应温度有利于提高碳酸盐化转化率。
(5)白泥的比表面积高于石灰石,但是白泥煅烧产物的比表面积低于石灰石煅烧产物,可能是因为白泥中杂质的存在加剧了烧结。白泥煅烧产物较石灰石煅烧产物具有更大的平均孔径。
[1] 左文銮. 造纸苛化白泥的处理及应用研究[D].南京:南京理工大学,2012.
[2] Li Y,Liu C,Sun R,et al. Sequential SO2/CO2capture of calcium-based solid waste from the paper industry in the calcium looping process[J].Industrial & Engineering Chemistry Research,2012,51(49):16042-16048.
[3] Sun R,Li Y,Liu C,et al. Utilization of lime mud from paper mill as CO2sorbent in calcium looping process[J].Chemical Engineering Journal,2013,221:124-132.
[4] Gupta H,Fan L S. Carbonation-calcination cycle using high reactivity calcium oxide for carbon dioxide separation from flue gas[J].Industrial & Engineering Chemistry Research,2002,41(16):4035-4042.
[5] Iyer M V,Gupta H,Sakadjian B B,et al. Multicyclic study on the simultaneous carbonation and sulfation of high-reactivity CaO[J].Industrial & Engineering Chemistry Research,2004,43(14):3939-3947.
[6] Martínez I,Grasa G,Murillo R et al.Kinetics of calcination of partially carbonated particles in a Ca-looping system for CO2capture[J].Energy & Fuels,2012,26(2):1432-1440.
[7] Manovic V,Anthony E J. Parametric study on the CO2capture capacity of CaO-based sorbents in looping cycles[J].Energy & Fuels,2008,22(3):1851-1857.
[8] Sun P,Grace J,Lim C,et al. The effect of CaO sintering on cyclic CO2capture in energy systems[J].American Institute of Chemical Engineers Journal,2007,53(9):2432-2442.
[9] Sakadjian B B,Iyer M V,Gupta H,et al. Kinetics and structural characterization of calcium-based sorbents calcined under subatmospheric conditions for the high-temperature CO2capture process[J].Industrial & Engineering Chemistry Research,2007,46 (1):35-42.
[10] Malik W,Gupta D,Masood I,et al. Kinetic study of thermal decomposition of calcium carbonate in the presence of K2CO3and BaCO3[J].Journal of Materials Science Letters,1985,4(5):532-536.
[11] Lee D K. An apparent kinetic model for the carbonation of calcium oxide by carbon dioxide[J].Chemical Engineering Journal,2004,100 (1):71-77.
[12] Grasa G S,Abanades J C,Alonso M,et al. Reactivity of highly cycled particles of CaO in a carbonation/calcination loop[J].Chemical Engineering Journal,2008,137(3):561-567.
[13] Alvarez D,Abanades J C. Determination of the critical product layer thickness in the reaction of CaO with CO2[J].Industrial & Engineering Chemistry Research,2005,44(15):5608-5615.
[14] Bhatia S,Perlmutter D. Effect of the product layer on the kinetics of the CO2-lime reaction[J].American Institute of Chemical Engineers Journal,1983,29(1):79-86.
Investigation on calcination and carbonation performance of papermaking lime mud
HE Lanlan,YU Dunxi,ZENG Xianpeng,LÜ Weizhi,WU Jianqun,XU Minghou
(State Key Laboratory of Coal Combustion,Huazhong University of Science and Technology,Wuhan 430074,Hubei,China)
:Papermaking lime mud is an alkaline industrial waste,taking large land resources in landfill. The use of lime mud to capture CO2from the industry flue gas is one of the effective ways to solve the problems. However,some fundamental problems still need to be investigated. This paper compared the calcination of lime mud and limestone,and investigated the carbonation of the calcined products in a TGA reactor. The results showed a higher decomposition rate for lime mud than for limestone,leading to a shorter time for complete calcination. After the same calcination process (850℃,N2,15min),CaO derived from lime mud showed a lower carbonation conversion ratio than limestone. This was likely because of the lower specific surface area of CaO derived from lime mud. The influence of temperature on the carbonation performance of the calcinates derived from lime mud and limestone was similar. Increasing temperature in the range of 600—700℃ did not have insignificant effects on the carbonation rate in the fast chemical reaction-controlled carbonation stage. However,it lengthened the fast carbonation stage and resulted in a higher ultimate carbonation conversion ratio.
lime mud;CO2capture;sorbent;waste treatment;decomposition properties;carbonation properties
TQ 110.9
A
1000-6613(2014)11-3095-06
10.3969/j.issn.1000-6613.2014.11.043
2014-04-17;修改稿日期:2014-06-30。基金项目:国家自然科学基金(51376071)及新世纪优秀人才支持计划(NCET-11-0192)项目。
何兰兰(1989—),女,硕士研究生,主要从事CO2捕集研究联系人:于敦喜,教授,博士生导师,主要研究内容为富氧燃烧技术、燃煤颗粒物污染与控制、二氧化碳捕集与资源化利用。E-mail yudunxi@hust.edu.cn。。
