低氧诱导因子-2α基因沉默对骨肉瘤细胞株MG-63生物学行为的影响
2014-07-05林珊珊崔春萍谢明均
朱 波 林珊珊 崔春萍 谢明均△
低氧诱导因子-2α基因沉默对骨肉瘤细胞株MG-63生物学行为的影响
朱 波1林珊珊2崔春萍3谢明均1△
目的 探讨低氧诱导因子-2α(HIF-2α)基因沉默对低氧状态下骨肉瘤MG-63细胞的影响。方法Western Blot检测MG-63细胞HIF-2α表达。利用小干扰RNA(siRNA)获得MG-63/siHIF-2α(siHIF-2α)细胞,阴性对照为MG-63/scramble(NC)细胞。Western Blot检测MG-63、NC和siHIF-2α细胞中HIF-2α、血管内皮生长因子(VEGF)、p-Erk/Erk及Mcl-1的表达。低氧下培养NC和siHIF-2α细胞,MTS试剂检测细胞活性,划痕迁移试验检测迁移能力,克隆集落形成试验检测集落形成率,裸鼠皮下移植瘤试验检测体内肿瘤生长情况。结果低氧可诱导MG-63细胞的HIF-2α蛋白表达,并呈时间依赖性(F=2 037.412,P<0.001)。低氧下siHIF-2α细胞的HIF-2α表达低于NC细胞(P<0.01)。低氧12 h和24 h,siHIF-2α组细胞活性均低于NC组,相对划痕宽度均大于NC组(P<0.05或P<0.01)。1 000~5 000细胞种植数的siHIF-2α组的集落形成率均小于NC组(P<0.05或P<0.01)。低氧下siHIF-2α细胞的VEGF、p-Erk/Erk和Mcl-1表达均低于NC细胞(P<0.01)。裸鼠皮下移植瘤siHIF-2α组肿瘤体积、质量和密度均小于NC组(P<0.01)。结论阻断HIF-2α信号通路可作为骨肉瘤临床治疗的新策略。
骨肉瘤;细胞系,肿瘤;RNA,小分子干扰;基因沉默;肿瘤移植;小鼠,近交BALB C;低氧诱导因子-2α
骨肉瘤是原发性骨恶性肿瘤中常见的实体肿瘤,恶性程度高,生长速度快,易引发内部低氧微环境,导致低氧诱导因子(HIF)富集。HIF可促进肿瘤血管生成[1]、能量代谢[2]、细胞生长、侵袭转移和化疗耐药等过程[3]。但目前有关HIF-2α对肿瘤作用的研究尚少见相关报道[4]。有研究认为HIF-2α参与了肿瘤发生发展的过程[5],但其在骨肉瘤中的作用研究甚少。本研究旨在通过小干扰RNA(siRNA)基因沉默技术观察HIF-2α基因沉默对骨肉瘤细胞系MG-63增殖、迁移、侵袭等作用的影响。
1 材料与方法
1.1 材料 改良杜氏伊格尔(DMEM)培养基、胰酶及聚凝胺购自Sigma公司;胎牛血清(杭州四季青公司);MTS溶液(Promega公司);兔抗人HIF-2α抗体、血管内皮生长因子(VEGF)多克隆抗体、兔抗人胞外信号调节激酶(Erk)抗体、兔抗人磷酸化Erk(p-Erk)抗体、鼠抗人髓细胞白血病蛋白(Mcl-1)抗体(CST公司);鼠抗人GAPDH抗体、辣根过氧化物酶(HRP)标记的羊抗兔二抗、HRP标记的羊抗鼠二抗(北京博奥森公司);RIPA蛋白裂解液及聚氰基丙烯酸正丁酯(BCA)蛋白定量试剂盒购自Thermo公司;人骨肉瘤细胞株MG-63购自中科院上海细胞库。12只体质量25 g左右,4周龄Balb/C雄性小鼠购自北京维通利华公司。
1.2 方法
1.2.1 细胞培养 选用人骨肉瘤细胞株MG-63和siRNA转染后获得的MG-63/siHIF-2α(siHIF-2α)和MG-63/scramble (NC)细胞,培养于10%胎牛血清(FBS)的DMEM培养基中,置于37℃,5%CO2及饱和湿度环境中培养。1%O2,5%CO2,以及94%N2的低氧培养箱(Thermo公司)模拟肿瘤内部低氧微环境。
1.2.2 Western BlotMG-63细胞低氧培养0 h、6 h、12 h、24 h;MG-63、NC和siHIF-2α细胞低氧培养24 h。以RIPA裂解细胞,提取蛋白。蛋白加入5×Loading buffer配制成20 μL,100℃水浴10 min,12 000 r/min离心30 s后以12%的聚丙烯胺分离转至PVDF膜上,5%脱脂牛奶常温封闭2 h,一抗4℃震荡过夜,TBST洗膜3次,每次10 min,二抗常温孵育1 h,最后加发光底物于暗室中用胶片曝光。
1.2.3 siRNA转染 针对人HIF-2α的小干扰RNA用于沉默MG-63细胞的HIF-2α,序列为:上游5′-CAACCTGCAGCCTCAGTGTATC-3′,下游5′-CACCACGTCGTTCTTCTCGAT-3′;小干扰RNA scramble siRNA作为阴性对照,序列为:上游5′-UUCUCCGAACGUGUCACGUTT-3′,下游5′-ACGUGACACGUUCGGAGAATT-3′。根据磷酸钙转染法[6]获得siRNA病毒。细胞培养基中先加入5 mg/L聚凝胺,再加入10倍于细胞数的siRNA逆转录病毒混匀,培养8 h后换液。获得MG-63/ siHIF-2α(siHIF-2α)和MG-63/scramble(NC)细胞。72 h后,在荧光显微镜下观察。
1.2.4 细胞活性MTS法检测 MG-63细胞接种于96孔板,于低氧处理12 h、24 h时分别加入MTS 20 μL/孔,孵育1.5~2 h,酶标仪(BioTek公司)于波长490 nm处测定光密度(OD)值。细胞活性(%)=(siHIF-2α组OD值/NC组OD值)×100%。
1.2.5 划痕迁移实验 细胞接种于6孔板,生长密度达90%时,以20 μL枪头尖在孔底轻划痕,于0 h、12 h、24 h观察划痕愈合情况,以Image Processing and analysis in Java(Image J)2X软件测量划痕宽度。相对划痕宽度=观察点划痕宽度/原始划痕宽度。
1.2.6 集落形成试验 NC和siHIF-2α细胞数分别以1×103、2×103、3×103、4×103、5×103的数量种入6孔板,低氧培养,每3 d换液1次。3周后,4%甲醛固定,结晶紫染色,×20倍显微镜下观察计数。
1.2.7 裸鼠皮下移植瘤实验 12只Balb/C雄性小鼠随机分为2组。收集siHIF-2α和NC细胞约1×107个,调整为0.3 mL细胞悬液接种于裸鼠背部皮下,4周后处死裸鼠,称取肿瘤质量(g),并计算肿瘤体积(cm3)。肿瘤体积=(长径×短径2)/2。
1.3 统计学方法 采用SPSS 13.0统计分析软件,数据采用均数±标准差(±s)表示,2组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较选用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 低氧对MG-63细胞HIF-2α表达的影响 0、6、 12及24 h的HIF-2α表达水平分别为57.74±5.43、1 073.26±35.11、1 675.63±38.97、1 821.88±31.63(F= 2 037.412,P<0.001),0 h与6 h相比,6 h与12 h相比,12 h与24 h相比,HIF-2α表达水平差异均有统计学意义(均P<0.001)。随着低氧时间延长,HIF-2α蛋白表达量增加,见图1。

Fig.1 Comparison of the HIF-2α expression level in MG-63 cells under hypoxia图1 MG-63细胞HIF-2α表达水平的比较
2.2 siRNA病毒对HIF-2α基因的沉默效率 siRNA病毒转染后,NC和siHIF-2α组细胞生长状态良好,荧光表达量尚可,见图2。MG-63组、NC组和si-HIF-2α组的HIF-2α表达水平分别为3 083.26± 116.35、2 920.61±65.33及752.22±29.01(F=817.462,P<0.001),其中MG-63组和NC组HIF-2α表达水平差异不明显(P=0.321),NC组表达水平高于siHIF-2α组(P<0.001),siHIF-2α组的HIF-2α蛋白表达受抑制,见图3。
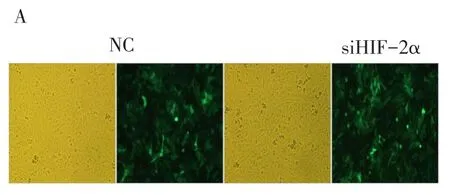
Fig.2 Representative images of MG-63 cells transfected by lentivirus with siHIF-2α(siHIF-2α)or scramble(NC)siRNA(×400)图2 NC组和siHIF-2α组细胞的镜下图及荧光图(×400)
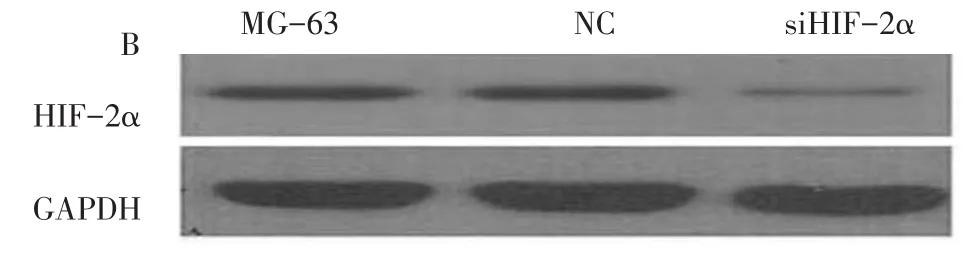
Fig.3 HIF-2α protein expression in MG-63,NC and siHIF-2α cells under hypoxia condition图3 HIF-2α基因沉默对HIF-2α表达的影响
2.3 HIF-2α基因沉默对低氧环境MG-63细胞的影响 NC组12 h和24 h时细胞活性均高于siHIF-2α组,而相对划痕宽度均低于siHIF-2α组(P<0.05或P<0.01),见表1。NC组于不同种植细胞数下的克隆集落形成率均高于siHIF-2α组(P<0.05或P<0.01),见表2。低氧环境下培养24 h后,MG-63组和NC组的VEGF、p-Erk/Erk和Mcl-1表达水平差异不明显(均P>0.05),而NC组的VEGF、p-Erk/Erk和Mcl-1表达水平均高于siHIF-2α组(均P<0.001),见表3、图4。
Tab.1 Comparation of cell viability and relative scratch width of NC and siHIF-2α cells表1 NC组和siHIF-2α组细胞活性及相对划痕宽度比较 (n=3,±s)

Tab.1 Comparation of cell viability and relative scratch width of NC and siHIF-2α cells表1 NC组和siHIF-2α组细胞活性及相对划痕宽度比较 (n=3,±s)
*P<0.05,**P<0.01
组别NC组siHIF-2α组t细胞活性(%) 12 h 100.00±4.91 77.72±7.15 4.449*24 h 100.00±3.33 72.33±2.99 10.710**相对划痕宽度12 h 0.78±0.03 0.95±0.02 8.167**24 h 0.21±0.01 0.78±0.02 44.150**
Tab.2 Comparation of clone formation rate(%)of NC and siHIF-2α cells at different cell counts表2 NC组和siHIF-2α组在不同种植细胞数下克隆集落形成率比较 (n=3,%,±s)

Tab.2 Comparation of clone formation rate(%)of NC and siHIF-2α cells at different cell counts表2 NC组和siHIF-2α组在不同种植细胞数下克隆集落形成率比较 (n=3,%,±s)
*P<0.05,**P<0.01
组别NC组siHIF-2α组t 1 000 2.57±0.25 1.02±0.15 9.208**2 000 2.75±0.18 1.17±0.27 8.433**3 000 2.76±0.28 1.35±0.22 6.858**4 000 2.93±0.39 1.44±0.19 5.949*5 000 3.91±0.40 1.98±0.27 6.927**
Tab.3 Comparation of VEGF,p-Erk/Erk and Mcl-1 expression in MG-63,NC and siHIF-2α cells表3 MG-63组、NC组和siHIF-2α组的VEGF、p-Erk/Erk及Mcl-1表达比较(n=3,±s)

Tab.3 Comparation of VEGF,p-Erk/Erk and Mcl-1 expression in MG-63,NC and siHIF-2α cells表3 MG-63组、NC组和siHIF-2α组的VEGF、p-Erk/Erk及Mcl-1表达比较(n=3,±s)
**P<0.01;a与NC组比较,P<0.001
组别MG-63组NC组siHIF-2α组F VEGF 2 728.08±276.22 2 722.53±259.78 593.29±113.05a87.098**p-Erk/Erk 2 681.69±75.75 2 457.01±341.58 1 013.80±56.95a58.672**Mcl-1 1 374.16±21.82 1 382.75±32.62 592.14±12.23a1 280.843**

Fig.4 VEGF,p-Erk/Erk and Mcl-1 protein expressions were determined by Weatern blot under hypoxia condition图4 VEGF、p-Erk/Erk及Mcl-1蛋白表达的Western Blot检测结果
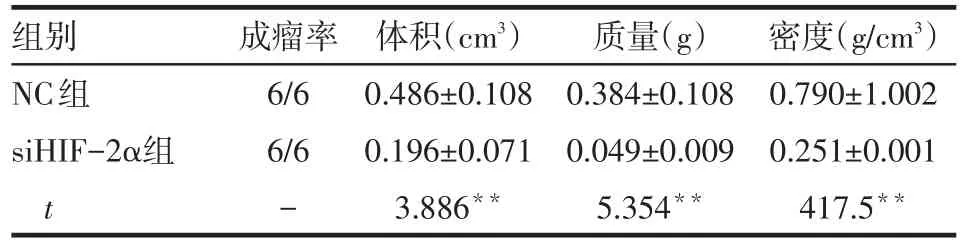
2.4HIF-2α基因沉默对裸鼠皮下移植瘤的影响 siHIF-2α组瘤体体积、质量和密度均小于NC组,见表4、图5。
Tab.4 Comparation of size,weight and density of NC and siHIF-2α xenograft tumors表4 NC组和siHIF-2α组皮下移植瘤体积、质量和密度比较 (n=6,±s)
Tab.4 Comparation of size,weight and density of NC and siHIF-2α xenograft tumors表4 NC组和siHIF-2α组皮下移植瘤体积、质量和密度比较 (n=6,±s)
**P<0.01
组别NC组siHIF-2α组t成瘤率6/6 6/6-体积(cm3)0.486±0.108 0.196±0.071 3.886**质量(g)0.384±0.108 0.049±0.009 5.354**密度(g/cm3)0.790±1.002 0.251±0.001 417.5**
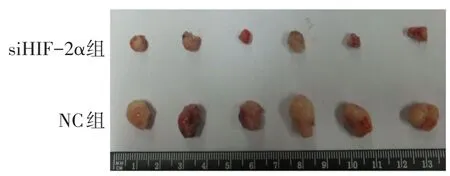
Fig.5 Images of xenograft tumors图5 裸鼠皮下移植瘤
3 讨论
骨肉瘤侵袭能力较强,容易转移到肺等重要器官,预后较差。发生肺部转移的骨肉瘤患者5年生存率较低[7]。通常情况下,肿瘤内部的低氧微环境会促使肿瘤细胞的生物学行为向恶性方向转化。HIF是低氧环境中基因转录、信息传递的重要途径[8]。在骨肉瘤中,HIF-2α早于HIF-1α激活下游靶基因[9]。
本研究显示,随着低氧时间延长,HIF-2α蛋白表达量呈增加趋势,证实HIF-2α蛋白表达与低氧具有一定的时间依赖性,表明低氧条件下能够成功地诱导MG-63细胞中HIF-2α的表达。小RNA干扰技术以下调HIF-2α表达实验结果显示,MG-63组和NC组HIF-2α表达水平差异不明显,NC组表达水平高于siHIF-2α组,表明HIF-2α基因沉默效果良好。MTS检测结果和划痕迁移实验结果显示,在低氧12 h和24 h时,NC组的细胞活性均高于siHIF-2α组,而相对划痕宽度均低于siHIF-2α组,表明HIF-2α基因沉默可显著地抑制MG-63细胞在低氧环境下的细胞存活和迁移能力。克隆集落形成试验结果显示,各个种植细胞数的siHIF-2α细胞的克隆集落形成率均小于NC细胞,表明HIF-2α基因沉默显著地抑制骨肉瘤细胞在低氧状态下的增殖能力。这提示HIF-2α很可能是骨肉瘤肿瘤细胞适应低氧微环境,并发生生物学行为恶化的关键因子,与相关研究结果一致[10]。Ben-Shoshan等[11]研究亦认为,HIF-2α可作用于c-Myc下游靶基因,从而促进肿瘤细胞周期进程和低氧状态下的细胞增殖。
VEGF为目前已知的作用最强的血管生成因子之一,是广泛转移性恶性疾病的重要原因[11]。Erk通路可促进肿瘤细胞的存活[12],Mcl-1蛋白是Bcl-2家族的成员,具有抗凋亡的作用[13]。本研究显示,si-HIF-2α组较NC组VEGF、p-Erk/Erk和Mcl-1表达水平均降低,表明HIF-2α基因沉默可通过下调VEGF而抑制骨肉瘤血管形成,也可抑制Erk磷酸化而抑制骨肉瘤细胞存活,还可抑制Mcl-1促进骨肉瘤细胞凋亡,进而抑制骨肉瘤的发生发展。本研究显示,siHIF-2α组瘤体的体积、质量和密度均小于NC组,提示HIF-2α基因沉默很可能极大地抑制了肿瘤细胞内各种蛋白的合成分泌,或者抑制了肿瘤瘤体内毛细血管的生成,从而导致瘤体内血浆蛋白的减少。进一步证实HIF-2α基因沉默打破了骨肉瘤细胞对低氧微环境的适应能力,对骨肉瘤的生长具有显著的抑制作用。
综上所述,低氧环境可诱导HIF-2α的表达,HIF-2α可能是骨肉瘤发生发展的关键因子,而阻断HIF-2α信号通路有可能成为临床治疗骨肉瘤的另一重要手段和策略。
[1]Skuli N,Simon MC.HIF-1α versus HIF-2α in endothelial cells and vascular functions:Is there a master in angiogenesis regulation [J]?Cell Cycle,2009,8(20):3252-3254.
[2]Skuli N,Liu L,Runge A,et al.Endothelial deletion of hypoxia-inducible factor-2α(HIF-2α)alters vascular function and tumor angiogenesis[J].Blood,2009,114(2):469-477.
[3]Loboda A,Jozkowicz A,Dulak J.HIF-1 and HIF-2 transcription factors—similar but not identical[J].Mol cells,2010,29(5):435-442.
[4]Semenza GL.Hypoxia-inducible factors:mediators of cancer progression and targets for cancer therapy[J].Trends Pharmacol Sci, 2012,33(4):207-214.
[5] 隋文文,张维东.缺氧诱导因子促进肿瘤血管生成的研究[J].国际肿瘤学杂志,2013,40(6):416-418.
[6]李华,刘维全,王太一,等.基因导入的脂质体转染法和磷酸钙转染法之比较[J].中国实验动物学杂志,2005,10(2):65-68.
[7]张志宏,龙新华,刘志礼,等.下调HER2磷酸化水平对骨肉瘤细胞U2-OS体外增殖转移的抑制作用研究[J].天津医药,2014,42 (1):1-4.doi:10.3969/j.issn.0253-9896.2014.01.001.
[8]Kaelin WG.How oxygen makes its presence felt[J].Genes Dev, 2002,16(12):1441-1445.
[9] Knowles HJ,Schaefer KL,Dirksen U,et al.Hypoxia and hypoglycaemia in Ewing's sarcoma and osteosarcoma:regulation and phenotypic effects of Hypoxia-Inducible Factor[J].BMC cancer,2010,10 (1):372.
[10]Bertout JA,Majmundar AJ,Gordan JD,et al.HIF2α inhibition promotes p53 pathway activity,tumor cell death,and radiation responses[J].Pro Nat Acad Sci,2009,106(34):14391-14396.
[11]Ben-Shoshan J,Schwartz S,Luboshits G,et al.Constitutive Expression of HIF-1α and HIF-2α in Bone Marrow Stromal Cells Differentially Promotes Their Proangiogenic Properties[J].Stem Cells, 2008,26(10):2634-2643.
[12]Fang Z,Tang Y,Jiao W,et al.Nitidine chloride induces apoptosis and inhibits tumor cell proliferation via suppressing ERK signailing pathway in renal cancer[J].Food Che Toxicol,2014,66:210-216.
[13]Faber AC,Coffee EM,Costa C,et al.mTOR Inhibition Specifically Sensitizes Colorectal Cancers with KRAS or BRAF Mutations to BCL-2/BCL-XL Inhibition by Supressing MCL-1[J].Cancer discov, 2014,4(1):42-52.
(2013-11-25收稿 2014-02-20修回)
(本文编辑 陆荣展)
Effect of Hypoxia-Inducible Factor(HIF)-2 Alpha Silencing on Osteosarcoma MG-63 Cells
ZHU Bo1,LIN Shanshan2,CUI Chunping3,XIE Mingjun1
1 Department of General Surgery,2 Department of Rehabilitation,the First People’s Hospital of Yibin, Sichuan 644000,China;3 Radiation Medicine and Radiation of Military Medical College Institute XIE Mingjun,E-mail:527121032@qq.com
ObjectiveTo investigate the effect of HIF-2a silencing by transfection of siRNA into MG-63 cells under hypoxia.MethodsHIF-2α expression level in MG-63 cells under hypoxia was determined by Western Blot.Small interfering RNA(siRNA)was used to construct MG-63/siHIF-2α(siHIF-2α)cells and control MG-63/scramble(NC)cells. The expression levels of HIF-2α,Vascular endothelial growth factor(VEGF),p-Erk/ErK and Mcl-1 in MG-63,NC and si-HIF-2α cells was determined by Western Blot.NC and siHIF-2α cells were cultured under hypoxia.Cell viability was assessed by MTT assay.Migration was identified by scratch migration assay.Tumor formation was identified by clone formation assay.Nude mouse subcutaneous xenograft model was used to investigate tumor development in vivo.ResultsHypoxia improved HIF-2α expression in MG-63 cells in a time-dependent manner(F=2 037.412,P<0.001).HIF-2α expression under hypoxia in siHIF-2αcells was lower than that in NC cells(P<0.01).Cell viability of siHIF-2α cells under hypoxia for 12 h and 24 h were lower than that in NC cells(P<0.05 or P<0.01).The relative width of scratch in siHIF-2α group under hypoxia for 12 h and 24 h were larger than that in NC group(P<0.01 or P<0.01).When cell counts reach 1 000-5 000,the clone formation rates of siHIF-2α cells were lower than that in NC cells(P<0.05 or P<0.01).The expression of VEGF,p-Erk/Erk and Mcl-1 protein under hypoxia in siHIF-2α cells was lower than that in NC cells(P<0.01).Tumor sizes,weights and density of siHIF-2α group in nude mice were suppressed compared with those in NC group(P<0.01).ConclusionBlocking HIF-2α signal pathway warrants its investigation as a potential strategy in osteosarcoma treatment.
osteosarcoma;cell line,tumor;RNA,small interfering;gene silencing;neoplasm transplantation;mice, inbred BALB C;hypoxia-inducible factor 2 alpha
R738.1,R349.5
A
10.3969/j.issn.0253-9896.2014.08.012
1宜宾市第一人民医院普外科(邮编644000),2康复医学科;3军事医学科学院放射医学与辐射研究所△
E-mail:527121032@qq.com
