GSTM1、GSTT1及GSTP1(rs1695)基因多态性与乳腺癌蒽环和(或)紫杉类药物化疗血液毒性关系的研究
2014-07-05刘新兰赵艳姣
刘新兰 赵艳姣 黄 英 姜 敏
GSTM1、GSTT1及GSTP1(rs1695)基因多态性与乳腺癌蒽环和(或)紫杉类药物化疗血液毒性关系的研究
刘新兰 赵艳姣 黄 英 姜 敏
目的 研究乳腺癌外周血中谷胱甘肽转硫酶(GST)M1、GSTT1和GSTP1(rs1695)基因多态性与乳腺癌患者采用蒽环类和(或)紫杉类药物化疗发生血液毒性的关系。方法应用多重PCR技术(M-PCR)和高分辨熔解曲线技术(HRM)检测3个基因在252例女性乳腺癌患者外周血中的基因多态性。结果采用紫杉类、蒽环联合紫杉类药物化疗,携带GSTP1(rs1695)AG/GG的患者是发生Ⅲ~Ⅳ度中性粒细胞减低的危险因素(OR=6.111,95%CI 1.526~24.469,P<0.05和OR=9.257,95%CI 2.903~29.522,P<0.01),而GSTM1(+)与GSTM1(-)、GSTT1(+)与GSTT1(-)患者Ⅲ~Ⅳ度血液毒性的发生率差异均无统计学意义;采用蒽环类药物化疗,GSTM1(+)和GSTM1(-)、GSTT1(+)和GSTT1(-)、GSTP1AA和GSTP1AG/GG患者Ⅲ~Ⅳ度血液毒性发生率差异均无统计学意义(P>0.05)。结论GSTP1(rs1695)基因多态性可作为预测乳腺癌患者采用紫杉类药物化疗发生中性粒细胞毒性的标志。
乳腺肿瘤;抗肿瘤联合化疗方案;谷胱甘肽转移酶;多态现象,遗传;聚合酶链反应;谷胱甘肽转硫酶;化疗血液毒性;高分辨熔解曲线技术
蒽环类和紫杉类药物是乳腺癌化疗的基石用药,二者可显著延长乳腺癌患者的生存期,具有良好的疗效及优势,但在应用时受到其不良反应的限制。且临床中发现,即使肿瘤分期、病理类型及治疗方案皆相同的患者,化疗不良反应的程度也可能不同,差异的原因与单核苷酸多态性(SNP)有关。研究表明,谷胱甘肽转硫酶(GST)M1、GSTT1和GSTP1 (rs1695)基因具有多态性,GSTM1和GSTT1缺失基因型(-)编码无活性的酶;GSTP1第5外显子上A313→G改变(SNP位点rs1695),使其编码的酶的活性降低甚至消失,引起化疗疗效及毒性的差异[1-2]。本研究通过检测252例乳腺癌患者3种酶的基因多态性,分析其与蒽环类和(或)紫杉类药物化疗血液毒性的关系,探讨3个基因多态性作为预测乳腺癌患者发生血液毒性的可行性,以期达到个体化及安全有效用药的目的。
1 资料与方法
1.1 一般资料 收集2011年1月—2013年1月在宁夏医科大学总医院肿瘤医院就诊、均经病理形态学和免疫组织化学确诊、病例资料完整的女性乳腺癌患者252例,年龄30~72岁,中位年龄48岁。按照2011年美国国立综合癌症网络(NCCN)指南进行临床分期:Ⅰ期53例,Ⅱ期50例,Ⅲ期21例,Ⅳ期128例。
1.2 方法
1.2.1 标本采集和DNA提取 所有患者化疗前抽取外周静脉血5 mL,乙二胺四乙酸(EDTA)抗凝,全血基因组DNA抽提采用美国OMEGA公司的3392-01试剂盒。Nanodrop2000检测样本DNA浓度和纯度,统一标定模板DNA浓度为25 mg/L,经电泳检测,电泳条带应>10 kb且无明显降解,分装后置于-80℃冰箱保存备用。
1.2.2 引物设计 采用GenBank已知序列设计引物,引物由上海生物技术有限公司合成,引物序列见表1。

Tab.1 Primer sequences of glutathione s-transferase M1,T1 and P1(rs1695)表1 GSTM1、GSTT1和GSTP1(rs1695)基因引物序列
1.2.3 多重PCR技术(M-PCR) 采用M-PCR技术检测GSTM1和GSTT1基因多态性,β-Globin为内对照。M-PCR的反应总体系为50 μL,其中0.1 μmol/L的GSTM1、GSTT1和β-Globin上、下游引物各1 μL,PCR-master-mix 25μL,无菌双蒸水(ddH2O)17 μL,DNA模板2 μL。PCR反应条件:95℃预变性5 min,95℃变性45 s、58℃退火45 s、72℃延伸45 s,共35次循环,最后72℃延伸7 min,结束反应。PCR产物经1.5%琼脂糖凝胶电泳分离,电压为5 V/cm,电泳35 min,后在美国Bio-Rad Gel Doc 200凝胶成像系统下观察,摄像并记录结果。经PCR扩增、电泳后,缺失基因型(-)不被扩增,电泳无条带显示。内对照β-Globin片段电泳表现为268 bp条带,GSTM1(+)为215 bp,GSTT1(+)为480 bp。
1.2.4 高分辨熔解曲线技术(HRM) 采用定量PCR为基础的HRM技术检测GSTP1(rs1695)A313G位点的基因型。HRM反应总体系为10 μL,其中0.1 μmol/L上、下游引物各0.25 μL,Eva荧光素0.5 μL,PCR-master-mix 5 μL,ddH2O 2 μL,DNA模板2 μL。HRM反应条件:(1)扩增阶段。95℃预变性2 min,95℃变性10 s,61℃退火10 s,72℃延伸7 min,30个循环。(2)熔解曲线阶段。数据采集从65℃开始,按照0.25℃/s的速度升温,期间每隔0.04 s采集1次图像,升温至95℃结束反应。Roche 480软件分析输出实验结果。根据HRM检测的不同基因型随机抽取10%的样本送至南京金斯瑞生物技术有限公司进行基因测序,以验证HRM技术检测结果的准确性。
1.2.5 化疗方案 所有患者均接受以蒽环类和(或)紫杉类药物为基础的化疗方案,其中以蒽环类为主方案化疗124例(AC/CAF,环磷酰胺+阿霉素/5-Fu方案);以紫杉类为主方案化疗58例(TX,紫杉醇+卡培他滨),以蒽环联合紫杉类方案化疗70例(T/DA,紫杉醇/多西紫杉醇+阿霉素)。阿霉素剂量为50~60 mg/m2静脉注射,第1天;紫杉醇剂量为135~175 mg/m2或多西紫杉醇(D)60 mg/m2静脉滴注,第1天;卡培他滨1 000 mg/m2口服第1~14天。
1.2.6 毒性判定 化疗2个周期后,对252例患者进行化疗血液学毒性判定,参照CTCAE(Common Terminology Criteria for Adverse Events)v3.0标准[3],分为0、Ⅰ、Ⅱ、Ⅲ和Ⅳ度。
1.3 统计学方法 所有数据经SPSS 11.5统计软件进行分析。基因型分布采用Hardy-Weinberg遗传平衡检验;χ2检验及Fisher确切概率法分析不同基因型与乳腺癌患者化疗发生血液毒性的关系;非条件Logistic回归模型计算比值比(OR)和95%可信区间(CI)。以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌中GSTM1、GSTT1和GSTP1(rs1695)基因多态性分布 252例乳腺癌中,GSTM1和GSTT1基因均有非缺失型(+)和缺失型(-)2种分型,缺失基因型系基因发生片段缺失后,经PCR扩增电泳后无目的条带产生;其中GSTM1(-)占57.1%(144/252);GSTT1(-)占29.4%(74/252)。GSTP1(rs1695)基因有AA、AG和GG 3种分型,经Hardy-Weinberg遗传平衡检验,证实本组患者GSTP1(rs1695)基因型分布符合遗传平衡定律,具有群体代表性,见表2。GSTM1 和GSTT1基因分型电泳结果见图1,GSTP1(rs1695)基因多态性分布图及测序结果见参考文献[4]中图1、2。
2.2 GSTM1、GSTT1和GSTP1(rs1695)基因多态性与乳腺癌患者接受不同方案化疗血液毒性的关系
2.2.1 蒽环类药物为主化疗 124例患者中,GSTM1 (+)和GSTM1(-)、GSTT1(+)和GSTT1(-)、GSTP1AA 和GSTP1AG/GG患者Ⅲ~Ⅳ度血液毒性的发生率差异均无统计学意义(均P>0.05),见表3。
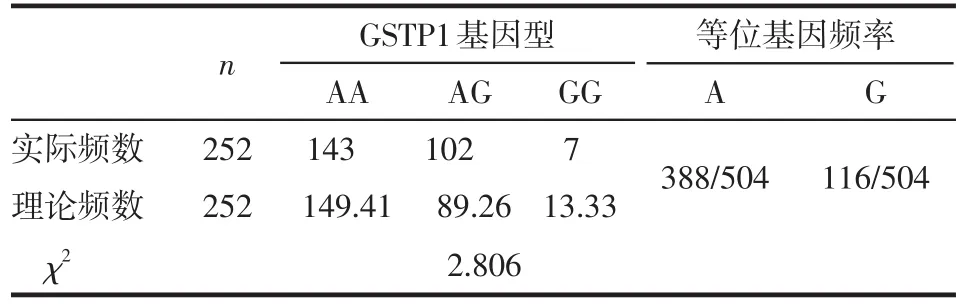
Tab.2 Genotype distribution and allele frequency of GSTP1(rs1695)表2 GSTP1(rs1695)基因型分布及等位基因频率

Fig.1 GSTM1 and GSTT1 gene amplification products图1 GSTM1和GSTT1基因扩增产物电泳结果图

Tab.3 Association between GSTM1,GSTT1 and GSTP1 (rs1695)gene polymorphisms with hematologic toxicities of breast cancer patients receiving Anthracycline-based chemotherapy表3 乳腺癌患者蒽环类药物化疗血液毒性与GSTM1、GSTT1和GSTP1(rs1695)基因多态性的关系 例
2.2.2 紫杉类药物为主化疗 58例患者中,发生0~Ⅱ度中性粒细胞减低毒性占31.03%(18/58),发生Ⅲ~Ⅳ度中性粒细胞减低毒性占68.97%(40/58)。GSTP1AG/GG携带者Ⅲ~Ⅳ度中性粒细胞减低发生率高于GSTP1AA携带者(P<0.01)。GSTM1(+)和GSTM1(-)、GSTT1(+)和GSTT1(-)患者Ⅲ~Ⅳ度血液毒性的发生率差异均无统计学意义;GSTP1AA和GSTP1AG/GG患者Ⅲ~Ⅳ度白细胞减低、血红蛋白减低及血小板减低的发生率差异均无统计学意义,见表4。

Tab.4 Association between 3 gene polymorphisms with hematologic toxicities of breast cancer patients receiving Paclitaxel-based chemotherapy表4 乳腺癌患者紫杉类药物化疗血液毒性与GSTM1、GSTT1和GSTP1(rs1695)基因多态性的关系 例
分别以上述3个基因为自变量[GSTM1(+)=0,GSTM1(-)=1;GSTT1(+)=0,GSTT1(-)=1;GSTP1AA=0,GSTP1AG/GG=1],上述化疗中性粒细胞减低为因变量(0~Ⅱ=0,Ⅲ~Ⅳ=1),行非条件Logistic回归分析,结果显示采用紫杉类药物化疗患者携带GSTP1 AG/GG基因型是发生Ⅲ~Ⅳ度中性粒细胞减低的危险因素,见表5。
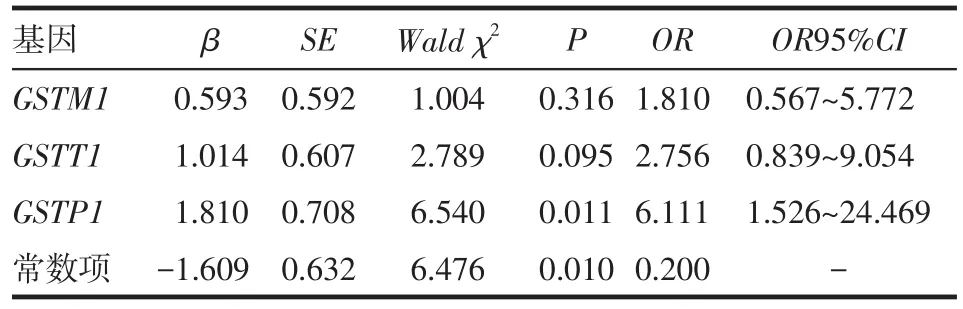
Tab.5 Unconditional Logistic regression of 3 gene polymorphisms with neutropenia of breast cancer patients receiving Paclitaxel-based chemotherapy表5 3个基因多态性与乳腺癌患者接受紫杉类药物化疗血液毒性关系的非条件Logistic回归分析
2.3 蒽环联合紫杉类药物化疗 70例患者中发生0~Ⅱ度中性粒细胞减低毒性占45.7%(32/70),发生Ⅲ~Ⅳ度中性粒细胞减低毒性占54.3%(38/70)。GSTP1AG/GG携带者Ⅲ~Ⅳ度中性粒细胞减低发生率高于GSTP1AA携带者(P<0.01)。GSTM1(+)和GSTM1(-)、GSTT1(+)和GSTT1(-)患者Ⅲ~Ⅳ度血液毒性的发生率差异均无统计学意义;GSTP1AA和GSTP1AG/GG患者Ⅲ~Ⅳ度白细胞减低、血红蛋白减低及血小板减低的发生率差异无统计学意义,见表6。

Tab.6 Association between 3 gene polymorphisms with hematologic toxicities of breast cancer patients receiving Anthracycline-Paclitaxel-based chemotherapy表6 GSTM1、GSTT1和GSTP1(rs1695)基因多态性与乳腺癌患者接受蒽环类联合紫杉类方案化疗血液毒性的关系 例
按结果2.2中相同的变量赋值方法行非条件Logistic回归,结果显示采用蒽环联合紫杉类药物化疗患者携带GSTP1 AG/GG基因型是发生Ⅲ~Ⅳ度中性粒细胞减低的危险因素,见表7。

Tab.7 Unconditional logistic regression of 3 gene polymorphisms with neutropenia of breast cancer patients receiving Anthracycline-Paclitaxel-based chemotherapy表7 3个基因多态性与乳腺癌患者接受蒽环联合紫杉类药物化疗血液毒性关系的非条件Logistic回归分析
3 讨论
3.1 GSTM1、GSTT1及GSTP1(rs1695)基因生物学功能和作用机制 蒽环类和(或)紫杉类药物均经肝脏GST家族(GSTs)代谢活化,GSTs是人体内的Ⅱ相代谢酶,通过催化亲电子物质与还原型谷胱甘肽结合发挥解毒效应[5]。GSTs催化阿霉素与还原型谷胱甘肽结合,增加其水溶性,从胆汁和尿液排出体外[5];抗微管药物通过GSTs与促细胞分裂原活化蛋白激酶(MAPK)之间的c-jun氨基末端激酶(c-Jun N-terminal kinase,JNK1)通路相连接而产生应激反应和细胞凋亡[6]。GSTM1、GSTT1和GSTP1基因是GSTs家族重要组成成员,分别编码GST-μ、GST-θ和GST-π同工酶。GSTM1(+)和GSTT1(+)基因型的个体可防御内外源性物质对细胞的损伤;而GSTM1(-)和GSTT1 (-)基因型编码的酶无活性[1],从而增加机体对肿瘤的易感性和化疗药物的损伤[7]。GSTP1第5外显子上A313→G(Ile105→Val)改变(SNP位点rs1695),可导致其编码的蛋白质的热稳定性下降和特异性催化活性降低[2]。本研究GSTM1、GSTT1及GSTP1(rs1695)基因型分布频率与文献报道一致[8]。
3.2 GSTM1、GSTT1和GSTP1(rs1695)基因多态性与乳腺癌患者化疗的关系 多数研究显示GSTM1、GSTT1和GSTP1(rs1695)基因多态性与以蒽环类和(或)紫杉类药物化疗疗效[4,9]、毒性[10]及预后[11]密切相关。Yao等[10]采用基质辅助激光解吸电离(MALDITOF)的方法研究乳腺癌患者接受以环磷酰胺+吡柔比星/表柔比星+氟尿嘧啶(CAF/CEF)为主方案化疗的结果显示,与GSTP1AA基因型相比,至少含有1个GSTP1 G基因的患者易发生Ⅲ~Ⅳ度中性粒细胞毒性(OR=0.63,95%CI 0.41~0.97)和白细胞毒性(OR= 0.59,95%CI 0.39~0.89)。本研究显示:采用紫杉类方案化疗、蒽环联合紫杉类药物化疗,GSTP1(rs1695) AG/GG基因型患者Ⅲ~Ⅳ度中性粒细胞减低发生率高于GSTP1(rs1695)AA基因型。中性粒细胞减低为骨髓抑制的敏感指标,说明GSTP1(rs1695)基因多态性可预测乳腺癌患者采用紫杉类药物发生骨髓抑制的可能性。GSTP1(rs1695)AA基因型可保护正常造血系统免受化疗药物的攻击,GSTP1(rs1695)GG/AG基因型的患者,因解毒化疗药物的能力降低,导致有效血药浓度增高,加之化疗药物对靶肿瘤的特异杀伤作用低下,在获得高化疗有效率的同时也对正常组织构成威胁,在联合化疗时其不良反应尤为明显。因此根据基因型与体表面积给予合适的化疗剂量是一个值得探索的方向。
综上所述,GSTP1基因SNP可作为预测乳腺癌患者采用紫杉类药物化疗发生骨髓抑制的标志。因此,通过检测外周血GSTP1(rs1695)基因多态性,在采用紫杉类药物化疗后24 h,给予携带GSTP1 (rs1695)GG/AG基因型患者注射粒细胞集落刺激因子可预防化疗相关重度骨髓抑制的发生,保障患者如期完成化疗。
[1]Hayes JD,Strange RC.Glutathione S-transferase polymorphismsand their biological consequences[J].Pharmacology,2000,61(3): 154-166.
[2]Zeng FF,Liu SY,Wei W,et al.Genetic polymorphisms of glutathione S-transferase T1 and bladder cancer risk:a meta analysis[J]. Clin Exp Med,2010,10(1):59-68.doi:10.1007/s10238-009-00 70-0.
[3]Cancer Therapy Evaluation Program,Common Terminology Criteria for Adverse Events,Version 3.0,DCTD,NCI,NIH,DHHS 2003. http://ctep.cancer.gov.
[4]刘新兰,赵艳姣,姜敏,等.GSTP1(rs1695)基因分型及其与乳腺癌蒽环和/或紫杉类药物化疗疗效的关系[J].第二军医大学学报, 2013,34(8):879-884.
[5]Oakley A.Glutathione transferases:a structural perspective[J].Drug Metab Rev,2011,43(2):138-151.doi:10.3109/03602532.2011.558093.
[6]Townsend DM,Tew KD.The role of glutathione-S-transferase in anti-cancer drug resistance[J].Oncogene,2003,22(47):7369-7375.
[7]Saadat I,Saadat MM.Influence of genetic polymorphisms of glutathione S-transferase T1(GSTT1)and M1(GSTM1)on hematological parameters[J].Mol Biol Rep,2010,37(1):249-253.doi:10.1007/ s11033-009-9662-8.
[8]De Jong MM,Nolte IM,De Meerman GJ,et al.Low-penetrance genes and their involvement in colorectal cancer susceptibility[J]. Cancer Epidemiol Biomarkers Prev,2002,11(11):1332-1352.
[9]Bai YL,Zhou B,Jing XY,et al.Predictive role of GSTs on the prognosis of breast cancer patients with neoadjuvant chemotherapy[J]. Asian Pac J Cancer Prev,2012,13(10):5019-5022.
[10]Yao S,Barlow WE,Albain KS,et al.Gene Polymorphisms in Cyclophosphamide metabolism Pathway,Treatment-Related Toxicity,and Disease-Free Survival in SWOG8897 Clinical Trial for Breast Cancer[J].Clin Cancer Res,2010,16(24):6169-6176.doi:10.1158/ 1078-0432.CCR-10-0281.
[11]Duggan C,Ballard-Barbash R,Baumgartner RN,et al.Associations between null mutations in GSTT1 and GSTM1,the GSTP1 Ile105Val polymorphism,and mortality in breast cancer survivors [J].2013,2:450.doi:10.1186/2193-1801-2-450.
(2013-09-25收稿 2014-03-10修回)
(本文编辑 李鹏)
Correlation between Polymorphisms of GSTM1,GSTT1 and GSTP1(rs1695)on Hematologic Toxicities with Anthracycline/Paclitaxel-Based Chemotherapy in Breast Cancer
LIU Xinlan,ZHAO Yanjiao,HUANG Yin,JIANG Min
The General Hospital of Ningxia Medical University,Yinchuan 750004,China
ObjectiveTo examine the effects of genetic polymorphisms in GSTM1,GSTT1 and GSTP1(rs1695) genes on hematologic toxicities of breast cancer patients receiving Anthracycline/Paclitaxel-based chemotherapy.MethodsMultiply PCR technique and High Resolution Melting method were used to examine these 3 genes polymorphsim in female breast cancers(n=252).ResultsThe GSTP1(rs1695)AG/GG genotype was a risk factor forⅢ-Ⅳdegree of neutrophil toxicity when patients
Paclitaxel-based chemotherapy and Anthracycline-Paclitaxel-based chemotherapy (OR=6.111,95%CI 1.526-24.469,P<0.05 and OR=9.257,95%CI 2.903-29.522,P<0.01).There were no statistic difference onⅢ-Ⅳdegree hematologic toxicities rates between GSTM1(+)and GSTM1(-),GSTT1(+)and GSTT1(-)patients after they receiced Paclitaxel-based chemotherapy and Anthracycline-Paclitaxel-based chemotherapy(P>0.05);There was no statistic difference onⅢ-Ⅳdegree hematologic toxicities rates between GSTM1(+)and GSTM1(-),GSTT1(+)and GSTT1(-), GSTP1AA and GSTP1AG/GG patients after they receiced Anthracycline-based chemotherapy(P>0.05).ConclusionThe genetic polymorphisms in GSTP1(rs1695)can be used as a gene marker for forecasting the chemotherapy,inducing neutropenia toxicities in breast cancer patients receiving Paclitaxel-based chemotherapy.
breast neoplasms;antineoplastic combined chemotherapy protocols;glutathione transferase;polymorphism,genetic;polymerase chain reaction;glutathione S-transferase;chemotherapy toxicities;high resolution melting
R737.9,R730.53
A
10.3969/j.issn.0253-9896.2014.08.002
宁夏回族自治区银川市应用研究开发计划项目(2011029)
宁夏医科大学总医院(邮编750004)
