低频电刺激脚桥核对苍白球内侧部神经元自发放电的影响
2014-07-05林宇涵焦金菊
郭 佳 林宇涵 李 垚 焦金菊
低频电刺激脚桥核对苍白球内侧部神经元自发放电的影响
郭 佳 林宇涵 李 垚△焦金菊△
目的 通过观察低频电刺激帕金森病(PD)模型大鼠脚桥核(PPN)对苍白球内侧部(GPi)神经元放电的影响,探讨低频电刺激PPN治疗PD的作用机制。方法30只SD大鼠随机分为对照组和PD组各15只。大鼠脑右侧黑质致密部注入6-羟基多巴胺建立PD模型;采用细胞外记录方法,利用7管玻璃微电极记录观察低频电刺激、微电泳谷氨酸(Glu)及其受体阻断剂MK-801、γ-氨基丁酸(GABA)及其受体阻断剂荷包牡丹碱(BIC)对大鼠GPi神经元放电频率的影响。结果低频电刺激PPN,对照组及PD组大鼠GPi神经元反应均以抑制为主,且平均放电频率均较刺激前降低(P<0.01);微电泳Glu和BIC对神经元有兴奋作用,而微电泳MK-801和GABA对神经元有抑制作用。在微电泳BIC的兴奋作用的基础上低频电刺激PPN使神经元放电频率明显降低,而在微电泳MK-801抑制作用的基础上低频刺激PPN使神经元放电频率进一步降低。结论低频电刺激PPN可抑制GPi神经元活动,可能是通过调节投射到GPi神经元的Glu和GABA神经通路实现的。
帕金森病;电刺激;脑桥脚被盖核;苍白球;谷氨酸;γ氨基丁酸;脑桥核;微电泳
帕金森病(PD)是常见的慢性中枢神经系统退行性病变,一般认为黑质致密部(SNc)多巴胺(DA)能神经元变性是其发病的主要原因[1]。虽然脑深部电刺激丘脑底核治疗PD效果良好,但不能明显改善PD步态障碍和静止震颤等运动特性[2]。脚桥核(PPN)作为大脑网状激活系统的一部分,能诱导并维护运动[3]。动物实验证明病变或者高频刺激能够导致PPN的失活,引发运动障碍,这种现象可以被低频刺激还原[4]。本研究观察低频电刺激PPN对苍白球内侧部(GPi)神经元放电的影响,并结合微电泳来探讨低频电刺激PPN改变GPi神经元放电频率的可能机制,为临床治疗PD提供实验依据。
1 材料与方法
1.1 实验动物及试剂 SD大鼠30只,体质量250~300 g,购自辽宁医学院实验动物中心。应用配对设计方法将实验大鼠随机分为对照组和PD组各15只,每组雌雄比例一致,标准环境饲养。6-羟基多巴胺(6-OHDA)、阿普吗啡(APO)、谷氨酸(Glu)、MK-801、γ-氨基丁酸(GABA)、荷包牡丹碱(BIC)均购自美国Sigma公司,其余试剂均由辽宁医学院生理实验室提供。
1.2 PD大鼠模型建立 经4%水合氯醛(8 mL/kg)腹腔麻醉后,用脑立体定位仪(美国WPI公司)对大鼠头颅进行水平固定。剪毛,常规消毒后,沿颅顶正中切2 cm长纵向切口,依次切开头皮及皮下组织,暴露前囟和后囟位点,根据《Paxinos &Watson大鼠脑图谱》确定右侧黑质致密部两点坐标:(1)AP-5.3 mm,ML 2.1 mm VD 7.1 mm。(2)AP-5.3 mm,ML 2.6 mm,VD 6.8 mm。将2 μL 6-OHDA分别注射于2个靶点,注射完毕后留针10 min,缓慢退针缝合伤口,腹腔注射青霉素预防感染。术后3周,大鼠颈背部皮下注射0.05%阿普吗啡(0.5 mL/kg),诱发大鼠旋转行为。5 min后开始观察并记录旋转圈数。以健侧后肢为支点原地旋转,首尾相接360°为1圈,记录30 min大鼠旋转次数,7圈/min以上大鼠为成功PD模型,用于实验。
1.3 电刺激 用20%乌拉坦(0.75 mL/100 g)腹腔注射麻醉大鼠,颅部水平固定于脑立体定位仪。将刺激电极插入大鼠脑PPN核团(AP-8.0 mm,ML 1.9 mm,VD 6.6 mm)。刺激强度0.6 mA,波宽0.06 ms,刺激时程5 s,刺激频率为25 Hz。
1.4 神经元放电及微电泳 自制7管玻璃微电极,尖端直径小于2 μm,中心管电阻5~10 MΩ,管内充入含0.1%滂胺天蓝的3 mol/L NaCl溶液。外周管电阻20~100 MΩ,根据微电泳实验分别注入Glu(1.0 mol/L,pH 8.0)、MK-801(0.01 mol/L,pH 4.0)、GABA(0.2 mol/L,pH 3.5)、BIC(0.01 mol/L,pH 4.0)。用6400A微电泳仪(美国Dagan公司)进行微电泳,用微电极推进器(美国Dagan公司)将玻璃电极缓慢推入GPi (AP-2.4 mm,ML 2.3~3.0 mm,VD 6.6~7.3 mm)。记录其放电活动。滞留电流为5~10 nA,不同试剂的微电泳电流均在5~100 nA之间,Glu用负电流泳入,其余为正电流。
神经元放电经DAM80微电极放大器(美国WPI公司)引导、滤波后显示于示波器,用Spike2生物信号处理系统(美国CED公司)记录储存。实验过程中,只对放电稳定且信噪比>3∶1的放电信号进行记录。为排除可能发生的电流作用,只要泳入NaCl引起放电变化,该数据不计入统计。
神经元放电频率(R)的改变根据下列公式判断:R=(处理后放电频率/处理前放电频率-1)×100%,R>20%为兴奋反应:R<-20%为抑制性反应;介于两者之间为无反应。
1.5 统计学方法 采用SPSS 16.0软件进行统计学处理,所得数据以±s表示。组内比较采用配对t检验,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 低频电刺激PPN对GPi神经放电元影响 对照组大鼠GPi神经元30个,PD组大鼠GPi神经元26个。低频电刺激PPN后,对照组大鼠GPi神经元27个为抑制反应,1个兴奋,2个无反应;PD组大鼠GPi神经元有24个抑制,1个兴奋,2个无反应。2组大鼠GPi神经元在低频电刺激后均以抑制性为主,见图1。

Fig.1 After low-frequency electrical stimulation of PPN,GPi neuronal present inhibitory response图1 低频电刺激大鼠PPN后GPi神经元抑制性反应
低频刺激PPN前,PD组GPi神经元基础放电频率(Hz)较对照组明显增高([15.34±3.12)vs(12.34± 2.53),t=2.334,P<0.05];刺激后PD组放电频率(4.52±1.75)和对照组放电频率(2.25±1.12)较刺激前均有明显降低(t分别为4.873、6.113,P<0.01)。
2.2 微电泳Glu和MK-801对GPi神经元放电影响 观察26个GPi神经元对微电泳Glu的反应,92%的神经元表现为明显兴奋反应,平均放电频率由(6.34±0.32)Hz增至(19.35±1.20)Hz(n=24,t= 15.435,P<0.01)。在25个神经元中,微电泳Glu受体阻断剂MK-801使88%的神经元表现为抑制反应,平均放电频率由(6.34±0.32)Hz降至(3.14±0.10)Hz(n=22,t=21.011,P<0.01)。而且Glu对神经元的兴奋效应可被MK-801阻断,见图2。
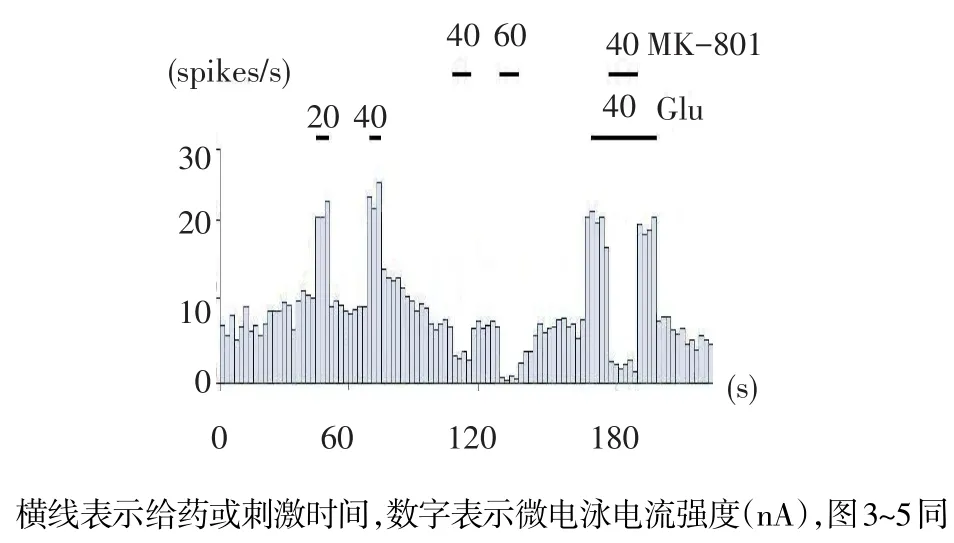
Fig.2 Effect of microiontophoresis Glu and MK-801 on rat GPi neurons图2 微电泳Glu和MK-801对大鼠GPi神经元放电影响
2.3 微电泳GABA和BIC对大鼠GPi神经元放电影响 观察28个GPi神经元对微电泳GABA的反应,93%的神经元表现为明显抑制反应,平均放电频率由(4.46±0.8)Hz降至(1.66±0.32)Hz(n=26,t=8.287,P<0.01)。在25个神经元中,微电泳GABA受体阻断剂BIC使92%的神经元表现为兴奋反应,平均放电频率由(4.46±0.8)Hz增至(18.21±2.03)Hz(n=23,t=4.938,P<0.01,)。而且GABA对GPi神经元的抑制效应可被BIC阻断,见图3。

Fig.3 Effect of micro-electrophoresis and BIC on rat GABA on GPi Neuron图3 微电泳GABA和BIC对大鼠GPi神经元放电影响
2.4 微电泳MK-801和BIC过程中低频刺激PPN对GPi神经元放电影响 在对照组大鼠15个GPi神经元中,微电泳MK-801和BIC过程中低频电刺激PPN,86%神经元出现了进一步的抑制反应,放电频率由(3.02±0.55)Hz变化到(1.25±0.43)Hz(n=13,t= 8.247,P<0.05);93%神经元在兴奋的基础上出现了明显的抑制反应,放电频率由(5.46±0.8)Hz降至(1.66±0.32)Hz(n=14,t=9.615,P<0.01)。在PD组大鼠17个神经元中,94%神经元出现了进一步的抑制反应,放电频率由(9.45±0.67)Hz变化到(1.32± 0.44)Hz(n=16,t=9.485,P<0.01);88%神经元在BIC兴奋的基础上出现明显抑制,放电频率由(10.24±1.2)Hz降至(1.12±0.22)Hz(n=15,t=22.221,P<0.01),见图4、5。

Fig.4 Response of GPi neurons to low-frequency micro-electrophoresis MK-801 stimulation on PPN图4 微电泳MK-801 GPi神经元对低频刺激PPN反应
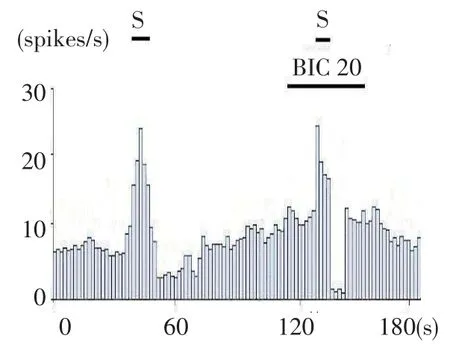
Fig.5 Response of GPi neurons to low-frequency micro-electrophoresis BIC stimulation on PPN图5 微电泳BIC GPi神经元对低频刺激PPN反应
3 讨论
在PD状态下,由于SNc中DA能神经元缺少,一方面通过SNc-纹状体(Striatum,Str)-苍白球外侧部(Globus pallidus external,Gpe)-STN间接通路使STN去抑制,并通过STN-GPi/SNr的Glu能投射使GPi活动进一步增强。另一方面通过SNc-Str-GPi/SNr直接通路,使Str-GPi/SNr的GABA能投射减少以使GPi/SNr去抑制。最终结果均导致GPi过度兴奋,Gpi/SNr过强的GABA能神经通路使皮质对运动的发动受到抑制而产生PD症状。已有实验证明,高频电刺激PPN能够增加GPi神经元活动[5],从理论上说并不能改善PD状态下GPi神经元的过度兴奋,而本研究中采用低频电刺激PPN,发现GPi神经元放电活动受到抑制,提示可以改善PD。
本研究在微电泳MK-801和BIC的基础上给予低频电刺激PPN,结果显示在微电泳MK-801抑制GPi神经元放电的基础上,给予低频刺激PPN,GPi神经元放电频率进一步降低,提示投射到GPi的Glu能减少,从而来抑制GPi活动。然而已有实验证明低频电刺激PPN可以兴奋STN神经元[6]。PPN的上行非胆碱能投射通路同时投射到苍白球、黑质致密部和STN,而PPN到STN的投射大部分是PPN到GPi投射的分支,笔者推断虽然低频电刺激PPN能够兴奋STN神经元,使其投射到GPi的Glu含量增加,但是PPN-GPi的直接通路作用更加明显,最终结果在微电泳实验上显示为GPi内的Glu含量较低频刺激前减少。
而在微电泳BIC兴奋GPi神经元的基础上,低频电刺激PPN,可使GPi神经元放电频率明显降低,推断可能是电刺激PPN,一方面改变PPN的放电模式,使PPN投射至GPi的胆碱能抑制突出前GPi/SNr的GABA能神经末梢的突出前膜受体[7],抑制GABA到PPN的投射,也有可能是通过SNc-Str-GPi/SNr直接通路的调节,使Str-GPi/SNr的GABA能投射增加[8],通过增加GABA的释放抑制了GPi神经元的活动,从而释放丘脑-皮质通路,使相应运动皮质活动提高而改善PD症状。
本研究证明了低频电刺激PPN能够通过Glu能神经投射的减少和GABA能投射的增加,降低了PD大鼠GPi神经元的电生理活动从而改善PD症状,为低频电刺激PPN治疗PD提供了依据。
[1]Acar F,Acar G,Bir LS,et al.Deep brain stimulation of the pedunculopontine nucleus in a patient with freezing of gait[J].Stereotact Funct Neurosurg,2011,89(4):214-219.
[2]Rodriguez-Oroz MC,Obeso JA,Lang AE,et al.Bilateral deep brain stimulation in Parkinson’s disease:a multicentre study with 4 years follow-up[J].Brain,2005,128(2):2240-2249.
[3]Takakusaki K.Forebrain control of locomotor behaviors[J].Brain, 2008,57(17):192-198.
[4]Nandi D,Aziz TZ,Giladi N,et al.Reversal of akinesia in experimental Parkinsonism by GABA antagonist microinjections in the pedunculopontine nucleus[J].Brain,2002,125(14):2418-2430.
[5]Liu MJ,Jiao JJ,Li Y,et al.Effect of high-frequency stimulation in the pedunculopontine nucleus on neuronal activity and neurotransmitters in the globus pallidus internus of rats[J].Tianjin Med J,2013,41 (7):682-685.[刘敏杰,焦金菊,李垚,等.高频电刺激脚桥核对苍白球内侧部氨基酸类递质及神经元放电的影响[J].天津医药, 2013,41(7):682-685.]
[6]Capozzo A,Florio T,Confalone G,et al.Low frequency stimulation of the pedunculopontine nucleus modulates electrical activity of subthalamic neurons in the rat[J].Neural Transm,2009,116(1):51-56.
[7]Aravamuthan BR,McNab JA,Miller KL,et al.Cortical and subcortical connections within the pedunculopontine nucleus of the primate Macaca mulatta determined using probabilistic diffusion tractography[J].Clin Neurosci,2009,16(3):413-420.
[8]Warren NM,Piggott MA,Lees AJ,et al.Muscarinic receptors in the thalamus in progressive supranuclear palsy and other neurodegenerative disorders[J].Neuropathol Exp Neurol,2007,66(5):399-404.
(2014-01-08收稿 2014-05-07修回)
(本文编辑 李国琪)
Effects of Low-Frequency Stimulation of Pedunculopontine Nucleus on Spontaneous Discharges of Globus Pallidus Internus
GUO Jia,LIN Yuhan,LI Yao,JIAO Jinju
Department of Physiology,Liaoning Medical College,Jinzhou 121001,China LI Yao,E-mail:liyaoliaoyi@163.com;JIAO Jinju,E-mail:jinjujiao@126.com
ObjectiveTo explore the mechanism of the low-frequency electrical stimulate on pedunculopontine nucleus to treat the Parkinson(PD)through observinge the low-frequency electrical stimulation of Pedunculopontine Nucleus (PPN)in PD rat model and the effects of neurotransmitters(GPi)neurons discharge in the medial part of the globus pallidus.MethodsThirty SD rats were randomly assigned to the control group and the PD model group,with 15 in each group.PD model was established through injecting 6-OHDA into Substantia nigra compact(SNc)of black rat.Effect of low frequency electrical stimulation,micro-electrophoresis glutamate(Glu)and its receptor blocking breaking agent MK-801,γ-aminobutyric acid(GABA)and its receptor antagonist bicuculline(BIC)on discharge of rat neuron GPi was examined using extracellular unit recording methods through seven glass microelectrode recording.ResultsWhen stimulated by low frequency electrical stimulation of PPN,reactions from the control group and neuronal response GPi in PD rats were inhibited.The average discharge frequency was reduced compared to pre-stimulation(P<0.01).Micro-electrophoresis and BIC Glu excite neurons while microiontophoresis MK-801 and GABA restrain neurons.In the background of micro-electrophoresis BIC’s excitatory effects on neuron,low-frequency electrical stimulation on PPN reduced neuronal firing frequency.And in the background of inhibition effect of micro-electrophoresis MK-801,low-frequency stimulation PPN further restrain neuronal discharge frequency.ConclusionLow frequency electrical stimulation inhibits GPi PPN neuronal activity probably though regulating neurons projecting to the Glu and GABA nerve pathways in GPi neuron.
Parkinson disease;electric stimulation;pedunculopontine tegmental nucleus;globus pallidus;glutamic acid;gamma-aminobutyric acid;pedunculopontine pucleus;microiontophoresis
R742
A
10.3969/j.issn.0253-9896.2014.08.011
辽宁省教育厅科研项目(L2010252)
辽宁锦州,辽宁医学院生理学教研室(邮编121001)△
E-mail:liyaoliaoyi@163.com;jinjujiao@126.com
