蓖麻醇酸酯生物合成代谢途径及关键酶研究进展
2014-06-11狄建军黄凤兰陈永胜张树军魏永春
狄建军 黄凤兰 陈永胜 张树军 魏永春
(内蒙古民族大学生命科学学院1,通辽 028000)(内蒙古自治区高校蓖麻产业工程技术研究中心2,通辽 028000)
蓖麻(RicinuscommunisL.)是起源于非洲的热带多年生灌木,属大戟科的一种高经济价值油料植物,在世界上许多的热带、亚热带和温带区域种植。现在蓖麻基因组草图绘制完成,在大戟科成员中尚属首例[1]。在油料植物中,储存在植物油体中的主要物质是三酰甘油(TAGs)。三酰甘油中脂肪酸的组成决定了植物油的利用价值。蓖麻籽中三酰甘油含量范围在39.6%~59.5%,其中含有特殊的羟化脂肪酸——蓖麻油酸(Ricinolic acid),蓖麻油酸是一种羟基脂肪酸(HFA),是蓖麻油中的主要成分,约占蓖麻三酰甘油的83.65%~90.00%,平均值达到88.30%[2]。蓖麻是一种高价值的油料作物,蓖麻油衍生物被用于肥皂、润滑油、液压油、刹车油、涂料、染料、油墨、耐寒塑料、蜡、上光剂、尼龙、药品和香水制造等,也是生物柴油的一种潜在来源[1]。鉴于蓖麻作为油脂作物的重要性,尤其是其中的蓖麻油酸具有重要的应用价值,对蓖麻醇酸酯合成代谢及关键酶的研究就尤为重要,现就国内外蓖麻醇酸酯代谢及其关键酶的有关研究进展概述如下。
1 蓖麻醇酸酯合成代谢
蓖麻醇酸酯以脂酰甘油形式存在,其中三蓖麻油酰甘油(RRR)约占71%,含2个蓖麻油酰基的三酰甘油(RR-TAG)约占18%。RR-TAG中,二蓖麻油酰油酰甘油(RRO)约占8.8%,二蓖麻油酰亚油酰甘油(RRL)约占6.6%[3]。
随着近年来分子生物学和基因工程技术的发展,蓖麻醇酸酯的合成代谢已有一定的进展[4-10](如图1)。TAG的合成主要通过两个途径,即脂酰-CoA依赖途径(Kennedy途径)和非脂酰-CoA依赖途径。油酰-ACP在质体中合成,经脂酰-ACP硫酯酶(AAT)水解后产生的游离油酸迅速经脂酰-CoA合成酶(ACS)催化形成油酰-CoA,同时被输出质体,进入酰基池,作为蓖麻醇酸酯合成的原料。油酰-CoA进入内质网,经酰基编辑途径形成蓖麻油酰-CoA,即由溶血磷脂酰胆碱酰基转移酶(LPCAT)转移油酰-CoA的油酰基团到磷脂酰胆碱(PC)的sn-2位,作为油酰-12-羟化酶(FAH12)的底物,FAH12将sn-2-油酰基催化形成sn-2-蓖麻油酰基。磷脂酶A2(PLA2)优先从PC的sn-2位上释放蓖麻油酸,同时释放溶血磷脂酰胆碱(LPC),通过LPCAT催化再次形成sn-2-油酰-PC重复作为FAH12的底物。该蓖麻油酸经长链脂酰-CoA合成酶(LACS)催化转化为蓖麻油酰-CoA,进入酰基池作为酰基供体进入脂酰-CoA依赖途径,在甘油骨架上连续发生酰基化反应生成TAG。在蓖麻油酰-CoA依赖途径中,第1个酰基化反应是由甘油-3-RL-DAG,1-蓖麻油酰-2-亚油酰-二酰甘油;RLR,1,3-二蓖麻油酰-2-亚油酰-甘油;RRRL,(12-蓖麻油酰蓖麻油酰)-蓖麻油酰-亚油酰-甘油;RO-DAG,1-蓖麻油酰-2-油酰-二酰甘油;ROR,1,3-二蓖麻油酰-2-油酰-甘油;RRRO,(12-蓖麻油酰蓖麻油酰)-蓖麻油酰-油酰-甘油;PE,磷脂酰乙醇胺;RR-DAG,1,2-二蓖麻油酰-二酰甘油;RRRR,(12-蓖麻油酰蓖麻油酰)-二蓖麻油酰-甘油;MAG,单酰甘油。FAD,油酰脱氢酶;TAGAT,三酰甘油酰基转移酶;CPT,胆碱磷酸转移酶;EPT,磷脂酰乙醇胺转移酶;PAP,磷脂酸磷酸酶;FAH,脂肪酸羟化酶;FAS,脂肪酸合成酶。
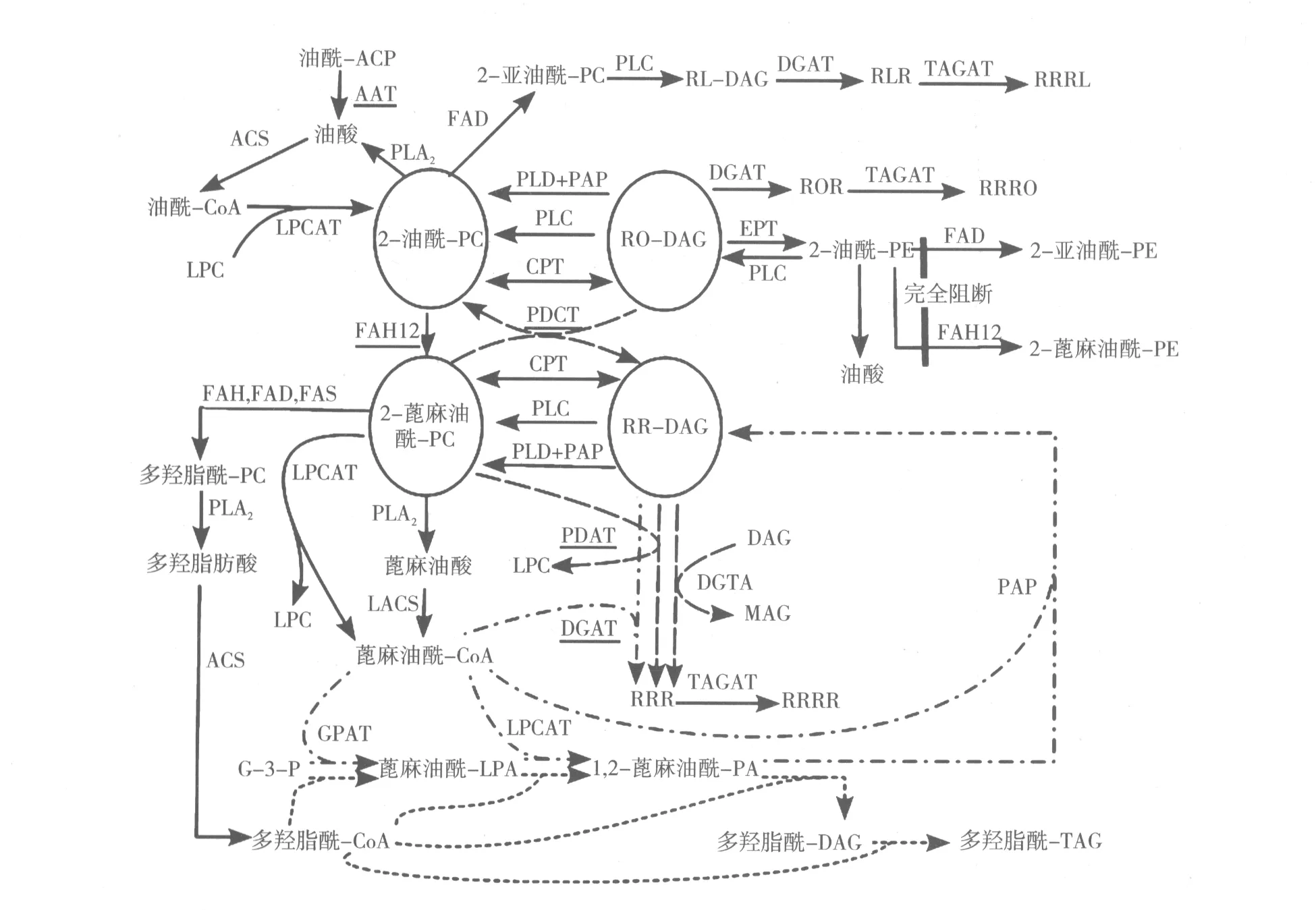
图1 蓖麻醇酸酯代谢途径
注:点画线表示脂酰-CoA依赖途径,长虚线表示非脂酰-CoA依赖途径,短虚线表示蓖麻油酸被1、2或3个多羟脂肪酸替代进入三酰甘油,下划线文字表示本文中介绍的关键酶。
磷酸酰基转移酶(GPAT)催化脂酰基转移到甘油-3磷酸(G-3-P)sn-1位点上形成溶血磷脂酸(LPA)。第2个酰基转移酶,溶血磷脂酸酰基转移酶(LPAAT)催化LPA sn-2位点酰基化产生磷脂酸(PA)。PA在磷脂酸磷酸酶(PAP)作用下去磷酸化产生二酰甘油(DAG)。第3个酰基转移酶,二酰甘油酰基转移酶(DGAT)催化DAG sn-3位点酰基化反应形成TAG。这些酰基转移酶的脂肪酸特异性决定了TAG中脂肪酸的组成。在非脂酰-CoA依赖途径中,可以经过不同路径形成TAG,一方面磷脂︰二酰甘油酰基转移酶(PDAT)直接将蓖麻油酰-PC sn-2位点上的酰基基团转移给DAG的sn-3位点,形成TAG,同时释放的LPC可再次经过LPCAT进入酰基编辑途径;另一方面,磷脂酰胆碱二酰甘油胆碱磷酸转移酶(PDCT)将蓖麻油酰-PC上的胆碱磷酸基团转移到油酰-DAG形成蓖麻油酰-DAG和油酰-PC,蓖麻油酰-DAG进入合成TAG的途径;而油酰-PC进一步被编辑形成蓖麻油酰-PC,最终进入TAG合成途径;还有一种可能是二酰甘油转酰基酶(DGTA)直接将DAG上的脂酰基转移到另一DAG上形成TAG,但至今没有克隆到该酶基因的cDNA[11]。在蓖麻中发现多羟脂肪酸及四酰甘油后,蓖麻醇酸酯代谢途径中增加了含多羟脂肪酸的TAG和四酰甘油的代谢(如图1)。
2 蓖麻醇酸酯合成代谢关键酶
2.1 脂酰-ACP硫酯酶
脂酰-ACP硫酯酶(AAT)是催化植物质体中脂肪酸合成的最后一步,水解脂酰-ACP中间体释放自由脂肪酸,通过脂酰-CoA合成酶输出到细胞质[12]。依据氨基酸序列和底物特异性不同,这些酶被分为2个家族:FatA和FatB[13]。FatA存在于所有植物,对油酰-ACP底物有高特异性。FatB在输出不饱和脂肪酸中起作用,被分为FatB1和FatB2两个子类。FatB1,存在于所有的植物,对长链脂酰-ACP有特异性,特别是棕榈酰-ACP[14];FatB2,对中、短链脂酰-ACP有特异性,并且发现只存在于在种子油中积累C8~C14脂肪酸的植物种类中[15]。由于这些硫酯酶决定了输出质体的脂肪酸种类,使其成为控制种子油脂肪酸组成的重要靶标。目前蓖麻种子的FatA和FatB均被克隆、测序和鉴定[16],分别为RcFatA和RcFatB,且均为单拷贝基因。RcFatA和RcFatB的开放阅读框分别编码371和419个氨基酸残基,分子质量分别为42.2ku和46.5ku,等电点分别为6.7和7.0。通过实时定量RT-PCR研究蓖麻不同发育时期种子和营养组织的AAT基因的表达水平显示,此酶受到胚胎发育的时序调控。在蓖麻种子发育的3~5期RcFatA和RcFatB基因表达水平最高,与油脂积累时期相一致[17],而在其他时期表达量显著降低。与拟南芥不同的是,RcFatB在种子1~4期及所研究的各营养组织中的表达水平比RcFatA要高,而在拟南芥所有研究材料中FatB的表达水平都比FatA低,且FatB表达量变化不大。研究RcFatA和RcFatB异源表达的大肠杆菌脂肪酸组成发现,与对照相比,RcFatA的表达降低了不饱和脂肪酸的相对含量,而RcFatB的表达正好相反,增加了不饱和脂肪酸的相对含量,因此RcFatA和RcFatB分别作用于不饱和脂肪酸和饱和脂肪酸,释放的游离脂肪酸可能进入β-氧化途径降解。利用离子交换层析分别分离纯化大肠杆菌表达的RcFatA和RcFatB后,利用相同浓度的不同脂酰-CoA作为底物,分析他们的底物特异性,结果发现RcFatA对棕榈酰-ACP和软脂酰-ACP催化效率低,而对油酰-ACP和棕榈油酰-ACP催化效率高,且对油酰-ACP底物有最高活性;与其他FatB蛋白对油酰-ACP催化活性低不同的是,RcFatB对油酰-ACP有最高催化活性,对棕榈酰-ACP虽具有高催化活性,但比其他FatB对棕榈酰-ACP的催化活性低。两个酶的最大反应速度的区别是:1)RcFatA催化油酰-ACP及棕榈油酰-ACP的反应速度非常大;2)两者催化饱和脂肪酸的反应速度差别不大。对油酰-ACP作为底物的最大反应速度,RcFatA比RcFatB高一个数量级,而对棕榈酰-ACP最大反应速度,RcFatA是RcFatB的7倍。RcFatA和RcFatB在不同底物情况下,Km值相差不大,但由于最大反应速度的不同,其kcat和催化效率(kcat/Km)显著不同。RcFatA的kcat和催化效率显著高于其他已研究的FatA,而与此相反的是,RcFatB的kcat小于其他已研究的FatB,但由于具有低Km值,其催化效率相似。提取3~4期蓖麻种子的粗匀浆和可溶性成分,研究硫酯酶活性,分析显示去除膜蛋白后的可溶性成分有更高的硫酯酶活性,催化油酰-ACP水解的活性最高,而催化棕榈酰-ACP和软脂酰-ACP的活性是催化油酰-ACP活性的3.5%,催化棕榈油酰-ACP的活性是催化油酰-ACP的11%。以上结果均显示了RcFatA和RcFatB对底物的特异性,RcFatA对油酰-ACP的高催化效率和RcFatB对油酰-ACP的特异亲和力共同作用,使蓖麻中积累更多的蓖麻醇酸酯[16]。
2.2 蓖麻油酰-12-羟化酶
蓖麻油酰-12-羟化酶(FAH12),将磷脂酰胆碱上sn-2-油酰基催化形成sn-2-蓖麻油酰基。Van de Loo等[18]通过差异筛选,从发育蓖麻胚乳的cDNA文库中富集种子特异性克隆,克隆到FAH12全长cDNA克隆,包括186bp的5’非编码区、1161bp的开放阅读框、101bp的3’非编码区。开放阅读框编码387个氨基酸残基的蛋白质,预计分子质量为44.4 ku。FAH12序列包括3个富含组氨酸模序(在残基108-113,145-149和319-323),在所有膜结合脱氢酶中是保守的,并且认为在这些酶活性位点的形成是非常重要的。FAH12探针和基因组DNA严格杂交表明,这一克隆在蓖麻中为单拷贝基因[18]。同样,通过Blast搜寻整个蓖麻基因组,也确信FAH12基因为单拷贝[1]。
Van de Loo等[18]进一步通过Northern杂交分析了FAH12的表达模式。FAH12探针与发育种子中约等于1.6kb的单链RNA有杂交信号,与叶RNA无任何可见的杂交信号,但过度曝光后,在叶中也可以检测到同样大小的条带,同时在种子中的杂交带则非常宽,证明FAH12在种子中相对特异性表达。通过种子cDNA文库与FAH12基因严格杂交显示文库中有1/560的克隆是FAH12,也证明FAH12在种子中是特异性强表达。将CMV 35S启动子后接FAH12 cDNA来转基因烟草,通过对获得的T2代转基因烟草叶片脂肪酸组成的色谱分析,发现除了蓖麻油酸之外,脂肪酸的组成在转基因植株和对照植株没有发现显著性差异,表明此克隆编码蓖麻油酰羟化酶,即油酰-12-羟化酶。
FAH12的cDNA在转基因拟南芥[19]和转基因亚麻荠[20]中表达均有HFA的积累。尽管HFA在拟南芥中合成并形成三酰甘油,但与天然存在的蓖麻籽种子油HFA的积累水平相比,积累水平很低。经过许多研究者的努力,在转基因FAH12拟南芥中HFA的含量最高约占种子总脂肪酸的17%[19],即使使用脂肪酸脱氢酶或脂肪酸延长酶的缺失突变体表达FAH12,在拟南芥种子中HFA的含量也小于20%[21]。同样,在其他工业用脂肪酸转基因植物中也只积累有限的相应脂肪酸[22],这些不尽人意的结果说明蓖麻籽中积累大量的蓖麻醇酸酯不仅仅是FAH12的作用,同时也需要其他的酶来共同促进蓖麻醇酸酯的积累。
2.3 二酰甘油酰基转移酶
二酰甘油酰基转移酶(DGAT)是一种跨膜酶,催化脂酰-CoA为底物在sn-1,2-二酰甘油(DAG)sn-3位上酰化形成TAG,是TAG生物合成的最后一步,被认为是很多油料种子中合成TAG的关键酶[23]。有两种不同的DGAT,即DGAT1和DGAT2,分别属于不同的基因家族,普遍存在于真核细胞中。已有报道,蓖麻中也存在这2种酶[24-26]。
He等[24]在蓖麻种子中克隆到一个RcDGAT1基因,编码521个氨基酸残基,分子质量为59.9 ku,序列全长为2067bp,包括266bp的5’非编码区和235bp的3’非编码区,为单拷贝基因。利用RT-PCR技术研究发现蓖麻种子发育过程中RcDGAT1的表达模式与FAH12表达模式有很大差别,说明此RcDGAT1蛋白水平及酶活性受到转录后水平的调控。检测RcDGAT1对DAG的特异性发现,RcDGAT1优先利用RR-DAG形成TAG。提取不同发育时期的蓖麻种子,经Western杂交后发现,RcDGAT1蛋白在26DAP时出现,持续增长到47DAP,并且在54DAP时仍保持较高水平,然后快速降低,在61DAP时降到很低水平[24]。之前预测的RcDGAT1蛋白的分子质量为60 ku,但在蓖麻总蛋白提取物中检测到的RcDGAT1只有50 ku,显示RcDGAT1蛋白存在翻译后加工的过程,在26DAP和33DAP的微粒体制备物中可以观察到全长的RcDGAT1蛋白。RcDGAT1活性在19DAP前几乎检测不到,26DAP时增长到显著水平,40DAP时达到最大,之后到54DAP快速降低,与TAG合成相一致,从侧面说明RcDGAT1与TAG的合成密切相关[17]。但RcDGAT1转化到含FAH12基因的拟南芥中并没有显著增加HFA的含量[22]。Kroon等[25]克隆RcDGAT2基因,在基因组中为单拷贝基因,并进一步利用实时定量PCR研究了RcDGAT1和RcDGAT2的时间和组织特异性表达模式,结果发现,RcDGAT1在叶子和不同时期的种子中表达水平相差不多,且最大表达量在种子10DAP,之后降低;与之显著不同的是,RcDGAT2的在种子中的表达与叶子中的表达相比,最多增大18倍(25DAP)。
FAH12在拟南芥中表达时最多产生17%的HFA,Burgal等[22]利用发育中蓖麻种子建立的cDNA文库,设计简并引物,得到几个编码蓖麻种子油代谢途径相关酶的cDNA克隆。这些cDNA在FAH12转基因拟南芥植株中的表达显示,蓖麻RcDGAT2可使HFA从17%增加到近30%,且与对照相比,并不影响种子大小及总TAG的积累。RcDGAT2唯一独特的明显特点是N-端12个残基的区域,包含9个天冬酰胺残基,其中6个是连续的。此区域的功能重要性,以及对HFA底物高亲和性的决定因素,需进一步试验验证。经研究后发现,RcDGAT2更偏好蓖麻油酰-CoA的酰基供体和包含HFA的的二酰甘油底物,进一步在酵母细胞中表达RcDGAT2,经过生化分析,证实了对含HFA的二酰甘油底物的强烈偏好[22]。酶促分析显示,重组RcDGAT2对蓖麻油酰-DAG的偏好比油酰-DAG或亚油酰-DAG高近10倍,RcDGAT2 mRNA在发育种子各个时期中的积累比RcDGAT1均要高,且在种子发育过程中表达先增加后减弱。Li等[27]通过实时定量PCR发现蓖麻发育种子中RcDGAT2表达水平比在不积累独特脂肪酸的大豆或拟南芥高的多。这些研究结果说明在蓖麻TAG生物合成中RcDGAT2对于蓖麻油酸的积累有非常重要的作用[10]。
2.4 磷脂︰二酰甘油酰基转移酶
磷脂︰二酰甘油酰基转移酶(PDAT)是一种在种子成熟过程中不依赖于脂酰-CoA的TAG合成酶,通过催化磷脂sn-2位点上的酰基转移到DAG sn-3位点上形成TAG和LPC[28]。PDAT在酵母中首次报道,由LOR1编码[29]。Dahlqvist等[29]利用蓖麻微粒体制备物可以将2-[14C]蓖麻油酰-DAG作为底物形成TAG,证明在发育的蓖麻微粒体制备物中具有PDAT活性,且对蓖麻油酸具有高特异性。Kim等[28]从蓖麻中克隆到3个PDAT基因,分别为RcPDAT1-1、RcPDAT1-2、RcPDAT2,其中RcPDAT1-1和RcPDAT2分别与拟南芥PDAT1-1和PDAT2具有相同的基因结构和表达模式,RcPDAT1-1定位于内质网,在其他组织中表达量较种子中多,两者分别与FAH12在拟南芥中共表达,并不增加HFA的含量。RcPDAT2定位于内质网膜;而RcPDAT1-2为蓖麻中所特有,在拟南芥中没有发现有相应基因,由PDAT1进化,也定位于内质网,并与合成蓖麻油酸的FAH12基因有相同的种子表达优势,对HFA具有特异活性,含FAH12基因的拟南芥植株中表达RcPDAT1-2显著增加HFA的产量(增加到25%),同时减少油酸含量,并且显著增加种子中TAG的含量,增加粒重,还对种子发芽和生长没有有害的影响。进一步研究显示即使FAH12、RcPDAT1-2与RcDGAT2共表达,与含FAH12和RcPDAT1-2基因的植株相比,并没有显著增加HFA的含量,可能原因是RcPDAT和RcDGAT两者竞争转移HFA到DAG的sn-3位点。van Erp等[30]从cDNA文库克隆了RcPDAT1A、RcPDAT1B和RcPDAT2,RcPDAT1A和RcPDAT1B在氨基酸水平上和AtPDAT1的相似性分别为83.8%和87.3%,RcPDAT2和AtPDAT1相似性为73.9%,而和AtPDAT2相似性为78%。使RcPDAT1A与FAH12共表达,HFA显著性增加到27%,分析种子发育过程中不同酯的脂肪酸组成,显示TAG中HFA增加的同时PC中的HFA显著减少。这些研究说明PDAT在蓖麻中积累大量HFA中起到重要作用。van Erp等[30]还进行了FAH12、RcPDAT1A和RcDGAT2 3个基因在拟南芥中的共表达,结果显示在拟南芥种子中HFA含量增加了约1.3%,其原因可能是所用启动子强度不同所导致。由于2篇文献中对PDAT的命名差别,对这些序列进行了比对后发现,RcPDAT1-1和RcPDAT1B序列相同,RcPDAT1-2与RcPDAT1A序列99%相同,2篇文献中的RcPDAT2序列有99%相同。这些结果表明蓖麻子中特异性的PDAT在转基因植物中产生含HFA的TAG合成中是一个关键酶。
2.5 磷脂酰胆碱二酰甘油胆碱磷酸转移酶
磷脂酰胆碱二酰甘油胆碱磷酸转移酶(PDCT),通过催化DAG和PC间胆碱磷酸头部的交换而相互变化,使DAG中的油酰基进入PC,经酰基编辑后形成蓖麻油酰基,再次形成DAG。Lu等[31]报道了PDCT是种子中TAG积累过程中不饱和脂肪酸合成所必须的酶,在野生型拟南芥中,种子TAG中有49.1%的脂肪酸是多不饱和脂肪酸(亚油酸和亚麻酸),这些脂肪酸是在内质网分别由脂肪酸脱氢酶FAD2和FAD3催化油酰-PC形成,而在PDCT缺陷的rod1突变体中,这些脂肪酸在TAG中只占29.4%,说明有40%的油酸通过PDCT经脂酰-PC形成亚油酸和亚麻酸。在油积累种子组织中rod1基因的高表达与突变分析及酶学分析相一致,显示PDCT催化的PC与DAG的互变在TAG中富集多不饱和脂肪酸是一种重要的机制[31]。
在蓖麻中此酶由RcROD1编码,包含285个氨基酸残基,与拟南芥AtROD1序列相比,两者在N末端和C末端有很大不同,而在中间区域有70%的同一性,存在与AtROD1相同的跨膜区和催化位点。虽然两者在序列上有很大差异,在酵母中表达AtROD1和RcROD1均有PDCT活性,且RcROD1的活性要比AtROD1高,但两者对蓖麻油酰-PC均不显示有偏好。Hu等[32]研究发现:第一,与RcPDAT1A表达系相似,RcROD1表达系增加TAG中HFA含量,而减少PC中HFA含量,显示PDCT可以有效的将在PC中产生的HFA转移;第二,RcROD1显著增加包含HFA(尤其是含2个和3个HFA)的TAG含量。在含2个HFA的TAG中,RcROD1可使sn-2位点含HFA增加,而使sn-1/3位点的HFA降低。由于HFA是由FAH12作用于PC的sn-2位点,超表达RcROD1可以增强sn-2位点上HFA从PC到DAG的转移,从而产生更多的sn-2 HFA-DAG,之后经DGAT和PDAT催化在DAG sn-3位点含HFA的TAG,从而产生更多的含HFA的TAG。第三,PDCT增加形成PC的酰基流的同时降低PC外途径的延长反应。通过减少作为DGAT2底物的羟化脂酰-CoA,快速的PC-DAG互相转变可能对对酰基编辑有影响;最后,RcROD1补偿了由于表达FAH12的种子油含量的降低。这些结果都显示蓖麻PDCT有效转化PC(特别是羟化脂酰-PC)形成DAG,最终形成TAG[32]。
3 结束语
蓖麻油是蓖麻油酸的唯一商业来源。然而,蓖麻子含有蓖麻毒蛋白、蓖麻碱、过敏原等毒素,这使得它在种植,收割和加工中存在着危险,并且种子必需人工收割,不适宜大面积种植。油酰-12-羟化酶的克隆为我们进行其它油料作物的分子育种提供了机会,但与天然蓖麻相比,在拟南芥中的表达结果不理想,种子油中只有低水平蓖麻醇酸酯的积累。有两个反应能导致蓖麻油酸水平的降低,一是油酰脱氢酶与油酰羟化酶竞争油酸库,另一个是蓖麻油酸的延长反应和进一步脱氢反应。了解蓖麻组装TAG的过程及积累近90%的蓖麻油酸的特异性的原因是成功进行基因改良作物研究的基础,同时,相关脂类的基本代谢途径的研究也有利于通过基因工程生产其他的高经济价值的脂肪酸。经过进一步研究,蓖麻醇酸酯在蓖麻种子中的大量积累,是相关酶对底物特异性选择的结果,现已确定了几个关键酶促步骤,包括:AAT[16]、FAH12[18]、DGAT[22]、PDAT[28,30]、PDCT[31]、PLA2[33]、LPCAT[34]等,使得利用遗传工程手段调控脂肪酸代谢途径、改变脂肪酸成分成为可能,为生产无蓖麻毒蛋白的转基因植物提供可能,同时为提高植物脂作为大量可再生的低碳资源提供了机遇。在过去的许多年里,人们已经意识到在代谢工程中仅对单个基因进行操作产生的价值有限,因此,为达到最佳的代谢通量应着眼于更复杂的途径,即同时涉及多个基因的过表达或抑制[35]。Brown等[36]研究发现,蓖麻油酰-CoA并不是发育中种子胚乳的主要脂酰-CoA,显示在此组织中代谢通路和酶底物的选择性对于三酰甘油合成是非常重要的,通过对组织特异性的全转录组测序并分析后,获得一些可能对RRR合成有重要作用的候选基因,在转基因植物中进一步表达这些基因可能使其产生的HFA水平更高。实践表明,脂类的积累涉及到多条生物合成与分解代谢途径,不可能通过特异表达一种基因来大幅提高脂类含量,而调控相关转录因子,带动代谢途径中一系列基因超量表达,可以使脂类水平大大提高。最近,在突变拟南芥种子中鉴定出WRI1(Wrinkled 1)转录因子,在拟南芥WRI1突变种子中TAG含量与野生型相比降低了80%。超表达WRI1可显著增加种子TAG含量。在玉米中超表达WRI1基因,种子含油量提高48%,拟南芥中异源表达油菜WRI1,种子含油量提高了10~40%,说明WRI1基因在提高植物种子含油量育种方面具有很高的应用价值[36]。Tajima等[37]依据蓖麻全基因组序列,鉴定了几个与WRI1同源的基因,经半定量PCR及免疫印迹试验,结果显示RcWRI1可能在种子发育过程中对于TAG储存具有重要作用。Brown等[36]也得到了一些在蓖麻油代谢中有作用的转录因子,研究这些转录因子的基因表达将有助于揭示这些转录因子调控蓖麻油合成机理,同时对于进一步改良油料作物含油量有重要的理论意义和实际意义。
[1]Chan A P, Crabtree J, Zhao Q, et al. Draft genome sequence of the oilseed species Ricinus communis[J],Nature Biotechnology,2010,28(9):951-956
[2]Da Silva Ramos L C, Shogiro Tango J, Savi A,et al. Variability for oil and fatty acid composition in castorbean varieties[J]. Journal of the American Oil Chemists’ Society,1984,61(12): 1841-1843
[3]Lin J T, Turner C, Liao L P, et al. Identification and quantification of the molecular species of acylglycerols in castor oil by HPLC using ELSD[J]. Journal of Liquid Chromatography & Related Technologies,2003,26 (5): 773-780
[4]Lin J T, Lew K M, Chen J M, et al. Metabolism of 1-acyl-2-oleoyl-sn-glycero-3-phosphoethanolaminein castor oil biosynthesis[J]. Lipids,2000, 35(5): 481-486
[5]Lin J T, Arcinas A, Harden L A, et al. Identification of (12-ricinoleoylricinoleoyl) diricinoleoylglycerol, an acylglycerol containing four acyl chains, in castor (Ricinus communis L.) oil by LC-ESI-MS[J]. Journal of Agricultural and Food Chemistry, 2006,54(10): 3498-3504
[6]Lin J T, Arcinas A. Regiospecific analysis of diricinoleoylacylglycerols in castor (Ricinus communis L.) oil by electrospray ionization-mass spectrometry[J]. Journal of Agricultural and Food Chemistry,2007,55(6):2209-2216
[7]Lin J T, Woodruffa C L, Lagouchea O J, et al. Biosynthesis of triacylglycerols containing ricinoleate in cCastor microsomes using 1-Acyl-2-oleoyl-sn-glycero-3-phosphocholine as the substrate of oleoyl-12-hydroxylase[J]. Lipids, 1998,33(1):59-69
[8]McKeon T A, Chen G Q, He X. et al. The Enzymology of Castor Oil Biosynthesis[C]. Association for the Advancement of Industrial Crops Conference. 2007,101-104
[9]Brown A P, Kroon J T M, Topping J F, et al. Components of complex lipid biosynthetic pathways in developing castor (Ricinus communis) seeds identified by MudPIT analysis of enriched endoplasmic reticulum[J]. Journal of Proteome research,2011(10): 3565-3577
[10]Alexandro Cagliari, Márcia Margis-Pinheiro, Guilherme Loss, et al.Identification and expression analysis of castor bean (Ricinus communis) genes encoding enzymes from the triacylglycerol biosynthesis pathway[J]. Plant Science, 2010,179 (5):499-509
[11]Lung S C, Weselake R J. Diacylglycerol acyltransferase: a key mediator of plant triacylglycerol synthesis[J]. Lipids, 2006,41(12):1073-1088
[12]Koo A J K, Ohlrogge J B, Pollard M. On the export of fatty acids from the chloroplast[J]. The Journal of Biological Chemistry, 2004,279(16):16101-16110
[13]Jones A, Davies H M, Voelker T A. Palmitoyl-acyl carrier protein (ACP) thioesterase and the evolutionary origin of plant acyl-ACP thioesterases[J].The Plant Cell,1995,7(3):359-371
[14]Dörmann P, Voelker T A, Ohlrogge J B. Accumulation of palmitate in Arabidopsis mediated by the acyl-acyl carrier protein thioesterase FATB1[J]. Plant Physiology,2000,123(2):637-644
[15]Voelker T A, Jones A, Cranmer A M, et al. Broadrange and binary-range acyl-acyl-carrier-protein thioesterases suggest an alternative mechanism for medium-chain production in seeds[J]. Plant Physiology.1997,114(2): 669-677
[16]Sanchez-Garcia A, Moreno-Perez A J, Muro-Pastor A M, et al. Acyl-ACP thioesterases from castor (Ricinus communis L.): An enzymatic system appropriate for high rates of oil synthesis and accumulation[J]. Phytochemistry,2010,71(8-9):860-869
[17]He X, Chen G Q, Lin J T, et al. Regulation of diacylglycerol acyltransferase in developing seeds of castor[J]. Lipids, 2004,39(9):865-871
[18]Van de Loo F J, Broun P, Turner S, et al. An oleate 12-hydroxylase from Ricinus communis L. is a fatty acyl desaturase homolog[J]. Proceedings of the National Academy of Sciences of the United States of America,1995,92(15): 6743-6747
[19]Broun P, Somerville C. Accumulation of ricinoleic, lesquerolic, and densipolic acids in seeds of transgenic Arabidopsis plants that express a fatty acyl hydroxylase cDNA from castor bean[J]. Plant Physiology,1997,113(3), 933-942
[20]Lu C, Kang J. Generation of transgenic plants of a potential oilseed crop Camelina sativa by Agrobacterium-mediated transformation[J]. Plant Cell Reports,2008,27(2):273-278
[21]Smith M A, Moon H, Chowrira G, et al. Heterologous expression of a fatty acid hydroxylase gene in developing seeds of Arabidopsis thaliana[J]. Planta,2003,217(3): 507-516
[22]Burgal J, Shockey J, Lu C, et.al. Metabolic engineering of hydroxy fatty acid production in plants: RcDGAT2 drives dramatic increases in ricinoleate levels in seed oil[J]. Plant Biotechnology Journal,2008,6(8):819-831
[23]Turchetto-Zolet A C, Maraschin F S, de Morais G L, et al. Evolutionary view of acyl-CoA diacylglycerol acyltransferase (DGAT), a key enzyme in neutral lipid biosynthesis[J]. BMC Evolutionary Biology, 2011,11:263
[24]He X, Turner C, Chen G Q, et al. Cloning and characterization of a cDNA encoding diacylglycerol acyltransferase from castor bean[J]. Lipids, 2004,39(4): 311-318
[25]Kroon J T, Wei W, Simon W J, et al. Identification and functional expression of a type 2 acyl-CoA:diacylglycerol acyltransferase (DGAT2) in developing castor bean seeds which has high homology to the major triglyceride biosynthetic enzyme of fungi and animals[J]. Phytochemistry ,2006,67(23): 2541-2549
[26]Chen G Q, Turner C, He X, et al. Expression profiles of genes involved in fatty acid and triacylglycerol synthesis in castor bean (Ricinus communis L.) [J]. Lipids,2007,42(3): 263-274
[27] Li R,Yu K, Hildebrand D F. DGAT1, DGAT2 and PDAT Expression in Seeds and Other Tissues of Epoxy and Hydroxy Fatty Acid Accumulating Plants[J]. Lipids, 2010, 45(2): 145-157.
[28]Kim H U, Lee K R, Go Y S, et al. Endoplasmic Reticulum-Located PDAT1-2 from Castor Bean Enhances Hydroxy Fatty Acid Accumulation in Transgenic Plants[J]. Plant Cell Physiology, 2011, 52(6): 983-993
[29]Dahlqvist A, Stah U, Lenman M, et al. Phospholipid:diacylglycerol acyltransferase: anenzyme that catalyzes the acyl-CoA-independent formation oftriacylglycerol in yeast and plants[J]. Proceedings of the National Academy of Sciences of the United States of America. 2000,97 (12):6487-6492
[30]Van Erp H., Bates P D, Burgal J, et al. Castor phospholipid:diacylglycerol acyltransferase facilitates efficient metabolism of hydroxy fatty acids in transgenic Arabidopsis[J]. Plant Physiology, 2011,155(2): 683-693
[31]Lu C, Xin Z, Ren Z, et al. An enzyme regulating triacylglycerol composition is encoded by the ROD1 gene of Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009,106(44): 18837-18842
[32]Hu Z, Ren Z, Lu C. The phosphatidylcholine diacylglycerol cholinephosphotransferase is required for efficient hydroxy Fatty Acid accumulation in transgenic Arabidopsis[J]. Plant Physiology, 2012,158(4): 1944-1954
[33]Lin J T, Woodruff C L, Lagouche O J, et al. Biosynthesis of triacylglycerols containing ricinoleate in castor microsomes using 1-acyl-2-oleoyl-sn-glycerol-3-phosphocholine as the substrate of oleoyl-12-hydroxylase[J]. Lipids.1998,33(1), 59-69
[34]Arroyo-Caro J M, Chileh T, Alonso D L, et al. Molecular Characterization of a LysophosphatidylcholineAcyltransferase Gene Belonging to the MBOAT Family in Ricinus communis L[J]. Lipids,2013,48(7):663-674
[35]Lu C, Fulda M, Wallis J G, et al. A high-throughput screen for genes from castor that boost hydroxy fatty acid accumulation in seed oils of transgenic Arabidopsis[J]. The Plant Journa,2006, 45(5):847-856
[36]Brown A P, Kroon J T, Swarbreck D, et al. Tissue-specific whole transcriptome sequencing in castor, directed at understanding triacylglycerol lipid biosynthetic pathways[J]. PLoS ONE, 2012,7(2):1-13
[37]Tajima D, Kaneko A, Sakamoto M, et al. Wrinkled 1 (WRI1) Homologs, AP2-type transcription factors involving master regulation of seed storage oil synthesis in castor bean (Ricinus communis L.)[J]. American Journal of Plant Sciences, 2013, 4(2): 333-339.
