食品中16种邻苯二甲酸酯类塑化剂的GC-MS检测方法研究
2014-06-11梁德沛孙远明柳春红
褚 玥 梁德沛 孙远明,3 柳春红,3 刘 辉
(华南农业大学食品学院1,广州 510642)(广东省产品质量监督检验研究院顺德基地2,佛山 528300)(广东省食品质量安全重点实验室3,广州 510642)
刘辉,男,1980年出生,博士,食品科学与工程
邻苯二甲酸酯(Phthalate acid esters,PAEs)是塑料工业中普遍使用的一类化学物质,主要用作增塑剂和软化剂,可增大塑料的可塑性和韧性,提高塑料的强度。PAEs的某些种类还可用作农药载体、驱虫剂、化妆品、润滑剂和去污剂的生产原料。据统计2009年世界增塑剂产能约910万t,产量约710万t,其中PAEs增塑剂约占总产量的88%,近年来,由于塑料制品的广泛使用,该类化合物的产量也在逐年增加[1]。大量塑料制品废弃后其中所包含的PAEs必将被释放到周边环境,已有报道多个城市饮用水受到不同程度PAEs污染,主要来源于环境中废弃塑料制品PAEs的释放[2-3]。PAEs与塑料之间通过氢键和范德华力相联结,彼此保持独立的化学性质,由于结合不紧密,所以容易从塑料中挥发迁移至环境中。有研究报道,蔬菜对土壤中PAEs具有较强的吸收累积能力,不同蔬菜类型、不同地点、不同PAEs污染类型下蔬菜的累积量不同[4-5],此外,PAEs与食品直接接触时,易迁移到食品中,污染食品[6]。目前,在大气、水体、土壤、生物乃至人体等自然和人类环境中普遍发现PAEs的存在,在全球主要工业国家环境中均已达到普遍检出的程度,已成为全球性最普遍的一类有机污染物,被称为第2个全球性“PCB污染物”[7]。中国国家环保总局和美国环保署(EPA)已将邻苯二甲酸二甲酯、邻苯二甲酸二乙酯等6种PAEs列为优先控制的有毒污染物。REACH法规亦将邻苯二甲酸二(2-乙基己基)酯、邻苯二甲酸丁苄酯、邻苯二甲酸二丁酯、邻苯二甲酸二异丁酯列为高关注物质[8]。PAEs是脂溶性物质,一旦进入人体,便很快积蓄在脂肪组织里,不易排泄出去,富集人体内,从而导致人体内残留着高浓度的邻苯二甲酸酯[9]。研究表明,PAEs具有一定的急性毒性,生殖毒性,在体内长期累积有致癌、致突变等毒性,并具有一定的内雌激素活性[10-14]。
目前,PAEs的测定方法主要有气相色谱-质谱法和液相色谱-质谱法,大多数针对塑料制品、电子电器产品或环境样品、土壤栽培农作物中污染程度的测定,也有针对食品中PAEs迁移量检测的报道[15]。但是大多研究都只针对单一种类的食品,针对不同种类的食品中PAEs的检测,特别是对机制复杂、高油脂食品中PAEs的研究略有不足。本试验对不同类型的食品分别进行了研究,比较了不同萃取溶剂和萃取方法的检测结果,优化了样品分离、净化方法及测定条件,建立了同时测定16种PAEs的GC-MS方法。
1 材料与方法
1.1 仪器与试剂
GCMS-QP2010Plus气相色谱-质谱联用仪:日本岛津公司;DM-5MS弹性石英毛细管(60 m×0.25 mm×0.25μm)色谱柱:美国J&W Scient if ic公司;GPC凝胶色谱仪:美国J2 scientific公司;N-1001DWA旋转蒸发仪:东京理化(上海)公司; PSA固相萃取小柱:DIKMA公司。16种邻苯二甲酸酯(PAEs):Dr.Erenstorfer,Gremany公司;正己烷、乙酸乙酯、环己烷、二氯甲烷、乙腈(均为色谱纯):TEDIA公司;氯化钠(AR)、无水硫酸钠(AR)、Florisil硅藻土(AR)等其余试剂:天津市大茂化学试剂厂。
1.2 标准曲线的配制
单标储备液:配制16类PAEs实验所用的单标储备液的质量浓度为4 000 mg/L,4 ℃冰箱中保存备用。混合标准系列溶液的制备:取一定量的4 000 mg/L的PAEs的单标储备液,用正己烷配成5.00 mg/L的混合标准溶液, 4℃冰箱中保存备用。取5.00 mg/L的混合标准溶液适量用正己烷分别稀释成质量浓度为20、100、500、1 000、2 000、5 000 μg/L的PAEs的标准列,4 ℃冰箱中保存备用。
1.3 样品前处理
1.3.1 不含油的水性样品
此类样品包括饮用水、果汁、功能饮料、可乐等饮料。准确移取样品5 mL,加至10 mL玻璃离心管中,准确加入正己烷2.0 mL,充分旋涡混合,20 ℃水浴超声萃取20 min,3 000 r/min离心10 min,取上清液进行GC-MS分析。
1.3.2 不含油的固体样品
称取5 g样品于50 mL具塞玻璃管中,加入25 mL的正己烷,漩涡混合1 min,20 ℃水浴超声萃取30 min。取上清液旋转蒸发至干,正己烷定容至2 mL,上机GC-MS检测。
1.3.3 GPC凝胶渗透色谱柱
柱分离度:玉米油与邻苯二甲酸二(2-乙基)己酯的分离度>85%;流动相:乙酸乙酯:环己烷(1∶1);流速:4.5 mL/min; 流出液收集时间:18~34 min。
1.3.4 乳制品
称取2 mL样品于10 mL玻璃离心管中,加入4 mL的正己烷,1 g氯化钠,充分漩涡混合, 20 ℃水浴超声萃取20 min,3 000 r/min离心,10 min,取上清液,氮吹浓缩至干,用乙酸乙酯:环己烷(体积比1∶1)定容至10 mL,漩涡混合2 min,经GPC凝胶渗透色谱装置净化,收集流出液(参考条件见1.3.3),经氮吹干,正己烷定容至2 mL,进行GC-MS分析。
1.3.5 食用油
称取0.5 g(精确至0.1 mg)油脂类样品,加入50 mL具塞玻璃管中,加入正己烷25 mL,漩涡混合1 min, 20 ℃水浴超声萃取30 min,取上清液,旋转蒸发浓缩至干,用乙酸乙酯:环己烷(体积比1∶1)定容至10 mL,漩涡混合2 min,经GPC凝胶渗透色谱装置净化,收集流出液(参见1.3.3),经氮吹干,正己烷定容至2 mL,进行GC-MS分析。
1.3.6 油脂类固体
称取0.5 g(精确至0.1 mg)油脂类样品,加入50 mL具塞玻璃管中,首先用25 mL正己烷提取1次,漩涡混合1 min,20 ℃水浴超声萃取30 min,静置分层,取上清液于茄型瓶中,再用25 mL正己烷二次提取,收集上清液,旋转蒸发至干,用乙酸乙酯:环己烷(体积比1∶1)定容至10 mL,漩涡混合2 min,经GPC凝胶渗透色谱装置净化,收集流出液(参见1.3.3),经氮吹干,正己烷定容至2 mL,进行GC-MS分析。
1.4 GC-MS分析条件
样品采用选择离子检测模式(SIM),分组检测见表1所示。

表1 SIM模式下PAEs质谱测定的保留时间和特征离子
电子轰击离子源(EI),电子能量70 eV, 离子源温度230 ℃。进样口温度:280 ℃,不分流进样,进样量1 μL,载气为氦气,载气流速0.5 mL/min,碰撞气为氩气,柱初始温度120 ℃,保持1 min,以20 ℃/min升温至220 ℃,保持2 min, 以10 ℃/min升温至250 ℃,保持4 min,再以以20 ℃/min升温至310 ℃,保持10 min。接口温度: 310 ℃,溶剂延迟:3.5 min。
为避免样品中其他组份的干扰和提高灵敏度,采用GC-MS的选择离子检测(SIM)方式。在SIM模式下,检测器只检测选定的特征离子,在相同扫描周期内,用以检测每个离子的时间更长,因而比全扫描(SCAN)模式灵敏度高5~100倍,使采集的灵敏度和重现性达到最优。
2 结果与分析
2.1 前处理条件的优化
2.1.1 提取溶剂的选择
向样品(香肠)中加入16类PAEs的标准溶液500 μg/kg按1.3.3的步骤进行提取,比较了表2中所列溶剂的提取效果。
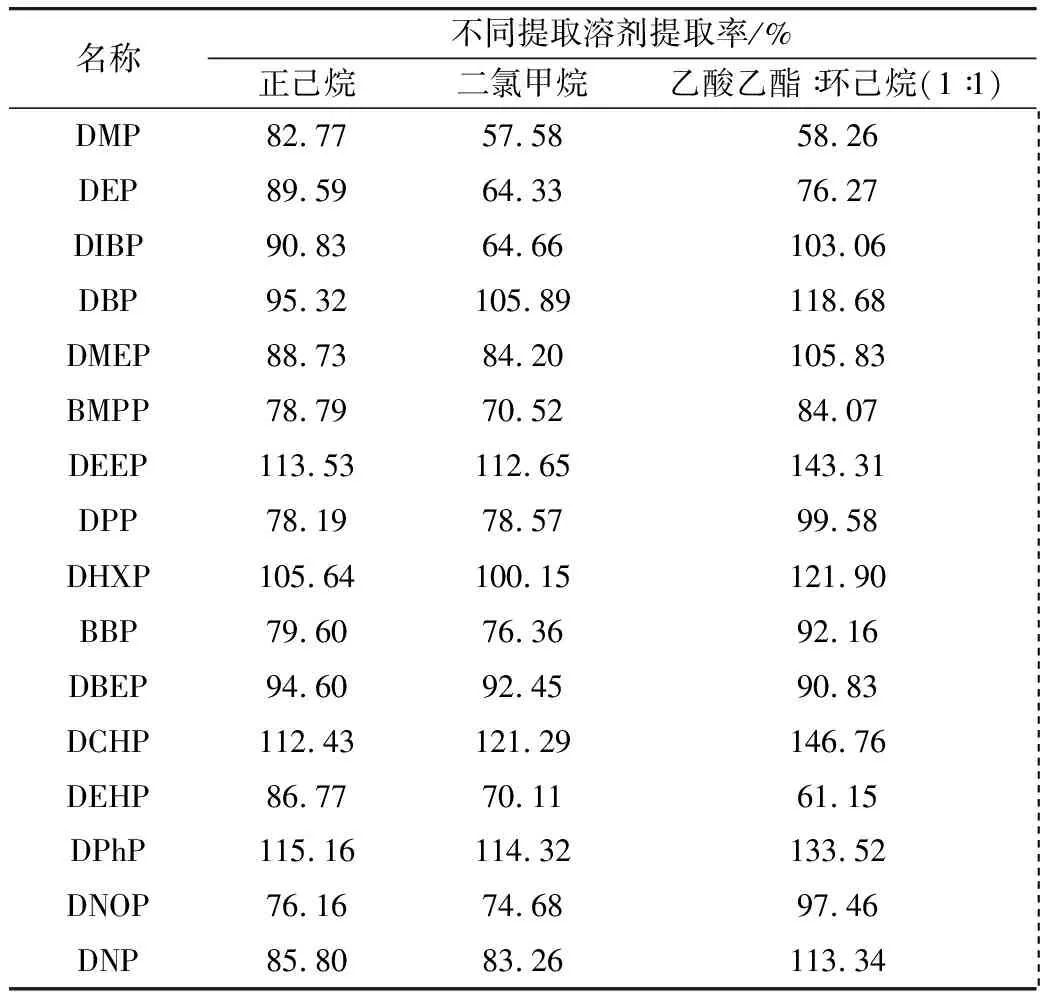
表2 不同提取溶剂的提取率
结果表明,提取效率:正己烷> 二氯甲烷>乙酸乙酯∶环己烷(1∶1),其中,乙酸乙酯∶环己烷(1∶1)部分PAES如DEEP、DCHP回收率过高,溶剂带入本底过高,而二氯甲烷毒性较大。 综上,选用正己烷为提取溶剂。
2.1.2 萃取方法的选择
目前,针对含油脂类固体中PAEs的萃取方法可采用液-液萃取、柱层析分离、固相萃取以及固相微萃取等。试验向样品(香肠)中加入16类PAES的标准溶液,以正己烷作为提取溶剂,对比了PSA固相萃取法(玻璃萃取小柱500 mL/6 mL,依次加入5 mL丙酮、5 mL正己烷,弃去流出液,进行活化,油脂类样品提取液2 mL进样,流速控制在1 mL/min,收集流出液洗脱,再依次加入5 mL正己烷、5 mL 4%丙酮-正己烷,收集合并流出液,40 ℃氮吹至1 mL GCMS上机检测);弗罗里硅土玻璃层析柱法[16];GPC法按1.3.6进行,加标回收率如表3。

表3 不同萃取方法对16类PAEs的提取效果
结果表明,正己烷液液提取时,提取率:GPC>PSA-SPE>弗罗里硅土-SPE。其中,使用填料为PSA 的固相萃取小柱时,其去除脂肪酸和油脂的能力较好,对大部分PAES的提取效率较好,较GPC法操作方便,但是PSA-SPE对BMEP和BMPP的吸附作用过大,导致这2种PAES的提取效率过低。GPC法16类PAES的提取率在76.16%~115.16 %之间,萃取效果较好,且GPC去除脂肪能力较好。因而,本试验选用GPC法对样品进行萃取。
2.2 定性分析
根据本试验所确定的分析条件,将16种邻苯二甲酸酯类化合物混合标准溶液进样,以保留时间定性,分离效果见图1。
由图1可以看出,16种化合物能在22.5 min内有效地分开,峰型尖锐,对称性好,出峰附近都没干扰峰,各峰间隔适宜,是理想的色谱检测条件。

图1 16种邻苯二甲酸酯的总离子图
2.3 线性关系和检出限
在确定的色谱和质谱分析条件下对一系列标准工作溶液进行GC-MS分析,以定量离子的峰面积对被测组分的质量浓度进行回归分析。以大于3倍信噪计算检出限。标准曲线的线性范围、线性方程、相关系数和检出限见表4。由表4可知,16种邻苯二甲酸酯类物质在20 ~5 000 μg/L范围内线性关系良好,线性相关系数均大于0.999,16种邻苯二甲酸酯类物质在食品中的检出限为0.02 mg/kg。

表4 16种邻苯二甲酸酯类化合物标准曲线线性方程、相关系数及检出限
2.4 回收率与精密度
在碳酸饮料、水果、油类、乳制品、肉制品等混样中分别添加200、500、1 000 ng的邻苯二甲酸酯,平行3次,GC-MS检测,结果见表5。
由表5可见,当添加邻苯二甲酸酯类增塑剂浓度为0.40~2.00 mg/kg时,回收率为75%~115%之间,RSD为1.00%~10%,说明本方法准确可靠。

表5 肉类样品中16种邻苯二甲酸酯类化合物的加标回收率和相对标准偏差
注:1)邻苯二甲酸酯混合加标量为200 ng;2)邻苯二甲酸酯混合加标量为500 ng;3)邻苯二甲酸酯混合加标量为1 000 ng。
2.5 实际样品检测
本试验选用碳酸饮料、乳制品、非油脂类蔬菜水果、油脂类固体食品5类8种食品混样作为研究对象,样品经正己烷溶解、超声波辅助提取、GPC凝胶色谱法萃取浓缩富集等预处理后GC-MS分析,样品加标及其实际检测的色谱图见图2和图3,测定结果见表6。

表6 样品中PAEs的检测结果
注:ND表示未检测到。
检测结果表明,采集的食品样品中均有不同程度PAEs污染,检出的PAEs种类有DMP、DEP、DIBP、DBP和DEHP,其余11种PAEs未检出。8种食品混样中饮料类未检出PAEs,酒类中DIBP检出率最高;乳类和水果类中仅检出DEHP含量较高;而对于肉类、油类、水产类和蛋类等动物性食品DIBP、DBP、DEHP的污染程度较高,这是由于邻苯二甲酸酯是脂溶性的化合物,接触到油脂时易于从包装材料中溶出,转移到食品中。在被检出有PAEs的样品中,几乎都有DEHP,因为DEHP是塑料中主要的增塑剂,它的生产量和使用量都远高于其他的邻苯二甲酸酯类化合物。

图2 16种PAEs在肉类样品加标水平为2 mg/kg的色谱图

图3 肉类样品的气质色谱图
2.6 干扰的排除
试验中应避免使用塑料制品,试验前对试剂、试验用水、玻璃仪器等必须进行净化处理,所用的玻璃器皿需要用清洁剂清洗,再水洗、丙酮浸泡2 h,然后用重蒸的正己烷清洗2次,在200 ℃焙烘2 h;并且测定试剂空白,进行比较和扣除。
3 结论
本试验建立了气相色谱-质谱(GC-MS)法同时测定不同类别食品中16种邻苯二甲酸酯的分析方法,研究了不同类别食品的分离、净化方法,优化了色谱分离条件,通过提取特征离子进行检测和确证,消除了基质干扰,避免产生假阳性结果,同时对不同食品中PAEs的污染状况进行了初步评估。本方法系统、全面、准确、可靠,定量下限达0.02 mg/kg,可应用于各类食品中邻苯二甲酸酯类的测定,对于食品中邻苯二甲酸酯的污染监控检测具有十分重要的意义。
[1]吴继军,徐玉娟,肖更生,等. 果酒中邻苯二甲酸单-2-乙基己基酯检测方法研究[J].北京工商大学学报:自然科学版,2011,29(4):39-41
[2]戴树桂,张东梅,张仁江,等.环境水样中邻苯二甲酸酯固相膜萃取预富集方法[J].中国环境科学,2000,20(2):146-149
[3]杨润,刘华良. 饮用水中16种邻苯二甲酸酯的气相色谱-质谱测定法[J].环境与健康杂志,2012,29(9):825-827
[4]FU X W,DU Q Z.Uptake of di-(2-ethylhexyl) phthalate of vegetables from plastic film greenhouses[J].Journal of Agricultural and Food Chemistry,2011,59(21):11585-11588
[5]王家文,杜琪珍,宋英琦.塑料工业区附近农田蔬菜DEHP的浓度水平及评价[J].环境科学,2010,31(10):2450-2455
[6]李婷,汤智,洪武兴. 分散固相萃取-气相色谱-质谱法测定含油脂食品中17种邻苯二甲酸酯[J].分析化学,2012,40(3):391-396
[7]US Environmental Protection Agency.Microbial source tracking guide[C].Washington,D C:Document EPA/600/R-05/064US Environmental Protection Agency,2005
[8]蔡晶,柴丽月,胡秋辉.食品中邻苯二甲酸酯的检测及安全评价[J].食品科学,2005,26(12):242-245
[9]Guo Y ,Wu Q , Kannan K. Phthalate metabolites in urine from China and implications for human exposures[J].Environment International,2011,37(5):893-898
[10]Call D J, Markee T P, Geiger D L, et al, An assessment of the toxicity of phthalate sters to fresh water benthos.1.Aqueous exposures[J]. Environmental Toxicology and Chemistry,2001,20(8):1798-1804
[11]Anderson D, Yu T W, Hincal F. Effect of some phthalate esters in human cells in the comet assay[J]. Teratogenesis, Carcinogenesis, and Mutagenesis,1999,19(4):275-280
[12]黄昕,厉曙光.酞酸酯毒性作用及其机制的研究进展[J].环境与职业医学,2004,21(3):198-201
[13]刘慧杰.邻苯二甲酸酯类化合物的毒理学效应及对人群健康的危害[J].第三军医大学学报,2004,26(19):1778-1781
[14]Sonnenschein C, Soto A M. An updated review of environmental estrogen and androgen mimics and antagonists[J]. The Journal of Steroid Biochemistry and Molecular Biology,1998,65(16):143-150
[15]杨博锋,汤志旭,高昕,等. 高效液相色谱法测定纸制食品接触材料中邻苯二甲酸酯的迁移量[J].分析测试学报,2012,31(12):1272-1276
[16]胡银川,李明元,谢晖,等. 塑料桶装食用油中邻苯二甲酸酯固相萃取方法研究[J]. 食品工业科技,2011,32(3):404-406
