油茶脂肪酸代谢途径中关键酶基因调控油脂合成的规律研究
2014-06-11曾艳玲谭晓风张党权陈鸿鹏曾晓峰许淑娴
曾艳玲 谭晓风 张党权 陈鸿鹏 曾晓峰 朱 勇 许淑娴 陈 力
(经济林育种与栽培国家林业局重点实验室 中南林业科技大学林学院1,长沙 410004)(国家林业局桉树研究开发中心2,湛江 524022)(中南林业科技大学食品科学与工程学院3,长沙 410004)
油茶是我国特色食用油料树种,其产物茶油不仅不饱和脂肪酸质量分数高达80%,而且富含十六烷酰胺和角鲨烯等具保健功能的生物活性物质[1],长期食用可降血脂血压,预防心脑血管疾病[2]。茶油之所以品质优良,主要是由于在茶油形成过程中油脂代谢途径各调控酶起着关键作用。酰基载体蛋白(ACP)是脂肪酸合成中的关键蛋白质之一,位于脂肪酸合成酶系的中央,作为脂酰基的载体将脂酰基从一个酶反应转移到另一个酶反应[3-4],因此ACP基因是调控饱和脂肪酸与不饱和脂肪酸比例的必要基因;硬脂酰-ACP 脱饱和酶(SAD)基因调控硬脂酸脱氢形成油酸,因此,直接决定了不饱和脂肪酸的总含量以及饱和脂肪酸与不饱和脂肪酸的比例[5-6];油酸脱氢形成亚油酸和亚麻酸则由油酸脱氢酶(FAD)基因家族调控,其中FAD2调控油酸的第12和13位碳原子之间形成双键,生成亚油酸,因此FAD2决定了油酸和亚油酸的比例[7-8]。这几个基因的表达调控作用主导着茶油不饱和脂肪酸含量的多少及品质的差异,因此本试验拟通过研究油茶种仁中ACP、SAD和FAD2基因的表达规律,结合相应发育时期油茶种仁含油率及脂肪酸成分变化,揭示油脂合成关键酶基因表达对油脂合成的影响。
1 材料与方法
1.1 材料与主要试剂
油茶籽:湖南省长沙市望城县东城镇油茶基地,国审品种 “华硕”和普通油茶“望城1号”,取材时间为5月5日、6月5日、7月4日、8月4日、8月15日、8月25日、9月4日、9月11日、9月19日、9月26日、10月3日、10月10日、10月24日。
石油醚(30~60 ℃)、正庚烷(色谱纯)、甲醇、氢氧化钾、无水硫酸钠:国药集团化学试剂有限公司;RNA抽提试剂盒(PureLinkTMRNA Mini Kit):美国Invitrogen公司;荧光定量试剂盒(QuantiFast SYBR Green PCR Kit):德国QIAGEN公司;逆转录试剂盒(PrimeScript RT reagent Kit With gDNA Eraser):日本TaKaRa公司,所有RNA提取所用溶液均用灭菌的DEPC水配制。 所用引物均由北京华大生物技术有限公司合成。
1.2 主要仪器与设备
FOSS SCINO ST310油脂萃取系统:诺斯高斯分析仪器苏州有限公司;G6890A气相色谱仪(FID 检测器):美国安捷伦科技公司;实时荧光PCR仪(CFX96)、核酸浓度测定仪:伯乐生命医学产品(上海)有限公司;高速冷冻台式离心机:美国贝克曼库尔特有限公司;空气加热器:英国TECHNE公司。
1.3 试验方法
1.3.1 油脂提取
参照国标GB /T 14772—2008 索氏抽提法。
1.3.2 脂肪酸成分测定
脂肪酸成分测定釆用碱式甲酯化法测定[9]。气相色谱分析30 m×0.25 μm×0.25 mm FFAP毛细管柱;色谱柱温度:60 ℃→180 ℃(25 ℃/min,停留1 min) →210 ℃(3 ℃/min,停留 1 min) →212 ℃(0.3 ℃/min,停留1 min) →240 ℃(8 ℃/min,停留 2 min),进样口温度: 240 ℃,检测器温度:240 ℃,分流比为1∶50,载气流流速:N21.23 mL/min,压缩空气 400 mL/min,H240 mL/min,进样量为 1 μL。
1.3.3 实时荧光定量PCR检测
油茶种仁RNA提取:PureLinkTMRNA Mini Kit说明书;RNA逆转录cDNA:PrimeScript RT Rreagent Kit With gDNA Eraser 说明书。
实时荧光定量PCR引物分别为:qACPF:5’-ATTCAAGCAAAACCAGGCG-3’/ qACPR:5’-CACACGAAATCCGAAAACG-3’,qSADF:5’-GTTCAAGTAACGCACTCCAT-3’/ qSADR:5’-TTGCCAACATTTCTCCACAG-3’,q FAD2F: 5’-CCCAGCAACCAAACATGAAC-3’/ q FAD2R: 5’-GAATGAGCGGAGGAGAGAAC-3’;反应体系为:2×QuantiFast SYBR Green PCR Master Mix 12.5 μL,10 μmol/L引物对各0.5 μL,模板cDNA 1 μL,无菌纯水补足25 μL;循环条件为95 ℃预变性 5 min; 95 ℃变性10 s,55 ℃退火30 s,共40循环。
2 结果与分析
2.1 种仁含油率和脂肪酸成分变化规律
根据所测种仁含油率结果分析(图1),“华硕”和“望城1号”含油率均处于逐渐上升趋势,8月中旬含油率仅有2%~4%,到10月下旬含油率上升至50%~60%。比较“华硕”和“望城1号”两者差异,在各个果实发育时期,“望城1号”种仁含油率均高于“华硕”。采用软件SPSS 17.0进行配对样本T检验分析两者差异,结果显示为差异极显著。
根据脂肪酸成分分析(图2),8月至10月“华硕”棕榈酸含量均处于逐渐递减状态,由 8月15日15.16%降至10月24日5.58%,油酸含量则处于逐渐递增状态,由8月15日53.53%增至10月24日88.07%,亚油酸含量处于逐渐递减状态,由8月15日28.33%减至10月24日4.01%,说明油酸积累速度快于油酸转化亚油酸的速度,所以在油酸含量逐月递增的情况下,亚油酸含量反而递减;8月至10月“望城1号”棕榈酸含量也均处于逐渐递减状态,由 8月15日13.88%降至10月24日7.31%,油酸含量也处于逐渐递增状态,由8月15日59.14%增至10月24日86.33%,亚油酸含量处于逐渐递减状态,由8月15日24.09%减至10月24日4.03%,变化规律与“华硕”基本相同,但是两者对比发现“望城1号”各成分变化幅度均比“华硕’要小。
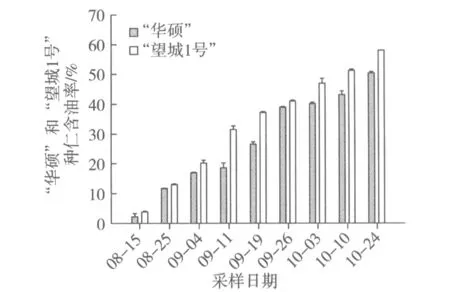
图1 油茶种仁不同发育时期含油率的变化

图2 油茶种仁不同发育时期棕榈酸、油酸和亚油酸的变化
2.2 调控脂肪酸代谢关键酶时空表达规律
本试验选取稳定表达的油茶甘油醛-3-磷酸脱氢酶基因(GAPDH)为内参基因[10],以 5月5日、6月5日、7月4日、8月4日、9月4日、9月11日、9月26日和10月24日采集的油茶种仁为材料,分析油茶酰基载体蛋白基因(CoACP)、油茶硬脂酰-ACP 脱饱和酶基因(CoSAD)和油茶油酸脱饱和酶基因(CoFAD2)的相对表达量(图3~图5)。
根据图3结果分析, 5月至10月期间,“华硕”CoACP相对表达量整体趋势为先上调后下调。7月至8月CoACP表达量迅猛增加,出现第一个表达高峰期,9月初有稍微回落,9月中旬重新上调,至9月下旬达到最大值,10月开始下调。这一结果与8月中旬棕榈酸含量是8月至9月期间最高值15.16%基本吻合(图2)。脂肪酸成分分析结果显示棕榈酸含量一直稳步下降,荧光定量结果显示“望城1号”CoACP相对表达量自8月后一直下调,这与棕榈酸含量下降规律一致,但是“华硕”荧光定量结果却显示9月初CoACP相对表达量有些许下调后9月中下旬才重新上调,这可能是因为脂肪酸合成酶是一个多酶复合体,在油茶种仁不同发育时期,发挥主效作用的单酶不同所致。
根据图4结果分析,5月至10月期间,“华硕”CoSAD相对表达量呈现先上调后下调的趋势。7月至8月CoSAD表达量迅猛增加,9月下旬达到最大值,10月开始下调。这与脂肪酸成分测定8月下旬油酸质量分数70.25%增至9月下旬85.08%后,油酸含量平稳增长的规律基本一致(图2)。“望城1号”CoSAD相对表达量也是呈现先上调后下调的趋势。但是其表达高峰期是在8月,比“华硕”早2个月,随后下调表达。这可能是 “望城1号”的油酸含量增幅比“华硕”要小的原因之一。
根据图5结果分析,5月至10月期间,“华硕”CoFAD2相对表达量呈现先上调后下调的趋势。7月至8月CoFAD2表达量迅猛增加,9月初表达量与8月表达量基本持平,9月中旬些许有些回落后,9月下旬达到最大值,10月开始下调。这与脂肪酸成分测定8月下旬亚油酸质量分数15.27%减至9月下旬5.51%后,亚油酸含量平缓减少的规律有所不符(图2)。这可能是因为CoFAD2是FAD基因家族[11]的成员之一,虽然是主效调控亚油酸合成的基因,但是还是受其他家族成员的调控影响。“望城1号”CoFAD2荧光定量结果则与脂肪酸成分中亚油酸含量下降的规律一致。

图3 油茶种仁不同发育时期CoACP相对表达量的变化
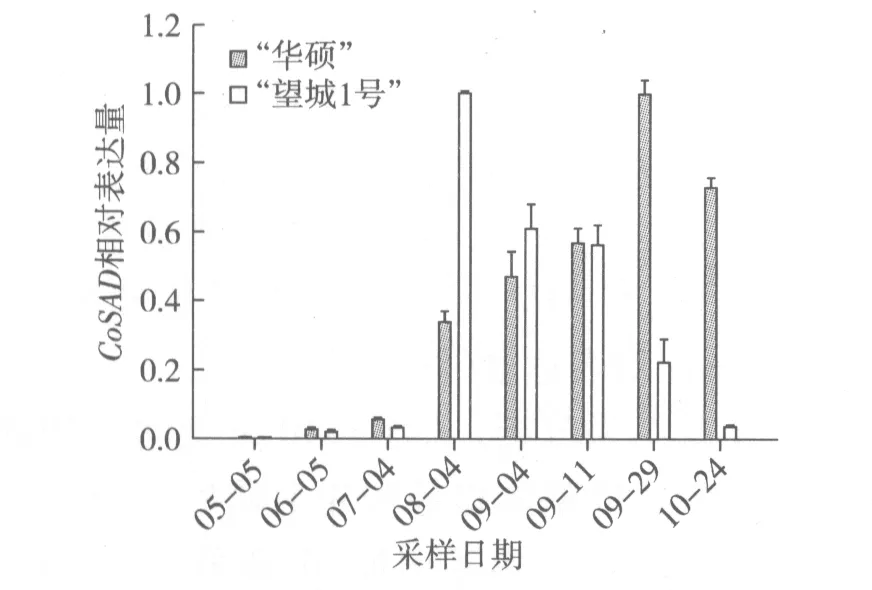
图4 油茶种仁不同发育时期CoSAD相对表达量的变化
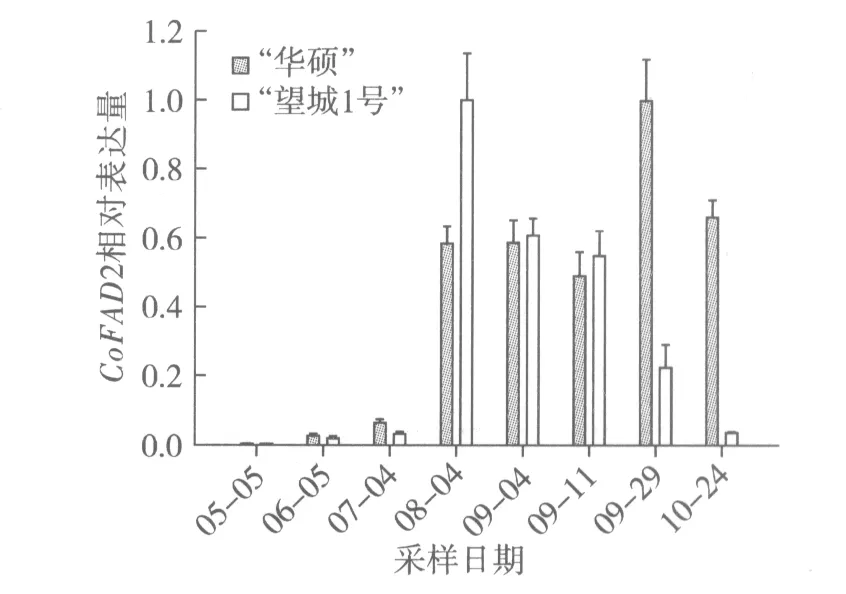
图5 油茶种仁不同发育时期CoFAD2相对表达量的变化

图6 不同发育时期油茶果实
3 讨论与结论
生物体在发育过程中没有永久关闭的基因。油茶果实发育过程中,随着不同相关基因的表达,表达丰度的差异,其含油率及脂肪酸各成分含量也随之变化。对比“华硕”和“望城1号”同时期种仁含油率,“望城1号”均高于“华硕”,但增长速率相当,说明“望城1号”较“华硕”先进入油脂合成时期,这可能与不同油茶品种果实发育周期相关。“华硕”果实发育期明显要长于“望城1号”(图6),“望城1号”在10月3日采摘时就已经有轻微裂果,10月24日完全成熟,而此时“华硕”还没有裂果成熟的迹象。根据脂肪酸成分分析,虽然10月24日的“华硕”种仁含油率比“望城1号”低,但是油酸及不饱和脂肪酸总含量高些,这说明“华硕”的确是品质优良的油茶品种[12],但其最适采收期要比普通油茶晚。
CoACP、CoSAD和CoFAD2是在油茶脂肪酸代谢途径中调控不饱和脂肪酸含量的关键酶,不同品种由于成熟期的差异在相同日期采摘的果实中相对表达量不同,“望城1号”的这3个基因表达高峰期均比“华硕”早1月有余,这也说明“望城1号”成熟期比“华硕”早1个月。根据相同发育时期种仁中基因表达量比较,不同油茶品种中CoACP、CoSAD和CoFAD2表达规律基本一致。结合脂肪酸成分和这3个基因表达蛋白的主调控作用分析,发现虽然调控产物含量变化和对应的基因表达规律大部分一致,但是“华硕”的CoFAD2表达规律与其亚油酸含量变化有所不符。有资料显示油菜、玉米、大豆等作物FAD2以多拷贝形式存在[13-15],油茶FAD2也可能是多拷贝的,不同拷贝的FAD2在同一个体存在表达差异,同时相同拷贝FAD2在不同个体间也存在表达差异,因此导致本试验中选用的CoFAD2表达规律与“望城1号”亚油酸含量变化一致,与“华硕”不符的结果。
[1]龙正海, 王道平.油茶籽油与橄榄油化学成分研究[J].中国粮油学报, 2008,23(2): 121-123
[2]廖书娟, 吉当玲, 童荣华.茶油脂肪酸组成及其营养保健功能[J].粮食与油脂, 2005 (6) : 7-91
[3]Majeru s P W. Acyl carrier protein. Structural requirements for function in fatty acid biosynthesis [J]. Journal of Biological Chemistry, 1967, 242 (10): 2325-2332
[4]谭晓风, 王威浩, 刘卓明, 等. 油茶ACP 基因的全长cDNA 克隆及序列分析[J]. 中南林业科技大学学报, 2008, 28(4): 8-14
[5]Kachroo A, Shanklin J, Whittle E, et al .The Arabidopsis stearoy-l acyl carrier protein-desaturase family and the contribution of leaf isoforms to oleic acid synthesis[J]. Plant Molecular Biology, 2007, 63(2) : 257-271
[6]张党权, 谭晓风, 陈鸿鹏,等. 油茶SAD 基因的全长cDNA 克隆及生物信息学分析[J]. 林业科学, 2008, 44(2): 155-159
[7]Marillia E F, Taylor D. Cloning andnucleotide sequencing of a cDNA encoding a Brassica carinata FAD2 (Accession No. AF124360) [J]. Plant Physiology, 1990, 120:339
[8]谭晓风, 陈鸿鹏, 张党权,等. 油茶FAD2 基因全长cDNA 的克隆和序列分析[J]. 林业科学, 2008, 44(3): 70-75
[9]王小艺, 曹一博, 张凌云,等. 油茶生长发育过程中脂肪酸成分的测定分析[J]. 中国农学通报, 2012, 28 (13) : 76-80
[10]孙美莲, 王云生, 杨冬青. 茶树实时荧光定量PCR分析中内参基因的选择[J]. 植物学报, 2010, 45 (5): 579-587
[11]肖钢, 张宏军, 彭琪, 等.甘蓝型油菜油酸脱氢酶基因(fad2)多个拷贝的发现及分析[J]. 作物学报, 2008, 34 (9): 1563-1568
[12]谭晓风, 袁德义, 袁军, 等. 大果油茶良种“华硕”[J]. 林业科学, 2011, 47(12): 150
[13]Mikkilineni V, Rocheford T R. Sequence variation and genomic organization of fatty acid desaturase-2 (fad2) and fatty acid desaturase-6 (fad6) cDNAs in maize[J]. Theoretical and Applied Genetics, 2003, 106: 1326-1332
[14]Schlueter J A,Vasylenko-Sanders I F, Deshpande S, et al. TheFAD2 gene family of soybean: Insights into the structural and functional divergence of a paleopolyploid genome[J]. Crop Science, 2007, 47: 14-26
[15]Hernández M L, Mancha M, Martinez-Rivas J M. Molecular cloning and characterization of genes encoding two microsomal oleate desaturases (FAD2) from olive[J]. Phytochemistry, 2005, 66: 1417-1426.
