大米抗性淀粉双酶制备及其结构表征
2014-06-11章萍萍孟少华袁怀波
周 颖 章萍萍 孟少华 王 勇 袁怀波
(合肥工业大学 生物与食品工程学院,合肥 230009)
抗性淀粉,是一种抗消化性淀粉,即不能在人体小肠中被消化吸收但却可以在大肠中被微生物分解的淀粉。抗性淀粉引起餐后血糖的波动较小,属于低GI碳水化合物。此外抗性淀粉进入大肠内发酵产生的短链脂肪酸能够降低结直肠癌的发病风险[1]。
目前制备抗性淀粉的方法主要有物理改性、化学改性和酶改性。阮少兰等[2]采用酸变性和沸水浴法制备大米抗性淀粉,其得率为12.7%。吴红引等[3]采用压热-酶法制备碎米抗性淀粉,其得率为16.8%,并利用X-射线衍射(X-RD)和电子扫描显微镜技术研究碎米抗性淀粉,得出其具有稳定的晶体结构。Wang等[4]用玉米淀粉、瓜尔豆胶和柠檬酸的混合物挤压制备抗性淀粉,其得率为16.2%。但是这些方法制得的抗性淀粉得率普遍较低,且来源于不同制备方法的抗性淀粉的抗消化能力无相关对比数据。本研究采用了α-淀粉酶与普鲁兰酶双酶协同处理的方法制备大米抗性淀粉,优化α-淀粉酶的最佳工艺条件,通过体外抗酶解试验衡量其抗消化能力,并进一步采用差示扫描量热仪(DSC)、电子扫描显微镜(SEM)和X-RD对双酶、单酶、湿热改性淀粉进行结构表征分析,旨在提高抗性淀粉的得率,增强抗性淀粉的抗消化能力,并且为抗性淀粉的生产提供理论依据。
1 材料与方法
1.1 材料
大米淀粉:金农生物有限公司;α-淀粉酶(4 000 u/g) 、糖化酶(100 u/mg):上海Kayon生物技术有限公司;普鲁兰酶(2 000 u/mL):锐阳生物;其他试剂均为分析纯。
1.2 仪器与设备
Q 200差示扫描量热仪:TA公司;XRF-1880 X射线荧光光谱仪:日本岛津公司;JSM-6490LV 扫描电子显微镜:日本电子制造公司;HH-2 数显恒温水浴锅:金坛市杰瑞尔电气有限公司;aR1140 电子分析天平:奥豪斯(上海)公司;SHY-2 水浴恒温振荡器:金坛市金城国胜实验仪器厂;KA-1000 台式离心机:上海安亭科学仪器厂;841Y—1 电热恒温烘箱:盐城申信电热机械有限公司;752 紫外可见分光光度计:上海光谱仪器有限公司。
1.3 方法
1.3.1 大米抗性淀粉制备
双酶法抗性淀粉的制备:准确称取大米淀粉20 g,加蒸馏水调成淀粉含量为25%的淀粉水溶液,用柠檬酸缓冲液调节淀粉溶液pH为6.0后于80 ℃条件下水浴加热20 min,糊化过程中需用搅拌机不停地搅拌淀粉以致糊化完全;冷却至室温后加入α-淀粉酶,α-淀粉酶的反应条件为pH 5.5,温度70 ℃,时间20 min,酶用量4 u/g;调节pH至4.5,加入4 u/g的普鲁兰酶,在气浴恒温振荡器中于46 ℃条件下反应12 h;接着将脱支后的淀粉溶液放置4 ℃冰箱中回生12 h;将回生后的淀粉溶液用冷冻离心机离心去除上清液;最后所得淀粉在60 ℃条件下干燥,研磨过200目筛,所得即为双酶法制得的抗性淀粉。
单酶法[5]抗性淀粉的制备:糊化方法同上。糊化后的淀粉直接加入普鲁兰酶,方法同上。研磨、过筛即为单酶法制得的抗性淀粉。
湿热法[6]抗性淀粉的制备:糊化方法同上。糊化后的淀粉沸水浴90 min;冷却后置于4 ℃冰箱中回生12 h;最后干燥、研磨、过筛。
1.3.2 单因素试验
单因素试验设计:α-淀粉酶的反应条件为pH 5.5,温度70 ℃,时间20 min,酶用量4 u/g,在其他条件不变的情况下,以抗性淀粉得率为考察指标,分别改变反应pH、温度、时间和用量。
1.3.3 抗性淀粉的测定
参照Goni[7]法。取0.5 g样品于50 mL离心管中,加入10 mL蒸馏水,用缓冲溶液调节pH为5.8后,加入过量α-淀粉酶沸水浴30 min;冷却至室温后,离心弃去上清液,再加入蒸馏水洗涤残留物,离心去上清液;加入6 mL浓度为2 mol/L的氢氧化钾溶液,振荡30 min至沉淀完全溶解后,调节pH为4.4,加入过量糖化酶,60 ℃水浴45 min;溶液冷却后离心并反复洗涤沉淀收集上清液,定容至100 mL,采用DNS法测溶液中还原糖的含量。
抗性淀粉含量=葡萄糖含量×0.9
抗性淀粉得率/%=抗性淀粉含量/总淀粉含量×100
1.3.4 抗酶解性测定[8]
分别称取3种淀粉样品5 g,配成10%的淀粉溶液,加入足量的耐高温α-淀粉酶,置于85 ℃的恒温水浴振荡器中,分别在反应时间为2、6、12、24 h时测定溶液中的还原糖含量。
1.3.5 抗性淀粉的结构研究方法1.3.5.1 差示扫描量热法[9]
称取少量抗性淀粉样品置于氧化铝坩埚中,密封后以空白皿为参比,然后以10 ℃/min的速率升温,扫描的温度范围为30~250 ℃。
1.3.5.2 扫描电子显微镜法[10]
将待测淀粉样品置于105 ℃的烘箱中干燥6 h,在红外灯下用双面胶将样品固定在样品台上,然后将进行喷金处理后的样品保存于干燥器中。观察并拍摄淀粉颗粒形貌。
1.3.5.3 X-射线衍射法[11]
测试前将样品在相对湿度为100%的干燥器中放置24 h以上,然后将淀粉样品放入X-射线衍射仪进行扫描测定,其操作条件为:起始角:4°;终止角:60°;步长:0.08;扫描速度:5 °/min;积分时间:2 s。
1.4 数据处理
试验数据分析和作图软件使用SPSS Statistics软件和Origin 7.5。数据分析采用平均值±标准偏差。所有试验均重复4次。
2 结果与分析
2.1 温度对抗性淀粉得率的影响
控制温度变量分别为50、60、70、80、90、100 ℃,其他条件保持不变,测定并计算抗性淀粉得率,结果见图1。

图1 温度对抗性淀粉得率的影响
由图1可知,RS的得率随温度的升高而升高,80 ℃时的得率最高;继续升温后抗性淀粉得率迅速下降。说明适当的升温有利于α-淀粉酶对淀粉进行降解,提高抗性淀粉的得率,但是温度过高导致淀粉过度降解,产生短直链淀粉,不利于抗性淀粉的形成。故最适反应温度为80 ℃。
2.2 pH对抗性淀粉得率的影响
调节溶液pH分别为4.5、5.0、5.5、6.0、6.5、7.0,其他条件保持不变,制备抗性淀粉,其得率如图2所示。

图2 pH对抗性淀粉得率的影响
由图2可以看出,在适宜条件(70 ℃, 4 u/g,40 min)下,抗性淀粉的得率随pH改变呈现先增后减的趋势,且当pH为5.5时,得率最高,这是因为在pH 5.5时,酶的活性最适,对淀粉的酶解作用最佳,酶解过度或不足都会使抗性淀粉的得率降低。故选择5.5为最佳反应pH。
2.3 时间对抗性淀粉得率的影响
控制反应时间分别为10、20、30、40、50、60 min,其他条件保持不变,制备抗性淀粉,其得率如图3所示。

图3 时间对抗性淀粉得率的影响
由图3可以看出在反应温度为70 ℃,酶用量4 u/g,pH 5.5的条件下,抗性淀粉得率随时间延长逐渐上升,在40 min时达到最高,之后随时间延长而下降。一定的酶解时间有利于淀粉分子酶解,并重新排布形成新的更稳定晶型;酶解过度会使淀粉分子中α-1,4糖苷键大量破坏,产生过多短链淀粉分子,不利于抗性淀粉的形成。
2.4 酶用量对抗性淀粉得率的影响
控制酶用量分别为0、2、4、6、8、10 u/g,其他条件保持不变,制备抗性淀粉,其得率如图4所示。
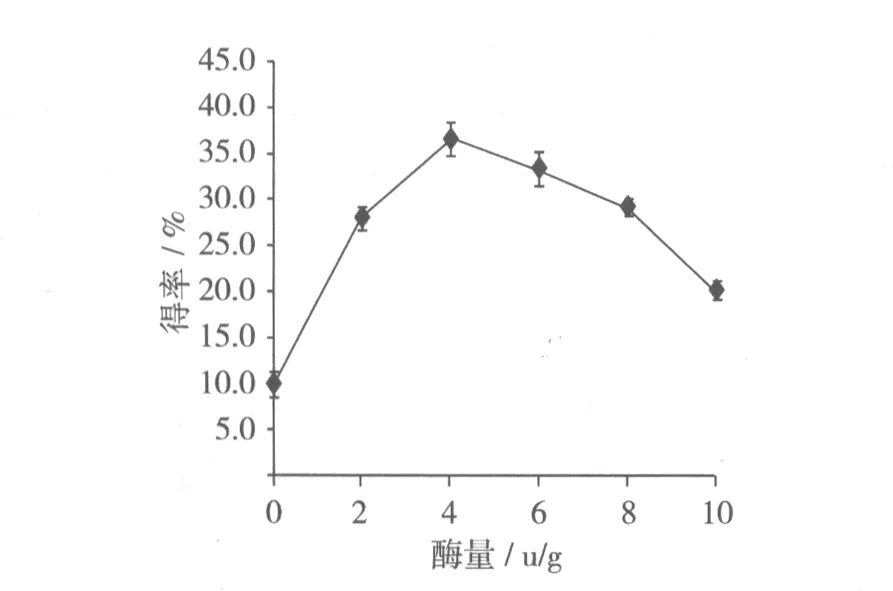
图4 酶用量对抗性淀粉得率的影响
抗性淀粉的得率随着酶用量的增加而提高,大于4 u/g时呈递减趋势。加入酶量少时,淀粉被切断程度不够,淀粉糊的黏度仍然很大[12],不易于直链淀粉分子相互接近形成结晶;加入酶量太大,黏度过低,也不利于抗性淀粉的形成。因此,酶添加量为4 u/g为最佳。
综上可以得出双酶法制备抗性淀粉的α-淀粉酶的最佳反应条件为:pH 5.5、温度80 ℃、反应时间40 min、酶用量4 u/g,在此条件下抗性淀粉的得率为45.2%。单酶法和湿热法制备抗性淀粉的得率分别为32.6%和15.4%。
2.5 抗酶解性测定
表1反映了3种抗性淀粉的抗酶解性。随着酶解时间的延长,3种抗性淀粉的酶解率均有增加,但是双酶法制得的抗性淀粉其酶解速率明显小于单酶法和湿热法制得的抗性淀粉。这是因为α-淀粉酶与普鲁兰酶双酶处理,淀粉分子被水解成短直链分子链,短直链分子之间通过氢键连接成紧密的双螺旋结构,形成新的结晶结构,从而减少淀粉分子与酶的结合位点,不易与酶结合而发生降解[13],因此具有较强的抗酶解性能。

表1 淀粉酶解率/%
注:所有结果均通过正负标准偏差计算 (n=4)。与湿热法RS相比,a 代表P<0.01,b 代表P<0.05。
2.6 扫描电镜观察
图5a~图5d分别为原大米淀粉、单酶法抗性淀粉、湿热法抗性淀粉以及双酶法抗性淀粉的电镜扫描图。观察图5a可以发现原大米淀粉颗粒表面是光滑的,呈不规则圆形或多边形;经热处理后如图5c,观察到淀粉颗粒呈现不规则、无统一形态,表面轮廓粗糙,且结构比较疏松;而经单酶处理后如图5b,淀粉颗粒呈现粗糙不规则的表面结构,结合较前2种淀粉相对紧密,但是颗粒表面却出现了裂痕或凹坑,并且可以观察到有很多堆叠密度较高的小碎片生成,有类似蜂巢状的结构出现;双酶法制备的抗性淀粉其颗粒结构如图5d所示,相比之下,其颗粒形貌呈现较大且紧凑的结晶,这得益于经过2种酶协同处理后,其短直链淀粉在回生条件下进行重组,形成螺旋结构,使得淀粉颗粒结构更加紧密不易被酶解的特性。

图5 4种淀粉的SEM观察
2.7 DSC差热分析
大米淀粉、单酶法抗性淀粉、湿热法抗性淀粉、双酶法抗性淀粉的DSC如图6所示。4种淀粉的相变峰值温度依次升高,分别为159、177 、180 、208 ℃。与原淀粉相比,抗性淀粉的起始糊化温度、峰值温度、终止温度和糊化焓具有显著的增加,其中双酶改抗性淀粉显示了较宽的糊化峰,糊化温度最高,这说明双酶改抗性淀粉中有序结构最多,其分子间作用力维持下的双螺旋结构最稳定,而有序的结构更容易形成稳定的结晶结构[14]。因此,双酶改抗性淀粉具有良好的热稳定性。

图6 4种淀粉的DSC图
2.8 淀粉的X-衍射分析
原淀粉、湿热法抗性淀粉、双酶法抗性淀粉和单酶法抗性淀粉的X-衍射图谱见图7。从图7中可以看出大米原淀粉在衍射角为15、17、18和23 °处有强吸收峰,是典型的A型结晶结构[15];湿热法抗性淀粉则没有很明显的衍射峰,说明在加热过程中,损坏了淀粉的结晶结构,呈现无序的结构状态;用普鲁兰酶处理后,抗性淀粉样品的衍射峰显示了新的结晶结构,其衍射角为12、14和19 °,为V型结构[16];结合α-淀粉酶处理之后,抗性淀粉的衍射峰较单酶法抗性淀粉又新增加了新的结晶构型,其衍射角为12、14、17、20和23 °,为B和V型混合结晶结构。这一结果表明这种结构对α-淀粉酶有更大的抗消化性。

图7 4种淀粉的X-射线图谱
3 结论
采用α-淀粉酶与普鲁兰酶协同作用的方法研究大米抗性淀粉的制备方法和结构表征。其中,通过单因素试验得出α-淀粉酶的最佳反应条件,使得抗性淀粉得率达到45.2%,而单酶法和湿热法制备的抗性淀粉得率仅分别为32.6%和15.4%,说明双酶法能够提高抗性淀粉的得率和含量。与此同时,抗酶解试验表明,在相同的水解条件和水解时间(2、6、12和24 h)下,双酶法抗性淀粉的水解率分别为6.55%、7.12%、7.55%和8.02%,而湿热法抗性淀粉和单酶法抗性淀粉均明显高于双酶法抗性淀粉的水解率,说明双酶法制得的抗性淀粉不仅得率高,而且具有良好的抗酶解作用。通过DSC、SEM和X-RD分析可以得出双酶法制得的抗性淀粉较湿热法和单酶法制得的抗性淀粉有糊化热性能稳定、空间结构紧密以及结晶度高等优点。
[1]张志英,沈福建. 抗性淀粉最新研究进展[J]. 粮油食品科技,2005,13(4):29-31
[2]阮少兰,刘亚伟,阮竞兰. 大米抗性淀粉制备工艺研究[J]. 粮食与饲料工业,2005(7):16-17
[3]吴红引,王泽南,张秋子,等. 压热-酶法制备碎米抗性淀粉的工艺及其结构特性研究[J]. 现代食品科技,2011(2):166-169
[4]Wang J,Jin Z Y,Yuan X P. Preparation of resistant starch from starch-guar gum extrudates and their properties[J]. Food Chemistry, 2007, 101:20-25
[5]Zhang H X,Jin Z Y. Preparation of resistant starch by hydrolysis of maize starch with pullulanase [J]. Carbohydrate Polymers, 2011, 83:865-867
[6]杨光,丁霄霖. 压热处理对抗性淀粉形成的影响[J]. 中国粮油学报,2001,16(3):45-47
[7]Goni I, Garcia-diz L, Manas E. Analysis of resistant starch: a method for foods and food product [J]. Food Chemistry, 1996, 56(4):445-449
[8]张斌,罗发兴,黄强,等. 不同直链含量玉米淀粉结晶结构及消化性研究[J]. 食品与发酵工业,2010,36(8):26-29
[9]金丽. 差示扫描量热技术在淀粉研究中的应用[J].食品与机械,2000(3):26-28
[10]孟庆虹,张守文,赵凯,等. 玉米抗性淀粉形成过程的研究[J]. 食品工业科技,2006(4):97-100
[11]蹇华丽,高群玉,梁世中. 抗性淀粉结晶性质的研究[J]. 食品科学,2003,24(7):44-47
[12]蹇华丽,高群玉,梁世中.抗性淀粉的酶法研制[J]. 食品与发酵工业,2002,28(5):6-9
[13]史苗苗. 蜡质玉米、稻米抗性淀粉的酶法制备及性质研究[D]. 广州:华南理工大学,2011
[14]Zhang H X,Jin Z Y. Preparation of products rich in resistant starch from maize starch by an enzymatic method[J]. Carbohydrate Polymers, 2011, 86:1610-1614
[15]徐斌,满建民,韦存虚. 粉末X射线衍射图谱计算植物淀粉结晶度方法的探讨[J]. 植物学报,2012,47(3):278-285
[16]覃海兵. 板栗抗性淀粉的制备及性质研究[D]. 恩施:湖北民族学院,2010.
